Takashi Maeda
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
8 Departamentul de Cardiologie și Neonatologie Pediatrică, Spitalul Municipal Ogaki, Ogaki, Japonia
Yoshiaki Sato
2 Divizia de Neonatologie, Centrul pentru îngrijiri materno-neonatale, Spitalul Universitar Nagoya, Nagoya, Japonia
Akihiro Hirakawa
3 Departamentul de Biostatistică și Bioinformatică, Școala Absolventă de Medicină, Universitatea din Tokyo, Tokyo, Japonia
Masahiro Nakatochi
4 Secțiunea de analiză statistică, Centrul pentru medicină avansată și cercetare clinică, Spitalul Universitar Nagoya, Nagoya, Japonia
Fumie Kinoshita
4 Secțiunea de analiză statistică, Centrul pentru medicină avansată și cercetare clinică, Spitalul Universitar Nagoya, Nagoya, Japonia
Takeshi Suzuki
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
Shintaro Ichimura
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
Ryoichi Ito
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
Ryuji Kudo
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
Michio Suzuki
4 Secțiunea de analiză statistică, Centrul pentru medicină avansată și cercetare clinică, Spitalul Universitar Nagoya, Nagoya, Japonia
Shin Hoshino
6 Departamentul de Pediatrie, Spitalul Orașului Kasugai, Kasugai, Japonia
Yuichiro Sugiyama
7 Departamentul de Pediatrie, Spitalul Anjo Kosei, Anjo, Japonia
Hideki Muramatsu
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
Hiroyuki Kidokoro
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
Jun-ichi Kawada
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
Yoshiyuki Takahashi
1 Departamentul de Pediatrie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
Divizia de Neonatologie, Centrul pentru Îngrijiri Materno-Neonatale Spitalul Universitar Nagoya, 65 Tsurumai-cho, Showa-ku, Nagoya, Aichi 466-8560, Japonia
TEL: + 81-52-744-2294, Fax: + 81-52-744-2974, Email: [email protected]
ABSTRACT
FUNDAL
Aproape toți sugarii înghit o cantitate de sânge matern în timpul nașterii. Cu toate acestea, nou-născuții care înghit o cantitate mare de sânge matern sunt considerați mai susceptibili de a experimenta probleme de hrănire decât cei care înghit mai puțin sânge matern. Se crede că prezența sângelui matern în stomac acționează ca un iritant chimic, provocând vărsături, secreții și intoleranță la hrănire (FI). FI poate duce la hipoglicemie, întârzierea stabilirii hranei pentru sân, necesitate de lichide parenterale și un risc crescut de infecții. Se crede că spălarea gastrică (GL) poate aduce beneficii acestor sugari prin îndepărtarea sângelui matern iritant.
În mod convențional, GL a fost efectuat în mai multe instituții pentru prevenirea problemelor de hrănire, prevenirea internării în unitatea de terapie intensivă neonatală. Anterior, mai multe rapoarte au arătat că la nou-născuții născuți cu lichid amniotic colorat cu meconiu, GL nu a avut un impact semnificativ în ceea ce privește reducerea problemelor de hrănire. 1-5 O recenzie sistematică recentă a arătat, de asemenea, că, deși au existat unele beneficii posibile ale GL la sugarii născuți prin lichior colorat cu meconiu, dovezile au fost limitate. 6 Din câte știm, până în prezent nu au existat rapoarte cu privire la efectul tratamentului GL asupra emezei măcinate cu cafea.
Cu toate acestea, inserția tubului nazogastric și GL ulterioară nu sunt întotdeauna fără complicații, inclusiv bradicardie, apnee, vărsături, traume, aspirație și/sau perforație esofagiană/gastrică. 7 Un raport anterior a arătat că aspirația gastrică efectuată la naștere este asociată cu un risc pe termen lung de tulburare intestinală funcțională. 8 Aspirarea gastrică de rutină poate supraestima FI și întârzia inițierea alăptării; în plus, au fost raportate, de asemenea, o ușoară creștere a tensiunii arteriale medii și o creștere a descărcării. 9
Acest studiu a fost conceput pentru a evalua siguranța și eficacitatea GL la nou-născuții care au înghițit o cantitate mare de sânge matern și au prezentat emeză de cafea măcinată și au diagnosticat melena falsă.
METODE
Proiectare și decorare
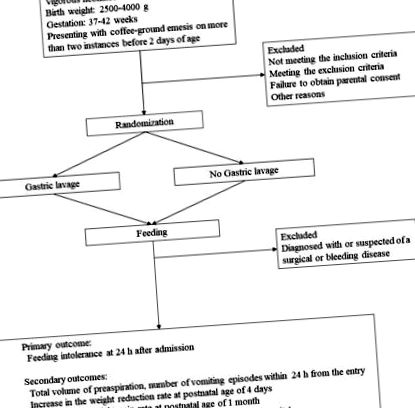
Acest studiu controlat randomizat, multicentric, neorbit, este coordonat la Spitalul Universitar Nagoya și efectuat la opt instituții (Spitalul Anjo Kosei, Spitalul Japonez Crucea Roșie Nagoya Daiichi, Spitalul Konan Kosei, Spitalul Universitar Nagoya, Spitalul Oraș Okazaki, Spitalul Municipal Ogaki, Spitalul Municipal Ogose, Tosei General Spital și Toyota Memorial Hospital). Figura prezintă o diagramă de flux a protocolului de studiu.
O diagramă a fluxului unui studiu controlat randomizat multicentric potențial care evaluează efectele spălării gastrice asupra emezei de cafea-măcinat la nou-născuți.
Considerare etică și înregistrare etică
Protocolul de studiu este în conformitate cu declarația de la Helsinki. Am obținut aprobarea de la comitetul etic de la Universitatea Nagoya pe 17 august 2017 (numărul IRB 2017-0405). Acest studiu a fost înregistrat la registrul de studii clinice UMIN sub numele de UMIN000026483 (http://www.umin.ac.jp/ctr/index.htm).
Criterii de eligibilitate
Criteriile de includere sunt următoarele:
• Starea viguroasă a nou-născuților, definită ca cea cu efort respirator puternic și tonus muscular bun
• Vârsta gestațională între 37w0d și 41w6d
• Greutatea la naștere: de la 2500 la 3999g
• Prezentarea cu emeză măcinată de cafea în mai mult de două cazuri înainte de vârsta de 2 zile
• Semne vitale normale și stabile, cum ar fi ritmul cardiac, tensiunea arterială și saturația de oxigen
• Acordarea în scris a consimțământului informat de către părinți pentru participarea la studiu
Criteriile de excludere sunt următoarele:
• Diagnosticat sau suspectat de o boală chirurgicală la examenul radiologic sau clinic
• Diagnosticat sau suspectat de sângerare gastro-intestinală, care necesită tratament
• Număr anormal de trombocite (≤100.000/mm 3) sau test de coagulare (PT ≥22 s, APTT ≥85 s) și boală hemoragică suspectată
• Prezența altor probleme, cum ar fi infecția sau suferința respiratorie, care necesită orice alte tratamente
• Prezența unei malformații congenitale majore
• Nerespectarea consimțământului informat al înlocuitorului
Înregistrarea pacientului
După confirmarea criteriilor de eligibilitate și obținerea consimțământului informat, pacienții eligibili vor fi înregistrați și alocați grupului GL care va primi GL sau grupului non-GL care nu va primi GL. Înscrierea va începe în aprilie 2018, iar randomizarea va fi efectuată de centrul de date independent al Spitalului Universitar Nagoya utilizând un software bazat pe web care generează un număr aleator și include o procedură de minimizare prin factori de prognostic (vârsta gestațională: ≤38 săptămâni sau> 38; greutatea corporală la naștere: ≤3000 g sau> 3000 g; scor Apgar de 5 minute: ≤7 sau ≥8).
Intervenţie
După ce a fost înscris în studiu și a fost alocat unui grup, fiecare pacient va primi perfuzie intravenoasă continuă și va fi introdus un tub nazogastric de 8-Fr. Tubul nazogastric va fi plasat corect sub îndrumarea examinării cu raze X abdominale. La nou-născuții aparținând grupului GL, GL se va efectua folosind o doză de 20 mL/kg de soluție salină normală care se va repeta până când fluidele de aspirație devin curate. Nou-născuții din grupul non-GL nu vor primi GL.
Nutriție enterală
Nutriția enterală va începe în 5 ore. Până la 24 de ore după începerea nutriției, nou-născuții vor fi hrăniți cu 10 ml la fiecare 3 ore. Personalul medical va verifica natura și cantitatea conținutului gastric înainte de a se hrăni de fiecare dată folosind tubul nazogastric, iar dacă conținutul gastric prezintă sângerări biliare sau proaspete, pacientul va fi exclus din acest studiu deoarece o boală chirurgicală sau sângerare gastro-intestinală nu pot fi exclus. Atunci când conținutul gastric este emeză măcinată de cafea, lapte nedigerat sau suc gastric, personalul medical îl va returna în stomac folosind un tub nazogastric și ulterior va continua să se hrănească. Indiferent de volumul rezidual, hrănirea va fi efectuată la pacienți fără a prezenta FI. La momentul prezentării FI, indiferent dacă continuă sau nu hrănirea, fie că returnează sau nu conținutul gastric, va fi decis la discreția medicului șef. .
Suspendarea protocolului
Tratamentul protocolar va fi încheiat dacă este diagnosticată sau suspectată o boală chirurgicală sau hemoragică; dacă au existat simptome ale tulburărilor respiratorii, circulatorii sau neurologice după prima hrănire; sau dacă apar evenimente adverse grave.
Definiția vărsăturilor, insuficienței, descuamării și intoleranței la hrănire
Vărsăturile sunt definite ca un episod de expulzare a conținutului gastric cu efort; regurgitarea este definită ca expulzarea fără efort a laptelui în timpul sau imediat după hrănire. Regurgitarea se poate distinge de vărsături prin examinarea conținutului; regurgitarea conține doar lapte, în timp ce vărsăturile pot conține și alte materiale alimentare. Secțiunea sau greața este definită ca tentativă de vărsătură fără expulzarea conținutului gastric.
FI se definește după cum urmează: (1) ≥2 episoade de vărsături în 4 ore sau ≥3 episoade în 24 de ore și/sau (2) eșecul hrănirii în cel puțin două ocazii din cauza repulsiei sau sugerii slabe.
REZULTAT
Rezultatul principal va fi FI în termen de 24 de ore de la momentul înscrierii la studiu. Rezultatele secundare vor include volumul rezidual total de preaspirare, numărul de episoade de vărsături în decurs de 24 de ore de la înscrierea în studiu, scăderea ratei de reducere a greutății la vârsta postnatală de 4 zile, creșterea ratei de creștere în greutate la vârsta postnatală de 1 lună și maxim bilirubină totală înainte de a fi externată din spital.
Determinarea mărimii eșantionului și luarea în considerare statistică
Mărimea eșantionului din acest studiu este calculată pentru a obține o putere de testare de 80% cu o rată de eroare α de 5,0% în ipoteza că proporțiile pacienților cu FI pentru grupurile GL și non-GL sunt de 80% și respectiv 50%. Astfel, vom înscrie patruzeci de pacienți pentru fiecare grup. Analiza principală pentru obiectivul primar este testul chi-pătrat al lui Pearson. Diferențele dintre variabilele continue ale grupurilor GL și non-GL vor fi analizate folosind teste t cu două eșantioane sau teste Mann-Whitney U pentru date distribuite în mod normal. Variabilele categorice vor fi analizate folosind testul chi-pătrat Pearson sau testul exact al lui Fisher. P 7 tulburarea intestinală funcțională, 8 și/sau inițierea întârziată a alăptării pot fi prevenite.
CONFLICTUL DE INTERES
Autorii nu au conflicte de interese de dezvăluit.
Echipa de cercetare clinică colaborativă din Nagoya
Masahiro Hayakawa 2, Yuichi Kato 7, Makoto Oshiro 9, Seiji Hayashi 10, Takashi Tachibana 8, Kuniko Ieda 11, Hikaru Yamamoto 12, Koji Takemoto 13
9 Departamentul de Pediatrie, Crucea Roșie japoneză Spitalul Nagoya Daiichi, Nagoya, Japonia,
10 Departamentul de Pediatrie, Spitalul Oraș Okazaki, Okazaki, Japonia
11 Departamentul de Pediatrie, Spitalul General Tosei, Seto, Japonia
12 Departamentul de Neonatologie, Spitalul Toyota Memorial, Toyota, Japonia
13 Departamentul de Pediatrie, Spitalul Konan Kosei, Konan, Japonia
- Efectele dimensiunii particulelor emulsiei lipidice asupra sațietății și aportului de energie, un studiu randomizat încrucișat
- Efectele unui program pediatric de gestionare a greutății cu și fără jocuri video active, randomizat
- Efectele micului dejun de cereale cu fulgi de ovăz și fulgi de porumb asupra sațietății, golirii gastrice, glucozei și
- Efectele micului dejun de cereale cu fulgi de ovăz și fulgi de porumb asupra sațietății, golirii gastrice, glucozei și
- Combinarea tratamentului de scădere în greutate comportamentală și un program comercial Un studiu clinic randomizat -