Victoria S. Shubina
Institutul de biofizică teoretică și experimentală, Academia Rusă de Științe, Institutskaya 3, Pușchino, Regiunea Moscova, Rusia 142290
Yuri V. Shatalin
Institutul de biofizică teoretică și experimentală, Academia Rusă de Științe, Institutskaya 3, Pușchino, Regiunea Moscova, Rusia 142290
Abstract
S-a examinat condensarea taxifolinei cu acid glioxilic, iar proprietățile produsului rezultat au fost comparate cu cele ale taxifolinei. Structura produsului a fost determinată prin spectroscopie RMN. Capacitatea polifenolilor de a elimina speciile reactive de oxigen (ROS) a fost estimată prin chemiluminescență dependentă de luminol. Activitățile de chelatare și reducere a fierului au fost studiate folosind spectrofotometria de absorbție. S-a arătat că condensarea duce la formarea unui dimer format din două unități de taxifolin legate printr-o punte de carboximetină la pozițiile C-6 și C-8 ale inelului A. Dimerul a prezentat o activitate de eliminare a ROS puțin mai mare decât taxifolina. Capacitatea de legare a fierului a compușilor a fost proporțională cu numărul de unități de polifenol. Capacitatea de reducere a fierului dimerului a fost mai mică decât cea a taxifolinei. Astfel, dimerul posedă o activitate antioxidantă mai mare decât flavonoidul părinte. Datele obținute pot fi utile pentru o mai bună înțelegere a proceselor care apar în alimente și băuturi și pentru o căutare de noi compuși activi.
Introducere
Materiale și metode
Produse chimice
Sare monosodică a acidului glioxilic monohidrat, acid ascorbic, dimetil sulfoxid-d6 (d6-DMSO), benzen, 3- (2-piridil) -5,6-difenil-1,2,4-triazin-4,4'-disulfonic hidrat (ferrozină), 5-amino-2,3-dihidro-1,4-ftalazinedionă (luminol) și peroxidază de hrean (150 U/mg) au fost cumpărate de la Sigma-Aldrich (SUA). Taxifolinul a fost furnizat cu amabilitate de Flamena (Rusia). Soluția salină tamponată cu fosfat provenea din Paneco (Rusia). Sulfatul de fier (II), clorura de fier (III), peroxidul de hidrogen, acidul clorhidric, acidul acetic și acetat de sodiu au fost obținute de la Reakhim (Rusia). Tetrahidrofuran, acetonă și etanol au fost cumpărate de la Panreac (Spania). Toate substanțele chimice au fost de calitate analitică. Toate soluțiile au fost preparate folosind apă distilată purificată printr-un sistem Milli-Q (Millipore SUA).
Sinteza și caracterizarea
Pe scurt, 148 mg de acid glioxilic și 20 pl de acid clorhidric concentrat au fost adăugați la soluția de taxifolin (608 mg) în 5 ml de tetrahidrofuran. Amestecul a fost refluxat timp de 2 ore. Progresul reacției a fost monitorizat prin cromatografie în strat subțire [Rf pentru produsul rezultat și taxifolin a fost 0,242 și respectiv 0,387; eluantul a fost un amestec benzen-acetonă-etanol 8: 2: 1 (v/v/v)]. Solventul a fost îndepărtat sub presiune redusă, rezultând formarea de ulei. Apoi produsul de condensare a fost izolat sub formă de sare de sodiu, spălat cu etanol încălzit pentru a îndepărta compușii de pornire nereacționați și uscat sub vid.
Caracteristicile structurale ale produsului rezultat au fost determinate prin spectroscopie RMN (1 H, 13 C, HSQC, HMBC). Spectrele 1 H, 13 C, HSQC și HMBC au fost măsurate pe un spectrometru Bruker Avance-III 600 la 600 (pentru proton) și 150 MHz (pentru carbon). Produsul a fost dizolvat în d6-DMSO.
Activitatea de eliminare a ROS
Interacțiunea polifenolilor cu ionii de fier
Datorită solubilității scăzute a hidroxizilor de fier formați în soluție în timpul hidrolizei sărurilor de fier, studiul a fost efectuat în tampon de acetat la pH 5,4
Activitatea de chelatare a fierului
Activitate de reducere a fierului
Activitatea de reducere a fierului a polifenolilor a fost estimată utilizând o metodă modificată de ferrozină (Mira și colab. 2002). Complexul format între ferrozină și Fe 2+ a fost detectat pe un cititor de microplăci Tecan Infinite F200 (Austria) în plăci cu 96 de godeuri (Greiner) la 562 nm la 37 ° C. Pe scurt, s-au preparat soluții care conțin ferrozină (1 mM) și polifenoli sau acid ascorbic la diferite concentrații (12, 18, 26, 40, 59, 90 uM). Apoi, o soluție de clorură de fier (III) (la o concentrație finală de 100 uM) a fost adăugată amestecurilor. Absorbanța a fost înregistrată după 0,5, 1, 2, 3 și 4 ore. Concentrația de Fe 2+ a fost evaluată printr-o curbă de calibrare obținută utilizând soluții de FeSO4 (un interval de concentrație de la 0,8 la 120 µM).
Acidul ascorbic, care este capabil să elimine ROS și să reducă ionii metalelor de tranziție, a fost folosit ca antioxidant standard.
Prelucrarea statistică a datelor a fost efectuată cu ajutorul programului MS Excel 2003. Valorile sunt prezentate ca medie ± eroare standard a mijloacelor a trei până la șase experimente independente.
Rezultate
Caracterizarea produsului rezultat
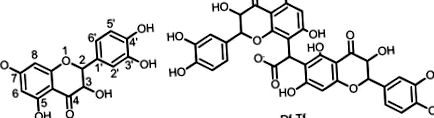
Ca rezultat al condensului, s-a obținut o pulbere galben deschis. Spectrul UV al produsului dizolvat în PBS a arătat banda maximă de absorbție la 224, 290 și 332 nm. Aceste benzi de absorbție sunt tipice pentru flavonoide. Absorbanța produsului la o concentrație de 21,28 μg/ml la 332 nm a fost aceeași cu cea a taxifolinului la o concentrație de 9,12 μg/ml. Deoarece concentrația produsului a fost crescută la 64,5 μg/ml și mai mult, a apărut în spectru o nouă bandă de absorbție centrată la 512 nm. În schimb, soluțiile de taxifolin nu s-au absorbit în regiunea vizibilă. Solubilitatea produsului în soluții de apă a fost de peste 10 ori mai mare decât cea a taxifolinului. Logaritmul coeficientului de partiție (logP) pentru produs a fost de 1,13 ± 0,12, în timp ce logP pentru taxifolin a fost de 1,64 ± 0,17.
tabelul 1
Caracteristicile RMN (1 H, 13 C, HMBC) ale produsului rezultat
| 2 | 83,02; 83,28 (CH) | 4,85 (2 H, m) | C-2, C-3, C-1 ′, C-2 ′, C-6 ′ |
| 3α | 71,87; 71,97 (CH) | 4,34 (2 H, m) | C-2, C-3, C-1 ′ |
| 4 | 196,91, 196,09 (C = O) | - | - |
| HCCOO - | 68,49 (CH) | 5,11 (1 H, s) | HCCOO -, C-4a, C-7, C-8a, COO - |
| 4a | 108,48 | - | - |
| 5 | 161,76, 161,87 (C) | 12.11 (s, OH) | - |
| 6 | 97,63; 97,48 (CH) | 5,57 (1 H, s) | C-4a, C-6, C-7 |
| 7 | 163,18 (C) | 12,80 (s, OH) | - |
| 8 | 98,71; 98,51 (CH) | 5,63 (1 H, s) | C-4a, C-8 |
| 8a | 160,11; 160,25 (C) | - | - |
| 1 ′ | 128,92 (C) | - | - |
| 2 ′ | 115,58; 115,66 (CH) | 6,72 (2 H, m) | C-2, C-1 ′, C-2 ′, C-3 ′ |
| 3 ′ | 145,39 (C) | 9.00 (br s, OH) | - |
| 4 ′ | 146,10; 146,17 (C) | 9.00 (br s, OH) | - |
| 5 ′ | 115,71; 115,79 (CH) | 6,75 (2 H, m) | C-4 ′, C-5 ′, C-6 ′ |
| 6 ′ | 119,52; 119.70 (CH) | 6,88 (2 H, m) | C-4 ′ |
| COO - | 176,35; 173.40 (COO -) | - | - |
Structuri de taxifolin și produsul rezultat
Activitatea de eliminare a ROS
Activitatea de eliminare a ROS a polifenolilor a fost comparată utilizând un sistem de luminol - H2O2 - hrean peroxidază. Rezultatele au arătat că taxifolina și Df-Tf au prezentat o activitate ridicată de eliminare a ROS (Fig. 2 a). LCL integral în prezența ambilor polifenoli a scăzut într-o manieră dependentă de doză (Fig. 2 b). Concentrația inhibitoare jumătate maximă (IC∫50) pentru taxifolină și Df-Tf a fost de 0,58 ± 0,04 și respectiv 0,42 ± 0,03 µM. Valoarea IC∫50 a acidului ascorbic utilizat ca antioxidant standard a fost de 4,60 ± 0,05 µM (datele nu sunt prezentate).
Efectul compușilor polifenolici asupra chimioluminiscenței. A Amplitudini și cinetica chemiluminescenței în control și în prezența polifenolilor. b Comparația efectului polifenolilor asupra chimioluminescenței integrale. Valorile sunt media ± erori standard de trei până la șase experimente independente
Activitatea de chelatare a fierului
Proprietățile de chelare a metalelor taxifolinului au fost studiate anterior (Mladěnka și colab. 2011; Říha și colab. 2014; Shatalin și Shubina 2014; Shubina și Shatalin 2013; Teixeira și colab. 2005). S-a constatat că taxifolina formează complexe cu ioni de fier (II), dovadă fiind apariția de noi benzi de absorbție în regiunea vizibilă (Shatalin și Shubina 2014; Shubina și Shatalin 2013). Raportul stoichiometric și spectrele de absorbție ale complexelor depind de condițiile de testare (pH, solvent, putere ionică) (Shatalin și Shubina 2014; Shubina și Shatalin 2013). În prezentul studiu, polifenolii au fost titrați printr-o soluție de Fe (II) în tampon de acetat la pH 5,4. Spectrele de absorbție au arătat noi benzi de absorbție centrate la 425 și 685 nm pentru taxifolin și la 460 nm pentru Df-Tf au apărut, indicând formarea complexelor polifenol-fier (Fig. 3). În același timp, intensitatea absorbției s-a modificat în funcție de timp (Fig. 4). Aceasta sugerează că amestecul nu a fost echilibrat. Prin urmare, raportul stoichiometric al complexelor a fost determinat pe baza datelor cinetice privind modificările absorbției la diferite rapoarte [Fe 2+]/[polifenol] (Fig. 4). Rezultatele noastre demonstrează că raportul stoichiometric al complexelor polifenol - Fe 2+ este 1: 4 și 1: 2 pentru Df-Tf și, respectiv, taxifolin.
Spectre de absorbție ale complexelor polifenol - Fe 2+ în tampon acetat, pH 5,4. A Absorbția taxifolinei în prezența diferitelor concentrații de Fe 2+. b Absorbția produsului rezultat în prezența concentrațiilor diferite de Fe 2+
Absorbția polifenolului - complexe Fe 2+ în funcție de timp. A Taxifolin - complexe Fe 2+; b Df-Tf - complexe Fe 2+; c absorbția complexelor taxifolin - Fe 2+ la 620 nm față de raportul molar Fe 2+/taxifolin; d Absorbția complexelor Df-Tf - Fe 2+ la 495 nm față de raportul molar Fe 2+/Df-Tf. Raporturile Fe 2+/polifenol au fost variate de la 0,1 la 18,4. Concentrația finală de polifenoli a fost de 250 uM. Concentrația finală de acid ascorbic a fost de 100 uM
Activitate de reducere a fierului
Pentru a examina capacitatea polifenolilor de a reduce ionii de fier, dependența concentrației Fe 2+ de concentrația polifenolului a fost determinată la pH 5,4 după 0,5, 1, 2, 3 și 4 h de incubație cu o soluție de FeCl3 (Fig. 5) . Acidul ascorbic, care este capabil să reducă doi echivalenți de ioni ai metalelor de tranziție, a fost utilizat ca reductant standard. S-a arătat că ambii polifenoli reduceau ionii Fe (III); concentrația ionilor Fe (II) în prezența Df-Tf a fost mai mică decât cea în prezența taxifolinului și a fost ușor dependentă de concentrația Df-Tf din sistem (în intervalul de concentrație de la 12 la 90 µM). În special, o creștere a concentrației Df-Tf de la 12 la 90 µM a dus la reducerea ionilor de fier de la 33 ± 3 la 38 ± 3 µM după 4 ore, în timp ce o creștere a concentrației de taxifolin de la 18 la 90 µM a dus la reducerea ionilor de fier de la 48 ± 4 la 93 ± 8 µM. O comparație a activității de reducere a taxifolinei cu cea a acidului ascorbic a arătat că, deși acidul ascorbic la concentrații scăzute reacționează mai rapid cu ionii de fier decât taxifolina, taxifolina reduce în cele din urmă mai mulți ioni de fier (Fig. 5).
Reducerea ionilor de fier în prezența polifenolilor și a acidului ascorbic la diferite concentrații. Concentrația FeCl3 este de 100 μM. Valorile sunt media ± deviația standard a trei experimente independente
Discuţie
Activitatea antioxidantă a polifenolilor depinde de numărul și localizarea grupărilor hidroxil aromatice (Chen și colab. 1996). În special, s-a observat o activitate ridicată de eliminare a radicalilor pentru polifenoli care conțin fragment catecol (Rice-Evans și colab. 1996). Prezența grupărilor hidroxil în poziția orto în inelul B asigură delocalizarea densității electronilor și stabilitatea sporită a radicalului format ca urmare a interacțiunii compușilor cu ROS (Foti și colab. 1996). Prezența grupărilor 5- și 7-OH în inelul A contribuie, de asemenea, la activitatea antioxidantă a polifenolilor (Rice-Evans și colab. 1996). Taxifolina și Df-Tf au aceste caracteristici structurale și prezintă o activitate ridicată de eliminare a ROS, susținând ideea că aceste grupuri sunt responsabile pentru activitatea de eliminare a ROS a polifenolilor (Rice-Evans și colab. 1996). O comparație a proprietăților de eliminare a ROS ale taxifolinei și Df-Tf arată că concentrația molară necesară pentru inhibarea 50% a LCL pentru Df-Tf este de 1,4 ori mai mică decât cea pentru taxifolin. Aceste rezultate sunt, de asemenea, în acord cu datele din literatura de specialitate, care demonstrează că activitatea antioxidantă a polifenolilor oligomerici se corelează pozitiv cu gradul de polimerizare (Jerez și colab. 2007; Zhou și colab. 2014).
De asemenea, trebuie remarcat un lucru important. După cum arată rezultatele noastre, Df-Tf este dizolvat mai ușor în soluții de apă decât taxifolin, indicând faptul că condensarea polifenolilor cu aldehide duce la formarea de produse care sunt distribuite diferit între fazele hidrofobe și hidrofile decât flavonoidele părinte. O solubilitate ridicată a polifenolului în una din cele două faze duce la acumularea acestuia în interiorul acestei faze. Prin urmare, proprietățile hidrofobe/hidrofile și conținutul de polifenoli condensați din alimente și băuturi vor influența biodisponibilitatea și proprietățile fracției polifenolice. Conform datelor din literatura de specialitate, polifenolii hidrofili pot acționa ca antioxidanți puternici în sistemele de emulsie a uleiului în apă (Pazos și colab. 2005). S-a sugerat că polifenolii foarte solubili în apă pot interacționa cu faza hidrofobă prin intermediul nucleului lor hidrofob, rezultând localizarea acestor compuși la interfața lipidică unde pot proteja mai eficient lipidele de oxidare (Pazos și colab. 2005). Pentru a estima acțiunea Df-Tf în sistemele care conțin lipide, sunt necesare studii suplimentare.
Concluzie
Rezultatele obținute în prezentul studiu au indicat că reacția taxifolinului cu acidul glioxilic a dus la formarea 6-8 dimerului (Df-Tf), care a constat din două unități de taxifolin legate prin puntea carboximetinei la C-6 și C- 8 poziții ale inelului A. Comparația proprietăților Df-Tf și taxifolin a arătat că Df-Tf a prezentat activități mai mari de eliminare ROS și legare a metalelor decât taxifolinul. În plus, concentrația ionilor Fe (II) în prezența Df-Tf a fost mai mică decât cea în prezența taxifolinului. În total, aceste rezultate au indicat faptul că Df-Tf posedă o activitate antioxidantă mai mare decât flavonoidul părinte. Interacțiunile posibile ale produsului cu fazele hidrofile și hidrofobe trebuie, de asemenea, luate în considerare în investigațiile ulterioare pentru o estimare mai cuprinzătoare a acțiunii sale.
- Proprietăți antioxidante și chelante cu fier ale taxifolinei și ale produsului său de condensare cu glioxilic
- 5 cele mai bune alimente pentru câini pentru câinii de pastor englezi vechi (recenzii actualizate în 2020) - culegător de produse pentru câini
- AO Booster - Nutriție cu ciocan de susținere a antioxidantului suprem
- 5 pași pentru a vă aduce produsul pe rafturile magazinelor
- 5 cele mai bune alimente pentru câini pentru teckel (recenzii actualizate în 2020) - Cules de produse pentru câini