Abstract
Introducere
Interesul pentru terapiile naturale a crescut dramatic în mediile urbane pentru tratarea bolilor minore și cronice. Creșterea vânzărilor de medicamente pe bază de plante se datorează și percepției că consumul de produse naturale ar fi sigur. Cu toate acestea, o astfel de percepție nu este întotdeauna adevărată, deoarece „natural” nu este sinonim cu „inofensiv”. De asemenea, adulterările pe bază de plante sau identificarea incorectă constituie o problemă reală și un risc latent pentru sănătate.
Baccharis L. speciile, Asteraceae, cunoscute popular ca „carquejas”, sunt disponibile pe scară largă în natură și sunt extrem de utilizate și comercializate. Părțile lor aeriene au fost utilizate în mod tradițional pentru a corecta disfuncțiile digestive (Hieronymus 1882). Mai mulți acizi fenolici și flavonoizi au fost identificați în Baccharis specii (Ramos Campos et al. 2016, printre altele). Extractele și componentele pure ale acestor specii au prezentat diferite activități biologice (Oliveira și colab. 2005; de Oliveira și colab. 2012; Rodriguez și colab. 2013, 2016). Infuzii de cinci „carquejas”, trei dintre ele, adică.,Baccharis articulata (Lam.) Pers., B. crispa Spreng. Și B. tundător (Mai puțin.) DC., Sa dovedit a crește fluxul biliar (BF) la șobolanii Wistar (Cifuente și colab. 2010). Aparat de tuns Baccharis a fost inclus în Brasileira (2010) și Lista națională a plantelor medicinale de interes din sistemul brazilian Sistema Único de Saúde (SUS) (Lista Renisus 2009), întrucât B. articulata și B. crispa sunt droguri oficiale în Farmacopea Nacional Argentina (1978). Cu toate acestea, se știe că altul Baccharis se folosesc specii în locul drogurilor oficiale. O analiză a probelor comerciale a arătat că Baccharis spicata (Lam.) Baill. este adesea folosit pentru a înlocui cei trei oficiali Baccharis (Barboza și colab. 2001).
Baccharis spicata este, de asemenea, cunoscut sub numele de „carqueja” și este utilizat ca plantă medicinală în America de Sud (Zardini 1984; Barboza și colab. 2009). Simone și colab. (2004) și Retta și colab. (2009) au afirmat că părțile lor aeriene au fost utilizate ca diuretice și digestive în medicina populară. Derivații fenolici (Oliveira și colab. 2004; Rodriguez și colab. 2016), și anume, rutina flavonoidă și derivații cofeoilquinici (Agudelo și colab. 2016), au fost raportate în extracte din această specie. Acizii cafeoilchinici s-au dovedit a fi principalii compuși responsabili de proprietățile hepatoprotectoare la unele plante medicinale (Basnet și colab. 1996; Azzini și colab. 2007).
Rozătoarele mici sunt modele ideale pentru examinarea efectului medicamentelor pe bază de plante asupra funcției hepatice prin evaluarea debitelor biliare. Pe de altă parte, măsurarea markerilor serici ai funcției hepatice și renale poate fi utilizată pentru a evalua dacă alți parametri fiziologici relevanți sunt afectați de medicamentul pe bază de plante (Cifuente și colab. 2010; Gonzalvez și colab. 2017). Examinarea farmacologică și toxicologică, precum și analizele botanice și fitochimice, sunt necesare pentru a confirma eficacitatea și riscurile potențiale pentru sănătate ale B. spicata extrase.
Luând în considerare aceste date, activitatea coleretică a extractului de etanol brut formează părți aeriene și fracții derivate din B. spicata a fost analizat în această lucrare. În plus, a fost efectuat un studiu chimic pentru a evalua controlul calității medicamentelor pe bază de plante.
Materiale și metode
Material vegetal
Părți aeriene ale Baccharis spicata (Lam.) Baill., Asteraceae, au fost colectate cu flori și identificate în Argentina, Provincia Santa Fe, departamentul San Lorenzo, orașul Roldán, la 32 ° 54 ′ 04 ″ S, 60 ° 54 ′ 26 ″ O, 24/III/2014 și identificată de Rodriguez M.V. (Voucher UNR numărul MVR 2045). Un exemplar de B. spicata a fost depus în Herbarul Universității Naționale din Rosario (voucher UNR numărul M.V.Rodriguez nr. 2045).
Extracte de plante și partiționare
Părți aeriene uscate de B. spicata (600 g) au fost extrase cu etanol la temperatura camerei, concentrate într-un evaporator rotativ și denumite Bstot. Bstot (10 mg) a fost dizolvat în etanol: H2O (5: 5) și repartizat succesiv cu n-hexan, cloroform, etil eter și acetat de etil. Pentru studii ulterioare, fracția apoasă rămasă (Bsaq) a fost liofilizată, iar fracția de acetat de etil a fost concentrată sub presiune redusă (Bsea).
Analiza cromatografică
Analizele HPLC UV/DAD au fost efectuate pe un instrument din seria Agilent 1200 folosind o coloană Phenomenex® C18 (Luna, 250 mm × 4,6 mm; 5 μm) în aceleași condiții de gradient descrise de Aboy și colab. (2012).
Analiza HPLC-MS a fost efectuată utilizând un sistem din seria Ultimate 3000 RSLC (Dionex – Thermo Scientific, Waltham, MA, SUA), echipat cu sursă de ionizare prin electrospray încălzit (H-ESI II) în aceleași condiții descrise de Aboy și colab. (2012). MS au fost realizate de ESI în modul pozitiv, cu tensiunea capilară la 5000 V, temperatura sursei 360 ° C și temperatura de desolvatare 310 ° C cu azot ca gaz de nebulizator.
Analiza HPTLC a fost efectuată utilizând un sistem HPTLC CAMAG (Muttenz, Elveția) echipat cu un eșantionator automat (ATS4). Probele au fost aplicate într-o placă de silicagel 60F254 TLC și dezvoltate în ADC2 cu saturație în cameră (20 min) și 33% umiditate relativă. Placa a fost detectată sub UV cu software-ul Vision CATS (CAMAG).
Animale și tratament
Șobolanii masculi Wistar (300-350 g) au fost hrăniți ad libitum cu o dietă standard normală și apă și menținută într-o perioadă de 12 ore întuneric-deschis. Protocoalele experimentale au fost efectuate conform „Ghidului pentru îngrijirea și utilizarea animalelor de laborator” (Institutele Naționale de Sănătate, Publicația nr. 86–23, 1985, revizuită în 1996) și aprobate de Comitetul local de îngrijire și utilizare a animalelor (Permisiuni 393/2015 și 217/2018, FBioyF, UNR). Animalele au fost împărțite aleatoriu în șase grupuri (n = 5 fiecare).
Grupul de control pozitiv a primit o injecție intravenoasă în bolus cu taurocolat (TC; Sigma-Aldrich) la 8 μmol/100 g greutate corporală (Marrone și colab. 2016). Grupul de control (C) a primit prin gavaj vehiculul fiecărui extract și alte trei grupuri au primit Bstot la 50 (Bstot50), 100 (Bstot100) sau 200 (Bstot200) mg/kg greutate corporală pe zi, timp de trei zile consecutive. Celelalte două grupuri au fost tratate prin gavaj cu fracțiuni Bsaq și Bsea la 100 mg/kg greutate corporală, urmând același program ca cel descris mai sus.
Proceduri experimentale
Procedurile chirurgicale au fost efectuate în ziua 4. Animalele au fost anesteziate cu o singură doză de ketamină/xilazină (100 și respectiv 3 mg/kg greutate corporală) și au fost menținute în această condiție pe tot parcursul experimentului. După o incizie abdominală mijlocie, conducta biliară comună a fost canulată, iar bila a fost colectată în tuburi pre-cântărite, la fiecare 10 minute timp de 40 de minute. La sfârșitul fiecărui experiment, animalele au fost eutanasiate prin exsanguinare, iar ficatul a fost îndepărtat și cântărit.
Determinarea debitului biliar și a concentrației sărurilor biliare
Debitul biliar (μl/min g greutate hepatică) a fost estimat prin gravimetrie, presupunând o densitate biliară de 1 g/ml. Concentrația sărurilor biliare a fost evaluată utilizând procedura 3α-hidroxisteroid dehidrogenazei (Talalay 1960). Producția biliară a sării biliare a fost calculată din concentrația BS și valorile BF.
Markeri serici ai funcției hepatice și renale
Concentrația serică a creatininei și activitățile fosfatazei alcaline (ALP), alaninei și aspartatului aminotransferazelor (ALT și, respectiv, AST), au fost determinate folosind truse comerciale (un cadou bun de la Wiener Lab., Rosario, Argentina).
Analiza Western Blot
S-au obținut lizate hepatice și s-a determinat concentrația de proteine conform metodei Lowry (Lowry și colab. 1951). Studiile Western blot au fost efectuate așa cum a fost descris anterior de laboratorul nostru (de Luján Alvarez și colab. 2002) folosind anticorpul de colesterol 7α-hidroxilază purificat de afinitate de iepure (CYP7A1, ab106060, Abcam, Cambridge, Marea Britanie) și anticorpul secundar conjugat cu peroxidază. Benzile de proteine au fost detectate de sistemul de detectare ECL și cuantificate prin densitometrie utilizând software-ul Gel-Pro Analyzer (Media Cybernetics, Silver Spring, MD, SUA). Sarcina egală și transferul de proteine au fost verificate prin detectarea β-actinei (Sigma-Aldrich) și colorarea Ponceau S a membranelor.
Histologie
Probele de ficat și rinichi din grupurile experimentale au fost fixate în 10% v/v soluție de formalină și încorporată în parafină cu topire scăzută. Cinci secțiuni micronice au fost colorate cu hematoxilin-eozină. Secțiunile renale au fost, de asemenea, colorate cu PAS.
Analize statistice
Rezultatele sunt exprimate ca medie ± SE. Semnificația diferențelor a fost testată de ANOVA unidirecțională; în cazul semnificației, a fost aplicat și un test Tukey. Diferențele au fost considerate semnificative atunci când p valoarea a fost
Rezultate si discutii
Analiza chimică a B. spicata extractul părților aeriene și fracțiunile au fost efectuate prin HPTLC în care au fost detectate în principal benzi fluorescente albastre care corespund probabil acizilor carboxilici (Fig. S1A). Benzi care migrează împreună cu acidul clorogenic (T1 Rf
0,4) și acid 3,5-dicaffoeilquinic (T2Rf
0,85) au fost, de asemenea, detectate. Aceste fracții au fost analizate în continuare în conformitate cu testul HPLC al acizilor cafeicoilchinici (CQA) în B. tundător dezvoltat anterior de Aboy și colab. (2012). Mai multe rapoarte au descris abordările HPLC pentru analiza CQA. A fost ales acetonitril în locul fazei mobile bazate pe metanol, deoarece arată cea mai bună rezoluție de vârf (datele nu sunt prezentate). Figura S1 prezintă cromatogramele obținute pentru Bstot (Fig. S1B), Bsea și Bsaq (Fig. S1C și respectiv D). Pentru ultimele fracții, spectrele UV echivalente au fost observate indicând CQA drept compuși principali, dar în cromatograma Bstot a fost detectat un vârf puternic suplimentar. De-a lungul întregului vârf detectat de DAD, puritatea derivaților CQA a fost determinată prin analiză spectrală. Procesul de fracționare a facilitat detectarea CQA. Vârfurile 1 și 2 au prezentat același ion la m/z 355 [M + H] +, care corespunde acizilor monocafeoilquinici (MQA) (Fig. S2A).
În conformitate cu rapoartele anterioare (Simões-Pires și colab. 2005), secvența de eluare a vârfurilor 1 și 2 a coincis cu 3-Oh și 5-Oh-acizi cafeoilchinici. Experimentele de coeluție HPLC cu probe standard au identificat ambii compuși în fracția apoasă. În conformitate cu rezultatele noastre, Agudelo și colab. (2016) au descris și prezența a 5-Oh-acid cafeoilchinic și 3,4-; Acizi 3,5- și 4,5-dicaffoeilquinici în B. spicata. Pe baza acestor rezultate, pe secvența de eluare și spectrele UV tipice acizilor clorogeni, precum și pe același ion la m/z 517 [M + H] + obținut în lucrarea noastră (Fig. S2B), acești acizi dicaffoeilchinici (DQA) ar putea corespunde vârfurilor 3, 4 și 5 (Fig. S1).
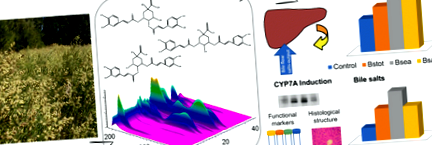
Unii autori au raportat activități coleretice ale MQA și DQA, sugerând că acționează sinergic (Wegener și Fintelmann 1999; Benedek și colab. 2006). Un efect coleretic este, de asemenea, atribuit Baccharis spp. (Cifuente și colab. 2010) și ar putea fi corelate cu conținutul de derivați ai esterilor cofeoilici, dar astfel de efecte nu au fost investigate în B. spicata. Prin urmare, am evaluat activitatea coleretică la diferite doze de Bstot (50, 100 și 200 mg/kg) la șobolani Wistar. Șobolanii tratați cu Bstot au prezentat o creștere dependentă de doză a BF în intervalul de concentrație testat comparativ cu grupul martor, prezentând diferențe semnificative la 100 și 200 mg/kg (Fig. 1a). Producția BS a fost, de asemenea, indusă de Bstot într-o manieră dependentă de doză. În conformitate cu creșterile observate ale BF, producția BS a crescut semnificativ la 100 și 200 mg/kg (Bstot50 45,72 ± 5,72, Bstot100 78,66 ± 19,37 * și Bstot200 104,15 ± 13,24 * nmol/min/g ficat) (Fig. 1b) . Așa cum era de așteptat, grupul de control pozitiv pentru colereză prin administrarea TC a arătat creșteri semnificative atât în producția BF, cât și în BS [Control BF (μl/min/g ficat), 1,56 ± 0,05; TC, 1,87 ± 0,04 *; Ieșire BS (nmol/min/g ficat) Control, 33,11 ± 3,10; TC, 128,80 ± 10,20 *; *p FIG. 1
- Efectul parametrilor de turnare Squeeze asupra proprietăților de uzură ale aliajului de aluminiu A390 SpringerLink
- Vindecarea rășinii epoxidice DER-331 de către Hexakis (4-acetamidofenoxi) ciclotrifosfazen și proprietăți ale
- Exploatarea suplimentelor alimentare cu proprietăți antioxidante pentru creșterea eficienței fizice la
- Fabricarea de cuști de reacție micro cu proprietăți personalizate Journal of the American Chemical
- Freud avea dreptate ... Despre originile comportamentului anormal SpringerLink