Abstract
Psoriazisul este o boală cronică inflamatorie a pielii care afectează pielea, articulațiile, sistemul cardiovascular, creierul și metabolismul. Patogeneza psoriazisului este mediată de o interacțiune complexă între sistemul imunitar, mediatori inflamatori ai diferitelor căi, de exemplu, TNF-alfa și căile IL-23/IL-17, loci de susceptibilitate asociată psoriazisului, autoantigenele și factori de mediu multipli. Psoriazisul este declanșat de combinația de factori genetici și de mediu. Un nou factor de risc de mediu cu o importanță crescândă este obezitatea. Mai multe studii au demonstrat că obezitatea este un factor de risc independent pentru debutul și severitatea psoriazisului. Datorită creșterii dramatice a obezității la nivel mondial, această minireview se concentrează pe obezitate ca factor major de risc de mediu pentru psoriazis și mecanismele de exacerbare a psoriazisului mediată de obezitate.
Introducere
Psoriazisul este o boală inflamatorie cronică a pielii poligenice (1-3). O proporție mare (20-30%) dintre pacienții cu psoriazis suferă de o afectare articulară suplimentară care afectează în principal extremitățile distale, dar și articulații mai mari (3). Psoriazisul de tip placă, cea mai frecventă variantă de boală, care se observă în
85% din cazuri, se manifestă în mod obișnuit sub formă de plăci roșii mat, eritematoase, solzoase, în special pe suprafețele extensoare ale coatelor, genunchilor și ale scalpului. Subtipurile de psoriazis mai puțin frecvente includ psoriazisul pustular, gutat, invers, eritrodermic și palmoplantar (4).
Psoriazisul are un fundal genetic semnificativ, după cum arată riscul crescut pentru dezvoltarea bolii la descendenți și frați ai pacienților cu psoriazis și apariția familială (5, 6). Asocierile genetice din psoriazisul vulgar au fost descrise în principal pentru locusul complexului major de histocompatibilitate (MHC) de pe cromozomul 6 care transportă genele antigenului leucocitar uman (HLA) și alte gene imunoreglabile, cum ar fi factorii de complement și TNF-α (6). Cea mai puternică asociere a fost observată pentru alela HLA-C Cw6, o alelă clasică HLA clasa I care a fost găsită la 46% dintre pacienții cu psoriazis, dar numai la 7% dintr-o populație de control (7). Studiile ulterioare de legătură la nivelul genomului prin analiza microsateliților au furnizat un set suplimentar de posibile regiuni genomice cu legătură la psoriazis, cum ar fi locusul PSORS1 și alți loci non-MHC, cum ar fi locurile PSORS2-5 (8). Studiile efectuate mai recent de asociere la nivel genomic (GWAS) asupra psoriazisului vulgar au identificat mai mulți factori de risc suplimentari ai psoriazisului care cuprind gene asociate inflamației cronice, inclusiv IL12B (9, 10), IL23A și IL23R (9), IL2/IL21 (7), TNFAIP3 și TNIP1 (9), ZNF313 (11) și gene epidermice/antimicrobiene, cum ar fi SLC12A8 și HBD (gena β-defensină umană) (12) și grupul de gene LCE (înveliș cornificat tardiv) (10).
Spre deosebire de psoriazisul vulgar, psoriazisul pustular prezintă asocieri genetice cu mutații în gena IL36RN cu cea mai puternică asociere pentru psoriazisul pustulos generalizat și o asociație mai slabă pentru pustuloza palmoplantară și acrodermatita continuă a lui Hallopeau (13). Pustuloza palmoplantară prezintă o prevalență mai mare la femeile și fumătorii. Psoriazisul gutat este asociat cu factori de mediu, cum ar fi stresul și infecțiile, dar nu a fost definit până acum un fundal genetic distinct. Diferitele mecanisme patogene pot avea, de asemenea, un impact asupra răspunsului la tratament, de exemplu, psoriazisul gutat este mai puțin receptiv la tratamentul cu anticorpi anti-TNF decât psoriazisul de tip placă (14).
Psoriazisul este considerat în prezent ca o boală autoimună, deoarece împărtășește multe caracteristici cu alte boli autoimune, cum ar fi cronicitatea simptomelor clinice și inflamația cronică, implicarea TNF-α și un fundal genetic cu loci genetici suprapuse cu alte boli autoimune (15, 16). Potențial autoantigeni precum keratina 17 cu omologii secvențiale la proteinele M streptococice, peptida antimicrobiană LL37 și autoantigenul melanocitar ADAMTSL5 au fost identificate recent. LL37 și ADAMTSL5 sunt recunoscute de celulele T după legarea la HLA-C * 06:02 subliniind rolul genotipurilor distincte HLA în patogeneza psoriazisului (17-19).
Tipurile de celule patogene centrale din psoriazis sunt keratinocitele epidermice, celulele care prezintă antigen și celulele T inflamatorii cu mecanisme complexe de feedback (1, 2, 20-22).
Rolul IL-23 ca regulator principal în psoriazis a fost evidențiat prin inducerea umflării urechii asemănătoare psoriazisului, hiperplaziei epidermice și acantozei la injectarea IL-23 în urechile șoarecilor, care a fost dependentă de IL17- și IL-22 (27)., 28). Aceste constatări au susținut rolul IL-23, IL-17 și IL-22 în psoriazis. Rolul acestor citokine în patogeneza psoriazisului este subliniat în continuare de modalitățile de tratament extrem de eficiente utilizate în prezent pentru psoriazis și artrita psoriazisului folosind anticorpi direcționați împotriva TNF-α, IL-23p19 și IL-17 (4, 29, 30). Analiza modelelor de expresie genică în pielea leziunilor cu psoriazis sub tratament cu agenți biologici a arătat că modelele de expresie genică ale genelor induse de IL-23- și IL-17 au fost într-adevăr reduse prin tratarea cu un anticorp anti-IL-12/23 în pielea vindecătoare leziuni (31).
Procesul inflamator dăunător în psoriazis nu este limitat la piele. Răspunsul inflamator necontrolat contribuie la o serie de afecțiuni comorbide în psoriazis, inclusiv boli cardiometabolice, accident vascular cerebral și sindrom metabolic (obezitate, hipertensiune arterială, dislipidemie și diabet) (32-36).
În general, se crede că psoriazisul este declanșat de o combinație de factori genetici și de mediu. S-a acceptat că interacțiunea dintre factorii de mediu și genetici contribuie la apariția, dezvoltarea și simptomele clinice ale psoriazisului. Un număr semnificativ de studii au identificat lumina ultravioletă, drogurile, fumatul, alcoolul și infecțiile, precum și stresul mental și biomecanic ca factori de risc de mediu care afectează psoriazisul, interferând cu predispoziția sa genetică și cu răspunsul imun (37).
Un nou factor de risc pentru psoriazisul cu o importanță socioeconomică ridicată este adipozitatea. Mai multe studii au arătat că obezitatea este un factor de risc independent pentru debutul și severitatea psoriazisului (38, 39). Datorită creșterii dramatice a obezității la nivel mondial, această minireview se concentrează pe obezitate ca factor de risc de mediu pentru psoriazis și mecanismele de exacerbare a psoriazisului mediată de obezitate.
Psoriazis și obezitate
Incidența psoriazisului la adulți aproape sa dublat între anii 1970 și 2000 (40). Deoarece baza genetică nu ar fi trebuit să se schimbe în mod semnificativ, factorii de mediu, inclusiv stilul de viață occidental, ar fi putut juca un rol în această prevalență în creștere (41). Obiceiurile alimentare din țările industrializate susțin adesea diete bogate în grăsimi, bogate în sare și bogate în zahăr, cu un aport caloric în exces care duce la obezitate și sindrom metabolic (42). Într-un studiu norvegian actual, cu o populație mare, care include aproape 35.000 de subiecți, a fost descrisă o asociere a sindromului metabolic cu un risc crescut de a dezvolta psoriazis. Analiza factorilor metabolici a indicat faptul că adipozitatea este un factor central în această asociere (43). Rezultate similare au fost raportate de alții [revizuite în (38, 39)]. Este dificil să arăți ce este primul, psoriazisul sau obezitatea. Izolarea socială pronunțată, obiceiurile alimentare slabe, depresia, consumul crescut de alcool și activitatea fizică scăzută la pacienții cu psoriazis ar putea explica modul în care psoriazisul poate duce la obezitate (38).
Deoarece țesutul adipos este un organ endocrin important care secretă factori solubili implicați în inflamație și imunitate, s-a postulat că expansiunea țesutului adipos și secreția sa de mediatori proinflamatori ar putea agrava psoriazisul. La pacienții cu psoriazis obezi s-au găsit niveluri ridicate de rezistină și leptină (39). O meta-analiză recentă a arătat că pacienții cu psoriazis au niveluri mai ridicate de leptină în comparație cu persoanele fără psoriazis (49).
În plus, obezitatea modifică compoziția celulară și activitatea celulelor inflamatorii din piele. Nakamizo și colegii săi au descris o acumulare de celule γδ producătoare de IL-17A în leziunile psoriazice ale pielii din șoarecii obezi induși cu dietă bogată în grăsimi (HFD), care au dus la o exacerbare a dermatitei psoriazice (50). Mai mult, șoarecii diabetici (db/db) modificați genetic au prezentat o inflamație psoriazică îmbunătățită a pielii cu niveluri crescute de IL-17A și IL-22 (51). Un alt studiu a arătat că HFD pe termen lung timp de 9 luni a promovat acumularea de macrofage CD11c + specifice în piele, într-o manieră dependentă de proteina de legare a acidului gras (E-FABP) (52). În studii elegante, Hristos și colegii săi au arătat că dieta occidentală (WD) induce imunitate antrenată de lungă durată în celulele mieloide. Autorii au indus inflamații sistemice la șoareci Ldlr -/- prin hrănirea WD care s-a calmat după trecerea șoarecilor la dieta chow. WD a indus o reprogramare transcriptomică și epigenomică de lungă durată a celulelor progenitoare mieloide, rezultând o proliferare crescută și răspunsuri imune înnăscute (53).
Un alt aspect important este faptul că obezitatea și nutriția afectează microbiomul (54, 55). Recent s-a demonstrat că microbiomul - care reprezintă ansamblul microorganismelor care trăiesc pe suprafețele exterioare și interioare ale corpului uman - exercită o puternică influență asupra bolilor autoimune ale omului (56). Există deja unele dovezi că acest lucru s-ar putea întâmpla și în psoriazis (57). Rolul microbiomului pentru procesele metabolice a fost, de asemenea, subliniat în studii experimentale recente (58). Interesant este că există o corelație între microbiom și producția de IL-17 în bolile autoimune (59-61). Modificările microbiomului intestinal în psoriazis se referă la o scădere a filului Bacteroidetes cu o creștere a genului Faecalibacterium. S-a sugerat că bacteriile își varsă componentele peretelui celular, cum ar fi lipopolizaharida și acidul lipoteicoic în fluxul sanguin, susținând astfel o stare inflamatorie cronică. Pe această linie, s-a demonstrat că substanțele pro-biotice exercită o influență asupra bolilor autoimune, cum ar fi boala Crohn, colita ulcerativă și artrita reumatoidă, dar până acum nu au fost testate pentru impactul lor asupra psoriazisului (62).
Psoriazis și acizi grași
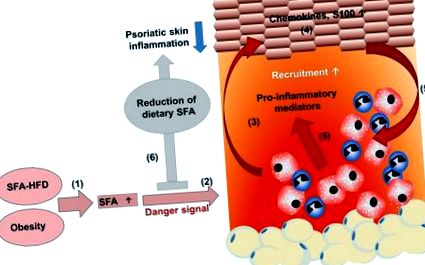
SFA derivate din HFD amplifică inflamația psoriazică. (1) O dietă bogată în acizi grași saturați (SFA) crește concentrația serică de SFA. (2) Aportul cronic al unei diete bogate în grăsimi crește țesutul adipos, rezultând obezitate cu niveluri serice ridicate de SFA. (2) SFA sensibilizează celulele mieloide rezultând un răspuns pro-inflamator amplificat cu secreție sporită a mediatorilor pro-inflamatori în prezența unui semnal de pericol. (3) Activarea îmbunătățită a celulelor mieloide contribuie la o perturbare a proliferării, diferențierii keratinocitelor și (4) îmbunătățește producția de chemokine și proteine S100. (5) În consecință, mai multe celule imune mieloide sunt recrutate în leziunea pielii și activate, îmbunătățind în continuare inflamația psoriazică a pielii. (6) Reducerea dietetică a SFA diminuează inflamația psoriazică a pielii, ceea ce ar putea sprijini eficacitatea tratamentului la pacienții psoriazici.
Datorită dovezilor limitate ale unui efect benefic al uleiului de pește pentru psoriazis, suplimentarea cu ulei de pește nu este recomandată pentru tratamentul psoriazisului (47). Datele din studiul nostru ar putea explica eșecul suplimentării cu PUFA ca măsură terapeutică în psoriazis (66-69). Se pare că o reducere a SFA este mai eficientă decât suplimentarea cu PUFA. În prezent, restricția calorică este recomandată pacienților cu psoriazis supraponderal și obez. Viitoarele studii clinice trebuie să verifice dacă o specificație a acestei recomandări - reducerea SFA ca măsură dietetică adjuvantă - ar putea sprijini terapiile antiinflamatorii convenționale.
Acizi grași și inflamație
PPAR sunt receptori specializați care detectează molecule de semnal derivate din FFA. Pierderea PPAR-γ amortizează biosinteza sterolului nou și mărește producția de IFN-β, care la rândul său suprimă transcrierea IL-1α și IL-1β în macrofage stimulate de LPS (80). Absorbția SFA-urilor duce la creșterea generării de ceramidă, care la rândul său activează PKC-ζ și MAPK, ducând la creșterea secreției IL-6 și IL-8 la stimularea LPS (79).
FFA crescute cauzate de HFD sau obezitate activează inflammasomul NLRP3 în macrofage, ducând la creșterea secreției IL-1β și IL-18 (78). În prezența semnalelor de pericol, SFA induc activarea inflamatorie prin inducerea speciilor de oxigen reactiv mitocondrial sau prin stimularea protein kinazei activate cu AMP, a autofagiei sau a căilor dependente de lizozom și calcineurină (70, 78). Absorbția excesivă de SFA induce cristalizarea intracelulară a SFA care duce la activarea inflammasomului NLRP3 și eliberarea ulterioară a IL-1β prin disfuncție lizozomală (81).
Luate împreună, SFA-urile pot amplifica răspunsul pro-inflamator prin acțiuni directe și indirecte (Figura 2). Astfel, restricționarea SFA dietetice poate fi utilă pentru suprimarea inflamației psoriazice.
Reglarea răspunsului pro-inflamator în psoriazis. (Stânga jumătate din cifră) Obezitatea și dieta bogată în grăsimi (HFD) cresc concentrația acizilor grași saturați (SFA). SFA sunt capabili să stimuleze direct expresia citokinelor pro-inflamatorii. SFA activează receptorii asemănători cu taxele (TLR) și se leagă de proteinele de legare a acidului gras epidermic citoplasmatic (E-FABP) activând receptorul acidului retinoid (RAR) și stimulează diferențierea macrofagelor CD11c + (MØ). O creștere a SFA modulează sinteza ceramidei. (Dreapta jumătate din figură) SFA amplifică răspunsul proinflamator în prezența unui semnal de pericol. SFA stimulează expresia citokinelor pro-inflamatorii prin legarea la PPAR, prin activarea inflammasomului și prin modularea sintezei ceramidei. Până în prezent nu este clar ce receptori sunt implicați în legarea FFA, translocarea în celulă și activitatea pro-inflamatorie ulterioară.
Concluzii
Psoriazisul este o boală cronică inflamatorie a pielii mediată de o interacțiune complexă între celulele imune și celulele rezidente ale țesuturilor. Factorii genetici și de mediu contribuie la patogeneza psoriazisului. Factorii de mediu, cum ar fi obezitatea și nutriția, au un impact important asupra debutului și severității psoriazisului. Studii recente sugerează că SFA dietetice par a fi amplificatoare cheie ale inflamației psoriazice și sugerează că restricția SFA poate fi benefică atât pentru pacienții slabi, cât și pentru cei obezi. Relevanța clinică trebuie să fie dovedită în viitoarele studii clinice pentru a îmbunătăți răspunsurile și comorbiditățile la tratamentul psoriazisului.
Contribuțiile autorului
AS și MK au scris manuscrisul. JS a editat și a discutat manuscrisul.
Declarație privind conflictul de interese
MK a primit burse de călătorie de la UCB Pharma și este membru al consiliilor consultative ale Novartis Pharma și LEO Pharma. JS a primit vorbitori onorari și este membru al consiliilor consultative ale Novartis Pharma, Janssen Pharma, UCB Pharma și AbbVie Pharma și a primit subvenții de călătorie de la aceste companii și de la LEO Pharma. Autorul rămas declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi construite ca un potențial conflict de interese.
Mulțumiri
Autorii recunosc sprijinul Fundației Germane de Cercetare (DFG), PsoNet Leipzig, Deutsche Psoriasisbund și Universität Leipzig în cadrul programului Open Access Publishing.
- Microbiom, acizi biliari și obezitate Cum metaboliții modificați microbial formează imunitatea antitumorală
- Acizii grași mononesaturați într-o dietă bogată în grăsimi și niacina protejează de disfuncția grăsimilor albe în
- Oocitele de la femeile obeze au niveluri mai scăzute de rețele tehnologice de acizi grași Omega-3
- Starea excesului de greutate maternă înaintea sarcinii și obezitatea ca factori de risc pentru nașterea prin cezariană
- Zonele rurale determină creșteri ale obezității globale - Scientific American