Departamentul de Chirurgie, Royal Infirmary of Edinburgh, Edinburgh EH3 9YW;
Departamentul de Chirurgie, Royal Infirmary of Edinburgh, Edinburgh EH3 9YW;
Departamentul de Chirurgie, Glasgow Royal Infirmary, Glasgow G31 2ER; și
Laboratorul de biochimie a izotopilor, Centrul de cercetare și reactor al universităților scoțiene, East Kilbride, Regatul Unit G75 0QF
Departamentul de Chirurgie, Royal Infirmary of Edinburgh, Edinburgh EH3 9YW;
Laboratorul de biochimie a izotopilor, Centrul de cercetare și reactor al universităților scoțiene, East Kilbride, Regatul Unit G75 0QF
Abstract
S-a demonstrat anterior că, în starea de repaus alimentar, rata totală de sinteză a albuminei este neschimbată la pacienții cu cancer avansat, comparativ cu martorii, în ciuda concentrațiilor de albumină mult mai mici (19). Prin contrast, rata totală de sinteză a fibrinogenului este semnificativ crescută în starea de repaus alimentar la pacienții cu cancer, însoțită de concentrații circulante mai mari comparativ cu martorii (33). Acest lucru ar sugera că, în starea de post pentru albumină cel puțin, o rată de sinteză redusă nu explică hipoalbuminemia observată. În schimb, concentrațiile plasmatice de fibrinogen reflectă, cel puțin parțial, o rată crescută de sinteză.
Sinteza albuminei este considerată a fi stimulată prin hrănirea subiecților sănătoși (13, 24); totuși, în schimb, sinteza fibrinogenului rămâne neschimbată (10, 13). Dacă ar exista un răspuns sintetic redus al albuminei la hrănirea în cancer, acest lucru ar putea contribui la hipoalbuminemie. Alternativ, dacă s-ar crește sinteza fibrinogenului ca răspuns la hrănirea cu cancer (și acest proces a afectat alte proteine pozitive în fază acută), atunci acest lucru ar putea contribui la cerințele metabolice asupra economiei de azot a acestor pacienți și ar putea contribui în cele din urmă la pierderea slabă. țesutului, în special dacă aportul de proteine din dietă a fost restricționat.
În încercarea de a explora aceste ipoteze, scopul prezentului studiu a fost de a evalua dacă pacienții slăbiți cu cancer pancreatic avansat au un răspuns anormal de albumină sintetică în starea de hrănire și dacă sinteza proteinei de fază acută pozitivă fibrinogen este modificat.cu hrănirea la astfel de pacienți.
Subiecte.
Opt pacienți cu un diagnostic neechivoc de cancer pancreatic, care pierdeau în greutate fără dovezi clinice de ascită sau edem periferic, au fost examinați în studiu. Șase indivizi sănătoși stabili în greutate au servit drept controale. Niciunul dintre pacienți nu a primit chimioterapie sau radioterapie și niciunul nu a suferit intervenții chirurgicale în ultimele 4 săptămâni. Niciun pacient nu a prezentat dovezi clinice sau radiologice de infecție, a fost icterizat sau a fost sever anemic sau a primit steroizi. Studiul a fost aprobat de comitetul etic local și toți subiecții au dat consimțământul scris în scris.
Protocol de studiu.
FIG. 1.Protocol de studiu. REE, cheltuieli energetice restante.
Pregătirea probelor și analiza izotopilor.
Metoda de preparare a probei a fost descrisă anterior (27). Pe scurt, protocolul de studiu a necesitat măsurarea îmbogățirii marcate cu fenilalanină în bazinul de fenilalanină fără plasmă și în albumina plasmatică și fibrinogen. Pentru analiza gratuită a fenilalaninei, probele de plasmă de 1,5 ml au fost diluate cu 5 ml de apă distilată deionizată, cu 250 nmol cicloleucină adăugată ca standard intern. Probele diluate au fost apoi deproteinizate prin ultrafiltrare (25.000 greutate moleculară tăiată cu centrifree, Amicon, Gloucestershire, Marea Britanie) și acidificate, iar aminoacizii au fost purificați prin schimb de cationi. [2H5] - sau [2H8] îmbogățirea fenilalaninei a fost măsurată prin cromatografie în fază gazoasă-spectrometrie de masă (GC-MS) catert-derivați de butildimetilsilil (37). S-a descoperit că fenilalanina [2H8] formează în timp [2H7] fenilalanină (fenilalanina liberă în circulație a cuprins aproximativ 50% ([2H7] fenilalanină la aproximativ 100 de minute după doza de inundație de [2H8] fenilalanină). Acest fenomen s-a produs in vivo și nu în standardele de urmărire sau în timpul prelucrării probelor. Pentru a depăși această problemă, ambii izotopomeri au fost măsurați în toate probele, iar suma lor a fost utilizată în toate calculele.
Albumina a fost extrasă din 1 ml de ser prin solubilitate diferențială în etanol absolut din 10% (greutate/greutate) proteină precipitată cu acid tricloroacetic. Pentru a elimina urmele de fenilalanină liberă, soluția de albumină etanolică a fost spălată de trei ori cu 5 ml de apă distilată deionizată prin ultrafiltrare. Albumina purificată a fost apoi hidrolizată și îmbogățirea cu fenilalanină marcată a fost măsurată prin GC-MS (37).
După spălarea plasmei de trei ori într-un con de ultrafiltrare, așa cum s-a descris mai sus, fibrinogenul a fost îndepărtat ca un cheag de fibrină. Coagularea a fost efectuată prin diluarea a 1,5 ml de plasmă la 20 ml cu soluție salină și 0,5 ml de clorură de calciu (0,5 mol/l). Cincisprezece unități de trombină fără albumină umană (Sigma, Poole, Marea Britanie) au fost apoi adăugate și după 10 minute fibrina a fost colectată pe o tijă de sticlă gravată. Fibrina a fost apoi hidrolizată sub vid la 145 ° C timp de 4 ore cu 6 mol/l HCI și îmbogățirea marcată cu fenilalanină a fost măsurată așa cum s-a descris mai sus.
Îmbogățirea marcată cu fenilalanină a bazinului fără plasmă, a albuminei și a fibrinogenului în starea de post și hrănire este prezentată în Fig.2. 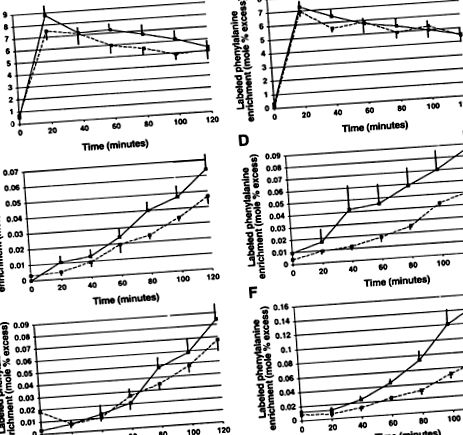
FIG. 2.Îmbogățirea marcată cu fenilalanină a bazinului fără plasmă (A și B), albumina (C șiD) și fibrinogen (E și F) în post (stânga) și hrănit (dreapta) stări în controale sănătoase (linii punctate) și pacienți cu cancer care slăbesc (linii solide). Graficele prezente înseamnă ± SE.
Analize de proteine.
Concentrațiile de albumină serică au fost măsurate utilizând metoda verde bromocrezol pe un analizor automat Technicon RA-1000 (Technicon Instruments, Tarrytown, NY). Concentrațiile plasmatice de fibrinogen au fost măsurate prin evaluarea timpului de coagulare în prezența unei concentrații ridicate de trombină pe un coagulometru KC4A (Baxter Healthcare, Thetford, Marea Britanie).
Calcule.
Viteza de sinteză fracționată a albuminei și fibrinogenului a fost calculată prin împărțirea ratei de schimbare a îmbogățirii marcate cu fenilalanină a albuminei sau fibrinogenului la zona de sub curba îmbogățirii precursorului vs. timp (2).
Măsurarea mediatorului.
Probele pentru măsurarea concentrațiilor de insulină, cortizol și interleukină-6 au fost luate la 8 AM după un post peste noapte. Concentrațiile serice de interleukină-6 au fost măsurate prin ELISA (Quantikine, R&D Systems, Abingdon, Marea Britanie). Limita de detectare a fost de 0,5 pg/ml. Coeficientul de variație a fost de 2 teste sau testul Wilcoxon semnat-rang, după caz (Statview, Abacus Concepts, Berkeley, CA). A P valoarea
Tabelul 1. Caracteristicile pacienților cu cancer și controalele sănătoase
Valorile prezentate sunt mediane și variabile. Comparație prin testul U-Mann Whitney sau testul χ 2.
Viteza de sinteză a albuminei este prezentată în Tabelul 2. Modificările în sinteza albuminei între stările de post și cele alimentate sunt prezentate în Fig.3. Nu a existat nicio diferență în ratele de sinteză a albuminei între pacienții cu cancer cu slăbire și controalele sănătoase la postul [median 14,2 vs. 15,7 g/zi (P= 0,30)] sau hrănit [rata medie sintetică totală 11,3 vs. 13,9 g/zi (P = 0,70)] stare. Pacienții cu cancer și martorii au prezentat un model similar de stimulare semnificativă a sintezei albuminei în starea hrănită, a medianelor 29 și respectiv 24%.
Tabelul 2. Cinetica albuminei la pacienții cu cancer și controale sănătoase
Valorile sunt mediane, cu interval între paranteze. FSR, rata de sinteză fracționată; ASR, rata de sinteză absolută; TSR, rata de sinteză totală. Post Vs. comparație alimentată de testul de rang semnat de Wilcoxon. Control vs. compararea pacientului de Mann Whitney U -test.
FIG. 3.Viteza de sinteză totală a albuminei în stare de repaus alimentar și hrănire în controale sănătoase (A) și pacienții cu cancer care slăbesc (B). Graficul prezintă mediane (simboluri) și intervale (bare SE). Creșterea medie este de 24% pentru A și 29% pentru B.Comparația dintre valorile postului și valorile hrănite se face prin testul de rang semnat Wilcoxon. Nu a existat nicio diferență semnificativă între controlul și valorile pacienților cu cancer de către Mann-Whitney U-Test (P = 0,70 post, P = 0,30 alimentat).
Ratele de sinteză a fibrinogenului sunt prezentate în Tabelul 3. Modificările sintezei fibrinogenului între stările hrănite și cele postite sunt prezentate în Fig.4. Pacienții cu cancer au avut rate semnificativ și semnificativ ridicate de sinteză a fibrinogenului atât în post [median 3.3 vs. 1,1 g/zi (P = 0,0019)] și hrănit [median 4,5 vs. 1,3 g/zi (P = 0,0019)] stări comparativ cu controalele. Nu a existat nicio modificare semnificativă în sinteza fibrinogenului cu hrănirea la pacienții martor (median 14%,P = 0,12). În schimb, a existat o stimulare semnificativă statistic a sintezei fibrinogenului cu hrănirea la pacienții cu cancer (mediană 38%, P = 0,012). Deși procentul de stimulare a sintezei fibrinogenului nu a fost semnificativ diferit între pacienții de control și pacienții cu cancer, a existat o diferență absolută substanțială și semnificativă a ratei de sinteză între cele două grupuri [creșterea medie a ratei sintetice totale a fibrinogenului la pacienții cu cancer 1,24 g/zi (interval 0,12) –6.91) vs. 0,17 g/zi (-0,16 până la +0,57) în controale, P = 0,014].
Tabelul 3. Cinetica fibrinogenului la pacienții cu cancer și controale sănătoase
Valorile sunt mediane, cu intervale între paranteze. Post Vs. comparație alimentată de testul de rang semnat de Wilcoxon. Control vs. compararea pacientului de Mann Whitney U -test.
FIG. 4.Ratele de sinteză totală a fibrinogenului în starea de post și hrănire în controale sănătoase (A) și pacienții cu cancer care slăbesc (B). Graficul prezintă mediane (simboluri) și intervale (bare SE). Comparația dintre valorile postului și valorile hrănite se face prin testul de rang semnat Wilcoxon. Diferența dintre controlul și valorile pacienților cu cancer de Mann-Whitney U-Test; P = 0,0019 atât în starea de post cât și în starea de hrănire.
Prezentul studiu a arătat că, în ciuda concentrațiilor de albumină circulante semnificativ mai scăzute, pacienții cu cancer pancreatic care pierd greutate suferă o stimulare a sintezei albuminei odată cu hrănirea, iar gradul în care aceasta apare este similar cu cel al controalelor sănătoase. Concentrațiile de fibrinogen circulante sunt semnificativ crescute la pacienții cu cancer, iar în starea de post, sinteza fibrinogenului este crescută semnificativ peste valorile de control. Deși indivizii sănătoși nu prezintă nici o stimulare semnificativă a sintezei fibrinogenului în starea de hrănire, există o creștere semnificativă odată cu hrănirea la pacienții cu cancer.
Sinteza albuminei nu a fost studiată anterior în starea de hrănire la pacienții cu cancer, dar studiul de față, care utilizează o metodă de doză de inundații și hrănirea orală, sugerează că sinteza este stimulată într-un grad similar (~ 30%) în comparație cu subiecții martor. Astfel, un răspuns sintetic anormal de scăzut al albuminei la hrănire nu explică probabil concentrațiile mai scăzute de albumină circulantă la acești pacienți. Ca și în studiile anterioare (24), în studiul de față, dimensiunea stimulului de hrănire a fost determinată de cheltuielile de energie măsurate în repaus. Deoarece pacienții cu cancer au avut o greutate corporală semnificativ mai mică decât martorii cu o cheltuială de energie similară în repaus, stimulul de hrănire a fost mai mare pe unitatea de greutate corporală la pacienții cu cancer [pacienții cu cancer mediu 3.15 kcal/kg (interval 2.73-3.37) vs. comenzi 2,36 kcal/kg (1,92-2,71), P = 0,0019]. Este posibil ca această dimensiune relativ mai mare a mesei să fi contribuit la stimularea semnificativă a sintezei atât a albuminei, cât și a fibrinogenului la pacienții cu cancer, în timp ce numai albumina, dar nu și sinteza fibrinogenului, a fost stimulată semnificativ prin hrănirea mesei în controale sănătoase.
Ca și în studiul actual, sinteza fibrinogenului s-a dovedit anterior a fi crescută până la dublu în starea de repaus alimentar la pacienții cu cancer în comparație cu martorii (33, 34). Mai mult, o creștere similară a sintezei fibrinogenului a fost demonstrată la pacienții cu traume și arsuri (41) și acest lucru este în concordanță cu conceptul că, în timpul unui răspuns în fază acută, rata de sinteză a reactanților pozitivi este în general crescută. La subiecții sănătoși, s-a demonstrat că hrănirea nu are nici un efect (10, 13), fie un efect stimulator mic (20%) asupra sintezei fibrinogenului (8). Acest lucru este în concordanță cu schimbarea nesemnificativă observată la voluntarii sănătoși în studiul actual. În schimb, hrănirea a provocat o creștere semnificativă a ratelor de sinteză a fibrinogenului la pacienții cu cancer. O observație similară a fost făcută la pacienții cu traumatism cranian (25) și acest lucru sugerează că, odată ce un răspuns în fază acută a fost inițiat de factori precum citokinele proinflamatorii, sinteza reactanților pozitivi (de exemplu, fibrinogenul) poate fi stimulată în continuare prin aport alimentar.
În prezentul studiu, pentru subiecții individuali nu a existat o relație evidentă între concentrațiile circulante de proteine și ratele de sinteză a proteinei relevante. În plus, nu a existat nicio modificare semnificativă a concentrației de albumină sau fibrinogen în perioada de studiu de 4 ore. Cu toate acestea, cu o rată de sinteză fracționată a fibrinogenului în repaus de ± 1%/h, o rată de alimentare de ± 1,25%/h și o rată de descompunere fracționată de ≥ 1%, nu s-ar aștepta o creștere a concentrației de fibrinogen în precizia test. Având un bazin mai mare și o rotație mai lentă, orice modificare a concentrației de albumină ar fi chiar mai mică.
Ratele de sinteză a proteinelor sunt doar un factor în determinarea concentrațiilor circulante, dar în prezent există informații limitate despre descompunerea proteinelor în fază acută și evadarea transcapilară. Există dovezi indirecte ale creșterii degradării fibrinogenului în cancer, cu concentrații crescute de produse de degradare a fibrinei (15,26); cu toate acestea, rolul fibrinogenului în coagulare complică relevanța acestei descoperiri. S-a demonstrat că evadarea transcapilară are loc la o rată crescută la pacienții cu cancer care slăbesc și sa sugerat că contribuie la hipoalbuminemia răspunsului în fază acută (21). Cu toate acestea, revenirea limfatică trebuie să fie crescută în mod similar, deoarece nu există nicio relație între evadarea transcapilară și concentrația de albumină (1) și nici o modificare a bazinului de albumină intravasculară cu evadare transcapilară crescută (4). Munca limitată a sugerat o creștere moderată a descompunerii albuminei la pacienții cu cancer, deși nu este clar dacă pacienții studiați au slăbit (36). De asemenea, s-a sugerat că tumoarea însăși poate consuma albumină (39), deși semnificația acestui fenomen în boala umană rămâne neclară. Este necesar un studiu suplimentar al defalcării proteinelor în fază acută la pacienții cu cancer care slăbesc.
Pe scurt, prezentul studiu a demonstrat că creșterea sintezei albuminei cu hrănirea la pacienții cu cancer este identică cu cea din martori și că pacienții cu cancer prezintă o stimulare substanțială a sintezei deja crescute de fibrinogen în starea alimentată. Aceste descoperiri sugerează că sinteza proteinelor în fază acută poate reprezenta o scurgere semnificativă a rezervelor de proteine ale organismului și, prin urmare, poate oferi un mecanism prin care răspunsul proteinelor în fază acută este asociat cu accelerarea pierderii țesutului slab și agravarea supraviețuirii la pacienții cu cancer.
Recunoaștem asistența tehnică a lui Jason Donnelly, Jean Maingay și Kathryn Sangster.
NOTĂ DE PICIOASĂ
Asistența financiară pentru acest studiu a fost primită de la Ross Products Division, Abbott Laboratories; Scotia Pharmaceuticals; și Royal Infirmary of Edinburgh National Health Service Trust.
Adresa pentru solicitări de reimprimare și alte corespondențe: T. Preston, Laboratorul de biochimie a izotopilor, Centrul de cercetare și reactor al universităților scoțiene, East Kilbride, Marea Britanie G75 0QF (E-mail: T. [e-mail protected] gla. Ac. UK).
- Efectele pe termen lung ale aportului crescut de proteine după scăderea în greutate asupra conținutului de lipide intrahepatice și
- Matrix Nutrition Diet Whey Protein Powder Shake; Înlocuirea mesei Scutire de pierdere în greutate (ciocolată)
- Ketorolac (sistemic) Memorial Sloan Kettering Cancer Center
- Ketorolac utilizări orale, efecte secundare, interacțiuni, imagini, avertismente; Dozare - WebMD
- Supă de linte de pui instant Curry Pot - Pregătirea mesei bariatrice
