Abstract
OBIECTIV: Pentru a analiza impactul suplimentării cu vitamina A atât a unei diete normale cu grăsimi (NF), cât și a unei diete bogate în grăsimi (HF) și a tratamentului cu acid retinoic acut (RA) asupra expresiei proteinei de decuplare 3 (UCP3) la șoareci.
PROIECTA: Șoarecii C57BL/6J au fost hrăniți timp de 18 săptămâni cu o dietă NF sau HF (10 și, respectiv, 45% energie ca grăsime), ambele având un conținut normal de vitamina A sau un exces de vitamină A (8 mg și 320 mg retinil palmitat/kg dietă, respectiv). Greutatea corporală și aportul de energie au fost înregistrate periodic. Nivelurile de ARNm UCP3 și proteine UCP3 în mușchiul scheletic (soleus/gastrocnemius) au fost analizate, precum și nivelurile de ARNm UCP1, UCP2 și UCP3 în țesutul adipos maro intercapular (BAT) și nivelurile de ARNm UCP2, proteine UCP2 și leptină mARN în depozitele de țesut adipos alb (WAT). De asemenea, a fost evaluat efectul tratamentului RA acut (100 mg/kg/zi, 4 zile) asupra nivelurilor de ARNm UCP3 la mușchiul scheletic și BAT la șoareci RMN.
REZULTATE: Suplimentarea cu vitamina A a unei diete NF a dus la creșterea nivelului de ARNm UCP3 și proteină UCP3 în mușchi, ARNm UCP1 în BAT și ARNm UCP2 în WAT inghinal, dar nu a avut niciun impact asupra greutății corporale sau adipozității șoarecilor B6. Dieta HF a promovat obezitatea și a crescut nivelurile de ARNm UCP3 și proteine UCP3 în mușchiul scheletic și ale ARNm pentru toate cele trei UCP din BAT. Suplimentarea dietei HF cu vitamina A a avut un efect redus asupra obezității finale atinse și nu a dus la creșteri ulterioare ale ARNm muscular UCP3 și nici a ARNm BAT UCP1 peste nivelurile obținute cu dieta HF non-suplimentată. Nivelurile de ARNm de leptină adipoasă au fost reglementate în jos după suplimentarea cu vitamina A, independent de conținutul de grăsimi din dietă. Reglarea în sus a nivelului mRNA al mușchiului, dar nu și BAT, a fost găsită și după tratamentul RA acut la șoarecii RMN.
CONCLUZIE: Rezultatele oferă dovezi ale unui efect stimulator al retinoizilor asupra expresiei musculare UCP3 in vivo, și o reglare diferențială retinoidă a genei UCP3 în mușchi și BAT.
Introducere
Genele proteinei 3 (UCP3) și 2 (UCP2) de decuplare (revizuite în ref. 1) au fost clonate în 1997 ca gene care codifică proteine cu o omologie de secvență ridicată la UCP1, proteina membrana mitocondrială internă a adipocitelor brune care constituie baza moleculară termogeneză în țesutul adipos maro (BAT). Când este activ, UCP1 poate disipa energia sub formă de căldură prin decuplarea fosforilării oxidative. 1,2 Rapoarte diferite (a se vedea ref. 1) au arătat că UCP2 și UCP3 scad potențialul membranei mitocondriale atunci când sunt exprimate ectopic în drojdie și, mai recent, analiza șoarecilor knockout UCP3 a furnizat dovezi ale activității de decuplare de către UCP3 în mușchiul scheletic in vivo, 3.4, deși rezultatele sunt contradictorii. 5
În această lucrare, am studiat efectele suplimentelor cronice de vitamina A dietetice asupra expresiei UCP și asupra dezvoltării obezității induse de dietă bogată în grăsimi la șoarecii predispuși la obezitate. Ne-am concentrat asupra UCP3, deoarece posibila sa reglare de către retinoizi nu a fost abordată anterior în experimente in vivo. Suplimentarea cronică a vitaminei A a avut un efect redus asupra dezvoltării obezității induse de dietă la șoarecii predispuși la obezitate, dar rezultatele noastre arată că expresia musculară UCP3 răspunde factorilor din dietă și, în special, grăsimilor și încărcăturii cu vitamina A a dietei și dovezi reglarea diferențială a UCP3 de către retinoizi în mușchi și BAT.
Metode
Experiment de suplimentare cu vitamina A
Experiment acut de tratament RA
Șoareci masculi RMN în vârstă de 12 săptămâni (CRIFFA, Barcelona, Spania) care au fost hrăniți cu chow de laborator obișnuit (Panlab, Barcelona, Spania) și au fost menținuți la 22 ° C cu un ciclu de lumină - întuneric de 12:12 h au fost folosite. Animalele au fost aclimatizate la aproape termoneutralitate (28 ° C) timp de o săptămână înainte de a fi alocate aleatoriu la două grupuri experimentale: animale tratate cu RA, care au primit o injecție subcutanată zilnică de 100 mg/kg de all-trans-RA (Sigma, Madrid, Spania) în timpul celor 4 zile imediat înainte de a fi uciși și a controlat animalele care au fost injectate cu vehicul (ulei de măsline). Au fost efectuate două experimente independente (patru și respectiv cinci animale pe grup).
Colecția de țesuturi
Animalele au fost ucise cu CO2 urmate de luxația cervicală și decapitare, la începutul ciclului de lumină. Sângele a fost colectat din gât și s-a preparat serul. BAT interscapular (BAT), WAT inghinal (iWAT), epididimal WAT (eWAT) și retroperitoneal WAT (rWAT) au fost excizate în integritate, ponderate, congelate rapid în azot lichid și depozitate la -70 ° C; mușchiul gambei (gastrocnemius/soleus) a fost de asemenea prelevat și congelat în azot lichid.
Extracția ARN și analiza Northern blot
Reactivii și sondele utilizate au fost de la Boehringer Mannheim (Barcelona, Spania). ARN tisular total a fost izolat folosind reactivul Tripure ™ și 10-20 µg au fost fracționate prin electroforeză pe gel de agaroză, transferate pe o membrană de nailon prin ștergere capilară în 20 × SSC și fixate cu lumină UV, totul conform Roca și colab. 14
ARN-urile de interes au fost analizate printr-o procedură bazată pe chemiluminiscență, utilizând sonde oligonucleotidice antisens marcate la sfârșit cu digoxigenină. 31 Au fost utilizate următoarele sonde: pentru UCP1 mARN, 5 ′ - IndexTerm GTTGGTTTTATTCGTGGTCTCCCAGCATAG-3 ′; 14 pentru ARNm UCP2, 5 ′ - IndexTerm GGCAGAGTTCATGTATCTCGTCTTGACCAC-3 ′; 14 pentru UCP3 mARN, 5 ′ - IndexTerm GACTCCTTCTTCCCTGGCGATGGTTCTGTAGG-3 ′; pentru ARNm de leptină, 5 ′ - IndexTerm GGTCTGAGGCAGGGAGCAGCTCTTGGAGAAGGC-3 ′; 32 și pentru ARNr 18S, 5 ′ - IndexTerm CGCCTGCTGCCTTCCTTGGATGTGGTAGCCG-3 ′. 32
Membranele fixe au fost pre-hibridizate la 42 ° C timp de 15 minute în DIG-Easy Hyb și apoi hibridizate cu sonda oligonucleotidică corespunzătoare (34 ng/ml, cu excepția sondei ARNr 18S, care a fost utilizată la 70 pg/ml) în DIG -Usor Hyb la 42 ° C peste noapte și supus la 2 × 15 min de spălare într-o soluție de 2 × SSC/0,1% (g/v) SDS la temperatura camerei, urmat de 2 × 15 min de spălare la 0,1 × SSC/0,1% (g/v) SDS la 48 ° C. După blocare, membranele au fost incubate cu un conjugat anti-digoxigenină - fosfatază alcalină, apoi cu substratul chemiluminiscent CDP-Star ™ și, în cele din urmă, expuse la Hyperfilm ™ ECL (Amersham, Buckinghamshire, Marea Britanie). Benzile din filme au fost analizate prin fotodensitometrie cu scaner, cuantificate utilizând programul BioImage (Millipore, Bedford, MA, SUA) și normalizate folosind valorile corespunzătoare ale ARNr 18S. ARN-urile de interes au fost analizate secvențial pe aceeași membrană, după dezizolarea cu fierbere 0,1% (g/v) SDS.
Analiza Western blot
Probele de eWAT, iWAT și mușchi picior congelate au fost omogenizate în soluție salină tamponată cu fosfat (137 mM NaCI, 3 mM KCl, 6,5 mM Na2HPO4 și 3,5 mM KH2PO4) într-un omogenizator de teflon/sticlă. Omogenatele au fost centrifugate la 500 g timp de 10 minute la 4 ° C și conținutul total de proteine din supernatante a fost determinat prin metoda lui Bradford. 33 Proteina (50 μg) a fost fracționată prin electroforeză în gel SDS-poliacrilamidă pe geluri de poliacrilamidă 10% conform Laemmli 34 și apoi electroblotată la o membrană de nitroceluloză. Colorarea Ponceau S a furnizat dovezi vizuale pentru încărcarea corectă și transferul electroforetic al proteinelor la membrana nitrocelulozei. Blocarea și dezvoltarea imunoblotilor au fost efectuate utilizând un sistem de analiză western blot de chemiluminiscență îmbunătățit (Amersham Pharmacia Biotech, Buckinghamshire, Marea Britanie). Anticorpii primari de iepure împotriva UCP2 și UCP3 au fost cumpărați de la Alpha Diagnostics (San Antonio, TX, SUA); specificitatea acestor anticorpi a fost confirmată anterior de Sivitz și colab. 35 de benzi din filme au fost analizate prin scaner fotodensitometrie și cuantificate folosind programul BioImage (Millipore, Bedford, MA, SUA).
Alți parametri determinați
Lipidele musculare au fost determinate prin metoda Folch. 36 nivelurile serice de acid gras neesterificat (NEFA) au fost cuantificate utilizând o metodă colorimetrică pe bază de acil-CoA sintetază și acil-CoA oxidază (Wako Chemicals GmbH, Neuss, Germania).
analize statistice
Valorile sunt exprimate ca mijloace ± s.e.m. În experimentele de suplimentare cu vitamina A, diferențele dintre grupuri au fost evaluate prin analiza bidirecțională a varianței (ANOVA); Elevi t-testul a fost aplicat pentru comparații medii atunci când ANOVA cu două căi a relevat interacțiunea dintre variabile. În experimentele acute de tratament RA, diferențele dintre animalele de control și cele tratate cu TRA au fost evaluate de Student t-Test. Rezultatele au fost considerate semnificative statistic la P
Rezultate
Impactul suplimentării pe termen lung a vitaminei A asupra obezității induse de dietă bogată în grăsimi la șoarecii B6
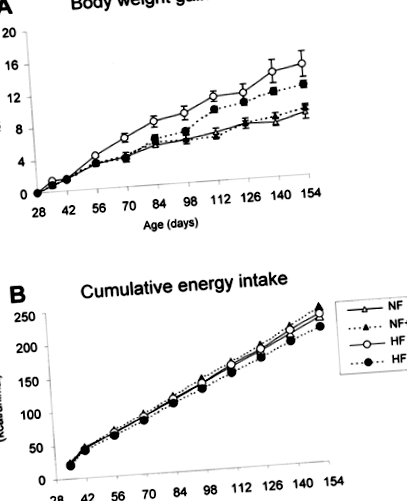
Efectele dietei bogate în grăsimi și suplimentarea cu vitamina A asupra creșterii în greutate corporală (A) și a aportului cumulativ de energie (B) al șoarecilor B6. Animalele au fost hrănite cu o dietă normală cu vitamina A normală (NF), cu o dietă normală bogată în vitamine A (NF + A), cu o dietă normală bogată în vitamine A (HF) sau cu o dietă bogată în grăsimi bogată în vitamina A (HF + A) )). Detaliile dietelor sunt date în secțiunea materiale și metode. Datele din A sunt mijloacele ± s.e.m. din patru animale pe grup. Aportul de energie a fost estimat pe bază de cușcă (patru animale/cușcă) timp de 24 de ore, din cantitatea reală de hrană consumată de animale și echivalența calorică a acesteia.
Efectele hrănirii pe termen lung a dietelor bogate în grăsimi și a suplimentării cu vitamina A asupra expresiei leptinei și UCP2 în depozitele WAT ale șoarecilor B6
Nivelurile de ARNm ale leptinei au crescut în depozitele iWAT și eWAT hipertrofiate ale șoarecilor B6 hrăniți cu diete bogate în grăsimi, în conformitate cu binecunoscuta corelație pozitivă generală dintre expresia leptinei și conținutul de grăsime și au avut tendința de a fi reduse după suplimentarea dietetică cu vitamina A, independent de conținutul de grăsimi al dietei, tendință care a atins semnificația statistică în eWAT (Tabelul 2).
Nivelurile de ARNm UCP2 în depozitele WAT nu au fost afectate atât în iWAT, cât și în eWAT prin alimentarea cu diete bogate în grăsimi și au crescut în iWAT după suplimentarea dietetică cu vitamina A, independent de conținutul de grăsimi al dietei (Tabelul 2). De remarcat, nivelurile de ARNm UCP2 în depozitele WAT, în special în iWAT, păreau a fi foarte scăzute, semi-cuantificare prin blotare nordică necesitând expunere îndelungată a filmelor la pete. Nivelurile de proteine UCP2 măsurate prin western blot par, de asemenea, să fie foarte scăzute și, atât în iWAT, cât și în eWAT, s-au dovedit a fi neafectate de alimentația cu conținut ridicat de grăsimi sau de suplimentarea cu vitamina A (rezultatele nu sunt prezentate). Astfel, nivelurile crescute de ARNm UCP2 în iWAT la animalele suplimentate cu vitamina A nu au fost însoțite de creșteri paralele ale nivelurilor de proteine UCP2 tisulare.
Suplimentarea cu vitamina A a expresiei musculare UCP3 reglată în sus la șoarecii B6
Nivelurile de ARNm ale mușchiului scheletic UCP3 s-au dovedit a fi crescute la șoarecii B6 după 18 săptămâni de suplimentare dietetică cu vitamina A a unei diete normale cu grăsimi (cu + 116%, semnificativ de către studenții t-test) și, mai marcat (cu + 174%), după 18 săptămâni de alimentație cu conținut ridicat de grăsimi; a existat o tendință clară de interacțiune între cele două variabile ale dietei, efectul de reglare a suplimentelor de vitamina A fiind evident doar în dieta normală cu grăsimi (Figura 2A). Modificările nivelurilor de proteine ale mușchiului scheletic UCP3 au prezentat un profil similar, cu creșteri ca răspuns atât la suplimentarea cu vitamina A, cât și la dietele bogate în grăsimi care nu au fost cumulative în grupul HF + A (Figura 2B). Într-un experiment separat, am găsit niveluri de mARN de UCP3 muscular crescute deja la șoarecii B6 după 4 săptămâni de supliment de dietă cu vitamina A a unei diete normale cu grăsimi (cu + 124%) și după 4 săptămâni de dietă bogată în grăsimi (cu + 46%); ca și în experimentul pe termen lung, în acest experiment pe termen scurt, efectul suplimentării cu vitamina A a fost evident doar în dieta normală cu grăsimi (niveluri relative de expresie: grupul NF, 100 ± 7; grupul NF + A, 224 ± 11; Grup HF, 146 ± 3, grup HF + A, 155 ± 20, n= 4 pentru fiecare grup. Înțelesuri ANOVA, P Figura 2
Efectele dietei bogate în grăsimi și suplimentarea cu vitamina A asupra expresiei mARN-ului UCP3 (A) și proteinei UCP3 (B) la mușchiul scheletic al șoarecilor B6. Șoarecii B6 în vârstă de patru săptămâni au fost hrăniți timp de 18 săptămâni o dietă normală cu vitamina A normală în grăsimi (grupul NF), o dietă normală bogată în vitamine A (grăsime NF + A), o dietă normală bogată în grăsimi cu vitamina A (grupul HF) sau o dietă bogată în grăsimi bogată în vitamina A (grup HF + A). Detaliile dietelor sunt date în secțiunea de materiale și metode. Datele sunt mijloacele ± s.e.m. din 4 animale pe grup și sunt exprimate în raport cu valoarea medie a grupului NF, care a fost stabilită la 100%. Rapoartele fiecărui ARNm la ARNr 18S au fost calculate pentru a corecta cantitatea de ARN. Pete nordice și occidentale reprezentative sunt prezentate în partea de jos (A, 20 (g ARN total/bandă; B, 50 (g proteină totală/bandă). Înțelesuri ANOVA, P †, HF vs. NF.
Efectul dietelor experimentale asupra expresiei tuturor celor trei UCP în BAT a fost analizat la nivelul ARNm (Tabelul 3). Dieta bogată pe termen lung în grăsimi a dus la creșterea nivelului de ARNm BAT UCP1, UCP2 și UCP3 (cu + 124%, + 66% și, respectiv, + 70%), în timp ce suplimentarea pe termen lung a vitaminei A a avut doar un efect semnificativ asupra ARNm UCP1 niveluri, care au crescut cu + 44%. A existat o interacțiune negativă între cele două variabile ale dietei, rezultând niveluri mai mici de ARNm BAT UCP1 în grupul HF + A decât în grupul HF.
Expresia UCP3 musculară reglată în sus a tratamentului RA acut la șoarecii RMN
Pentru a confirma efectul stimulator al retinoizilor asupra expresiei musculare UCP3 și reglarea diferențială a UCP3 în mușchi și BAT de către retinoizi, am analizat nivelurile de ARNm muscular și BAT UCP3 la șoareci RMN care fuseseră tratați acut cu all-trans-RA, comparativ cu controlul șoarecii care primesc numai vehicul. S-a demonstrat anterior că acest tratament are ca rezultat pierderea în greutate corporală, adipozitatea redusă și capacitatea termogenică îmbunătățită, cu niveluri crescute de expresie a ARNm atât ale UCP1 cât și ale UCP2 (dar nu UCP3) în BAT. 22,28,29 Așa cum se arată în Figura 3, tratamentul cu toate trans-RA a condus la o creștere semnificativă a ARNm UCP3 în mușchiul scheletic, dar, în conformitate cu rezultatele noastre anterioare, 28 nu a afectat nivelurile de ARNm UCP3 în BAT. Nivelurile serice de NEFA nu au fost afectate de tratamentul RA (șoareci martor: 1,77 ± 0,12 mEq/l; șoareci tratați cu RA: 1,66 ± 0,17 mEq/l; n= 9 pentru ambele grupuri).
Discuţie
Din câte știm, această lucrare constituie prima dovadă a reglării în sus a expresiei musculare UCP3 de către retinoizi in vivo. Am găsit această reglare ascendentă ca răspuns atât la tratamentul RA acut, cât și la suplimentarea dietetică cu vitamina A, la două tulpini de șoareci (B6 și RMN) și ambele la nivelul ARNm și la nivelul proteinelor. Aceste rezultate sunt în acord cu studiile in vitro care arată inducerea expresiei UCP3 de către RA în miotuburi diferențiate în cultura celulară. 24,25 Fără a aduce atingere efectelor post-transcripționale, efectul retinoizilor asupra expresiei UCP3 poate reflecta activitatea sporită a receptorului acidului retinoic: heterodimeri ai receptorului retinoid X (RAR: RXR) și/sau ai receptorului activat cu proliferatorul peroxizomului: RXR ( PPAR: RXR) heterodimeri, pentru care ambele elemente de răspuns au fost descrise în promotorul genei UCP3, 25.39, precum și în promotorul genei UCP1 (vezi ref. 1). Primii heterodimeri transactivează transcrierea la legarea all-trans-RA sau 9-cis-RA la porțiunea RAR, în timp ce aceștia din urmă necesită legarea 9-cis-RA la porțiunea RXR, pe lângă un ligand PPAR, pentru transcripție maximă activitate. 40,41
Efectul de reglare în sus a suplimentelor alimentare cu vitamina A și a tratamentului RA acut asupra nivelurilor de ARNm UCP3 s-a găsit în mușchi, dar nu și în BAT. Prin urmare, retinoizii ar trebui adăugați la lista hormonilor și a afecțiunilor care afectează diferențial expresia genei UCP3 în cele două țesuturi, care includ T3 și postul. 42 Pot fi sugerate mai multe ipoteze pentru a explica un efect muscular al retinoizilor. În primul rând, expresia genei UCP3 stimulată de RA ar putea necesita interacțiunea heterodimerilor RAR: RXR cu un factor de transcripție muscular specific. De fapt, s-a arătat în experimentele de transfecție că efectul stimulator RAR: RXR mediat de RA asupra expresiei genei UCP3 este complet dependent de co-transfecția MyoD, 25 un regulator principal al diferențierii celulelor musculare care este exprimat selectiv în celulele de linia miogenică. O altă posibilitate este că izoformele RAR și/sau RXR exprimate diferențial în mușchi și BAT mediază efectul retinoizilor asupra genei UCP3. În acest context, s-a raportat că, dintre cele trei izoforme RXR cunoscute, RXRγ prezintă o expresie restricționată în linia miogenă. 43
Creșterea forțată a nivelurilor circulante de NEFA sa dovedit a stimula expresia UCP3 la mușchiul șobolanului 49 și s-a raportat o corelație pozitivă între concentrațiile circulante de NEFA și nivelurile de ARNm muscular UCP3 la om. 50 Cu toate acestea, reglarea în sus a UCP3 în mușchiul scheletic în acest studiu, indiferent dacă este declanșată de alimentația cu conținut ridicat de grăsimi, suplimentarea dietei cu vitamina A sau tratamentul RA acut, nu ar putea fi explicată prin creșterea nivelului circulant al NEFA. Acest lucru este în acord cu efectul direct al RA asupra genei UCP3 și cu conceptul că reglarea expresiei UCP3 de către grăsime ar putea fi mai mult legată de creșterea efectivă a ratei de oxidare a grăsimilor decât de nivelurile ridicate de NEFA. în sine. De fapt, studiile la oameni sub diete bogate în grăsimi au arătat creșteri ale oxidării grăsimilor și ale expresiei UCP3 la nivelul mușchilor care nu au fost însoțite de creșteri ale nivelurilor circulante de NEFA. 47,51
Nivelurile mai scăzute de ARNm de leptină adiposă la șoarecii B6 hrăniți cu diete suplimentate cu vitamina A sunt în concordanță cu reducerea nivelului de ARNm de leptină adiposă după tratamentul RA acut la șobolani și șoareci 27,28 și reducerea nivelurilor de leptină circulantă după suplimentarea dietei cu vitamina A la șobolani. 30 Rezultatele noastre sugerează în continuare că retinoizii pot exercita ei înșiși un efect inhibitor asupra expresiei leptinei care nu este secundar unei reduceri a conținutului de grăsime, deoarece nivelurile de ARNm de leptină adiposă deprimate găsite nu s-au corelat cu reduceri comparabile ale masei depozitelor adipoase.
Pe scurt, rezultatele noastre nu susțin un rol al UCP3 muscular ca determinant major al eficienței metabolice și al echilibrului energetic, în conformitate cu rezultatele șoarecilor cu deficit de UCP3, 3,8, dar arată că expresia musculară UCP3 răspunde atât grăsimii, cât și cantitatea de vitamina A a dietei și dovedește o reglare diferențială a UCP3 de către retinoizi în mușchi și BAT de rozătoare.
- Plan de slăbire pentru dietă Exercițiul fizic mai subțire și planul bogat în proteine pentru a elimina locul 12
- The Tight Tan Slacks of Dezso Ban The High Protein Diet - John McCallum (iulie 1966)
- Efectul unei diete hipocalorice pe termen scurt asupra expresiei genelor hepatice și a factorilor de risc metabolici în
- Medicamente de top pentru slăbit Dieta bogată în proteine și slăbire Movimento Rete
- Rețeta VegStart Diet Triple Berry Protein Bowl pentru micul dejun