Suhana Ravi
4 Departamentul de fiziologie celulară și moleculară, Colegiul de Medicină al Universității de Stat din Pennsylvania, Hershey, PA; și
Rudolf J Schilder
5 departamente de entomologie și biologie, Universitatea de Stat din Pennsylvania, Colegiul de Stat, PA
Scot R Kimball
4 Departamentul de fiziologie celulară și moleculară, Colegiul de Medicină al Universității de Stat din Pennsylvania, Hershey, PA; și
Abstract
Precuparea ARNm (pre-ARNm) splicing este o etapă critică în expresia genelor care are ca rezultat îndepărtarea secvențelor intronice din ARNm imatur, ducând la producerea de ARNm matur care poate fi tradus în proteine. Splicarea alternativă pre-ARNm este procesul prin care exonii și/sau intronii alternativi sunt incluși sau excluși selectiv, generând ARNm maturi care codifică proteine care pot diferi ca funcție. Modificările rezultate ale modelului de exprimare a izoformei proteice pot duce la schimbări în interacțiunea proteină - proteină, localizarea subcelulară și fluxul prin căi metabolice. Deși mecanismele de bază ale îmbinării pre-ARNm ale intronilor și exonilor sunt caracterizate în mod rezonabil, modul în care aceste mecanisme sunt reglementate rămâne puțin înțeles. Scopul acestei revizuiri este de a evidenția anumite progrese recente în înțelegerea noastră asupra reglării splicingului pre-ARNm prin nutrienți și modularea metabolismului nutrienților care rezultă din modificările în splicarea pre-ARNm.
Introducere
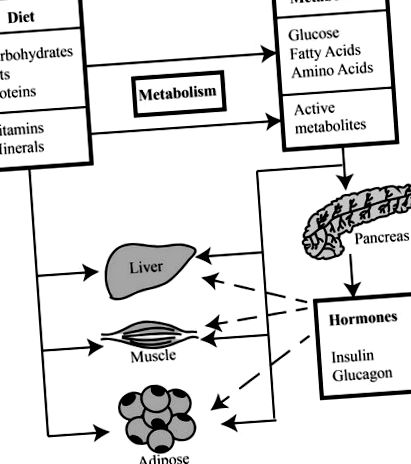
Reglarea nutrienților pentru îmbinarea alternativă. Metaboliții macronutrienților și micronutrienților alimentari acționează direct și indirect (de exemplu, prin hormoni produși de pancreas) pentru a modula evenimente de îmbinare alternative în țesuturile țintă. Acest proces este reglementat de semnalizarea căilor în aval de nutrienți, metaboliți și hormoni.
Pre-mARN Splicing
Marea majoritate a pre-ARNm la mamifere conțin introni care sunt eliminați prin 2 reacții de trans-esterificare catalizate de spliceozom și proteinele auxiliare asociate care au ca rezultat îndepărtarea unui intron și îmbinarea celor 2 exoni care se învecinează cu intronul (1) Figura 2 ). Nucleul spliceozomului este compus dintr-un complex de 5 particule mici de ribonucleoproteină nucleară (snRNP) care sunt recrutați în pre-ARNm într-o manieră dependentă de secvență. Procesul de îmbinare este sub o reglementare robustă pentru a asigura expresia specifică temporală și celulară și tisulară a variantelor de îmbinare. O parte din această reglementare se datorează utilizării de snRNP distincte și proteine auxiliare pentru diferite tipuri de evenimente de îmbinare. Cel puțin 45 snRNP au fost identificate ca componente ale spliceozomului și se știe că> 170 de proteine auxiliare reglează procesul. Splicarea este dinamică și remodelarea interacțiunilor ARN - proteină și proteină - proteină mediază progresia mașinilor de-a lungul pre-ARNm.
Proteină.
Disponibilitatea dietetică redusă a unuia sau mai multor aminoacizi esențiali duce la inducerea răspunsului la aminoacizi (AAR) care promovează activarea mai multor căi de semnalizare care controlează transcrierea, procesarea și rotația ARNm (28). Exprimarea mai multor gene în AAR, de exemplu, Asn sintetaza, este reglată prin activarea factorului de transcripție 3 (ATF3) și s-au identificat diferite variante de îmbinare a ATF3 în celulele din cultură private de histidină, ser sau glucoză (29). De exemplu, Pan și colab. (30) au observat că a existat o modificare a raportului expresiei ATF3 mRNA splice form ca răspuns la privarea de histidină din celulele HepG2. Izoforma ATF3 de lungime completă formează complexe cu corepresori și inhibă expresia genei AAR. Celelalte variante de îmbinare ATF3 codifică izoforme trunchiate care nu au domeniul de legare a ADN pentru genele AAR. Aceste izoforme trunchiate sechestrează corepresoarele asociate cu ATF3 și astfel mediază activarea transcrierii genei AAR. Din păcate, mecanismele implicate în reglarea indusă de aminoacizi a ATF3 pre-ARNm splicing nu au fost încă elucidate.
Reglarea îmbinării pre-ARNm de către micronutrienți
Vitamine.
Vitaminele sunt obținute în urme din dietă și metabolizate în formele lor active care se pot lega de receptorii de răspuns la vitamine și pot activa căile de semnalizare în aval. Efectele directe ale vitaminelor asupra îmbinării pre-ARNm sunt mediate de metaboliți activi, iar efectele indirecte sunt mediate de stresul oxidativ ca răspuns la deficitul de vitamine. Majoritatea vitaminelor, inclusiv a complexului de vitamina B și a vitaminei C, reglementează îmbinarea alternativă a propriilor transportatori și a proteinelor care leagă vitaminele. De exemplu, în cortexul cerebral uman au fost identificate 3 variante de îmbinare a Met sintazei (dependentă de vitamina B-12) (31). Vitaminele pot regla, de asemenea, expresia factorilor de îmbinare. De exemplu, s-a arătat că o dietă cu deficit de vitamina E scade expresia factorilor de îmbinare, cum ar fi componenta de îmbinare 35kDa (SC35) în ficat (32).
Vitamina D este un alt modulator important al îmbinării pre-ARNm (37). De exemplu, în celulele canceroase de colon, expresia diferitelor variante de îmbinare a enzimelor metabolizatoare ale vitaminei D, de exemplu, citocromul p450 24A (CYP24A), este controlată de forma activă a vitaminei, 1α, 25-dihidroxivitamină D [1,25 ( OH) 2D]. Au fost propuse mai multe mecanisme pentru reglarea îmbinării pre-ARNm de vitamina D. De exemplu, 1,25 (OH) 2D se poate lega de receptorul vitaminei D (VDR) și poate cupla reglarea transcripției și procesării elementului de răspuns la vitamina D - Conținând gene și pre-ARNm. Zhang și colab. (38) au arătat că coactivatorul receptorului nuclear/proteina care interacționează cu schiurile coregulator VDR (NCoA/SKIP) este o componentă a complexului spliceozomal și recrutarea acestuia la VDR este esențială pentru evenimentele de îmbinare dependente de vitamina D. În plus față de rolul său în celulele canceroase, 1,25 (OH) 2D mediază, de asemenea, expresia crescută a variantei scurte de îmbinare a pompei de calciu cu membrană plasmatică (PMCA) 1 în osteoblaste (39).
Minerale.
Mulți dintre transportorii de ioni minerali au variante de îmbinare cu funcții distinctive. De exemplu, au fost identificate 3 variante de îmbinare a cotransportorului de sodiu/potasiu/clorură (NKCC2), iar o dietă cu conținut scăzut de sare crește expresia izoformei cu afinitate ridicată NKCC2B în cortexul renal (40). Alte exemple includ modificări induse de hipertensiune arterială sensibilă la sare în modelul alternativ de îmbinare a pre-ARNm pentru canalul epitelial de sodiu (41), modificări induse de iodură dietetică în expresia diferitelor variante de îmbinare a simporterului de sodiu/iodură intestinal care rezultă în activitatea crescută de absorbție (42) și modificările induse de zinc în fosforilarea SRSF6 a proteinei SR care duc la modificări în splicarea mediatorului interacțiunea Bcl-2 a pre-ARNm a morții celulare (Bim) și modularea apoptozei în celulele neuroblastomului (43).
Concluzie
Exemplele de mai sus demonstrează că substanțele nutritive pot afecta atât direct, cât și indirect expresia genelor prin modularea îmbinării alternative a pre-ARNm. Astfel de evenimente au potențialul de a modifica nu numai procesele implicate în metabolismul nutrienților, ci și alte evenimente necesare pentru homeostazia celulară. Deoarece zona este încă relativ neexplorată, informațiile disponibile reprezintă probabil tipul de aisberg în ceea ce privește controlul nutrienților pentru exprimarea genelor. Cu toate acestea, având în vedere că pre-ARNm care codifică proteine reglatoare cheie (de exemplu, receptorul de insulină, receptorul de leptină, etc.) asociate cu boli precum obezitatea suferă evenimente importante de îmbinare, iar proteinele mecanice de îmbinare destul de limitate implicate, studii aprofundate ale efectele nutrienților asupra reglării proceselor de îmbinare constitutive și alternative probabil vor fi un efort fertil și ar putea duce la identificarea țintelor potențiale pentru intervenția terapeutică.
Mulțumiri
Mulțumim Dr. Leonard S Jefferson pentru comentarii utile în timpul pregătirii manuscrisului. SR, RJS și SRK au scris manuscrisul; SRK avea responsabilitatea pentru conținutul final. Toți autorii au citit și au aprobat versiunea finală a manuscrisului.
Note de subsol
6 Abrevieri: AAR, răspuns la aminoacizi; ATF3, activând factorul de transcripție 3; BIM, mediator Bcl-2-interacțiune a morții celulare; CYP24A, citocrom p450 24A; ER, reticul endoplasmatic; FADS, desaturaza acidului gras; GIP, polipeptidă insulinotropă dependentă de glucoză; GIPR, receptor polipeptidic insulinotrop dependent de glucoză; G6PD, glucoză-6-fosfat dehidrogenază; hnRNP, ribonucleoproteină nucleară eterogenă; IRE1α, proteină de semnalizare ER către nucleu care necesită inozitol, 1α; LCPUFA, PUFA cu lanț lung; NCoA/SKIP, coactivator al receptorului nuclear/proteină care interacționează cu schiurile; NKCC2, cotransportor sodiu/potasiu/clorură; ORF, cadru de lectură deschis; PKC, protein kinaza C; PMCA, pompă de calciu cu membrană plasmatică; pre-ARNm, ARNm precursor; RA, acid retinoic; RAR, receptor de acid retinoic; RARE, element de răspuns la acidul retinoic; SC35, component de îmbinare 35 kDa; SF2/ASF, factor de îmbinare 2/factor de îmbinare alternativ 1; snRNP, mici particule nucleare de ribonucleoproteină; Proteine SR, proteine bogate în serină/arginină; SRSF, factor de îmbinare bogat în serină/arginină; UPR, răspuns proteic desfășurat; VDR, receptor de vitamina D; XBP1, proteina 1 de legare a cutiei X; 1,25 (OH) 2D, 1α, 25-dihidroxivitamină D.
- Diferențe sexuale în obezitate, metabolismul lipidic și inflamație - Un rol pentru cromozomii sexuali PubMed
- Acțiuni origenice ale grelinei în modificările induse de hrănirea peștelui de aur în expresia mRNA a creierului și a intestinului
- Prezentare generală a tulburărilor de metabolizare a carbohidraților - copii; s Probleme de sănătate - manuale Merck Consumer
- Arătați 990 Dieta și stilul de viață ca terapie genică (Arhivă) - Oamenii; cu Farmacie
- Oxitocina poate juca un rol central în obezitate și sindromul metabolic HCPLive