Subiecte
Abstract
Introducere
Boala Parkinson (PD) este a doua cea mai frecventă tulburare neurodegenerativă, afectând până la 3% din populațiile vârstnice (> 65 de ani). PD se caracterizează prin deficite motorii, cum ar fi tremor, rigiditate și bradikinezie 1. Aceste simptome sunt cauzate în principal de pierderea neuronilor dopaminergici localizați în substanța neagră (SN) și zona tegmentală ventrală (VTA). Deoarece peste 90% din cazurile de PD sunt de origine sporadică, s-au înregistrat puține progrese în tratamentul bolii. În ultimii 40 de ani, cercetătorii s-au concentrat pe îmbunătățirea farmacologică a transmisiei dopaminergice, care este de obicei pusă în aplicare atunci când majoritatea neuronilor au dispărut deja.
Acest studiu a urmărit să înțeleagă dacă îmbunătățirea farmacologică a transmisiei noradrenergice realizată fie prin aplicarea cronică a unui inhibitor selectiv al recaptării NA (reboxetină, REB), fie a unui antagonist alfa2-AR (atipamezol, APM) poate ameliora efectele motorii ale pierderii progresive a neuronilor dopaminergici și dacă această stimulare noradrenergică poate avea efecte benefice asupra supraviețuirii neuronale dopaminergice și a conținutului de dopamină striatală într-un model de șoarece de parkinsonism progresiv.
Pentru a testa această ipoteză, am folosit un model condiționat de șoarece knock-out lipsit de factorul de inițiere a transcripției-IA (TIF-IA) caracterizat prin inhibarea inductibilă a unei funcții celulare fundamentale, cum ar fi sinteza ARNr în neuroni dopaminergici pentru a provoca neurodegenerarea lor progresivă 11 . Acești șoareci mutanți imită multe semnale distinctive ale PD, inclusiv vulnerabilitatea progresivă și selectivă a neuronilor SN, deficitele de coordonare motorie, precum și creșterea disfuncției mitocondriale și creșterea deteriorării stresului oxidativ 11. Important, așa cum s-a arătat anterior, unele dintre efectele acestei mutații pot fi parțial salvate prin administrarea L-DOPA 11, precum și prin inhibarea căilor de semnalizare pro-apoptotice, cum ar fi p53 și îmbunătățirea regulatorului principal al sintezei proteinelor, ținta mecanicistă de rapamicină (mTOR) 11,12, susținând utilizarea lor potențială ca model pentru terapiile care modifică boala împotriva neurodegenerării dopaminergice.
Materiale și metode
Animale
Ablația selectivă a TIF-IA la neuroni dopaminergici (șoareci TIF-IA DATCreERT2) a fost realizată folosind Cre/loxP abordare. Găzduirea șoarecilor transgenici Cre recombinaza sub promotorul transportorului de dopamină (DAT) (șoarecii DAT CreERT2) au fost încrucișate cu animale care adăpostesc gena TIF-IA cu oxigen, așa cum s-a descris anterior 11. Șoarecii mutanți masculi și femele au fost ținuți cu colegii lor de control (Cre-negativi) de același sex în cuști auto-ventilate în condiții standard de laborator (12 ore ciclu lumină/întuneric, hrană și apă ad libitum). Studiul a fost realizat în strictă conformitate cu recomandările din Ghidul pentru îngrijirea și utilizarea animalelor de laborator de la Institutele Naționale de Sănătate. Protocolul pentru toate studiile comportamentale a fost aprobat de Comitetul etic al animalelor de la Institutul de farmacologie, Academia Poloneză de Științe (Număr permis: 951/2012, eliberat: 28.06.2012).
Droguri și program experimental
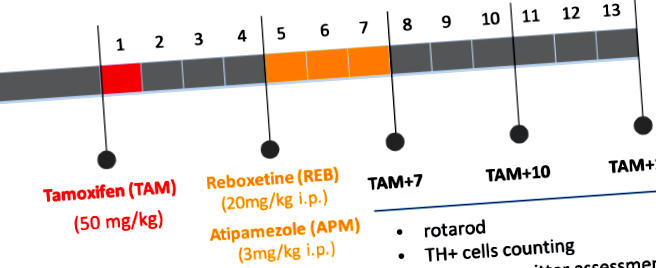
Pentru a activa recombinaza CreERT2 dependentă de tamoxifen la șoareci adulți (12 săptămâni) și a induce mutația, am aplicat tamoxifen (TAM) (Sigma-Aldrich, SUA) dizolvat în ulei la o doză de 1 mg/șoarece, de 2 ori pe zi timp de 5 zile consecutive, cu 4 săptămâni înainte de administrarea medicamentelor investigate. Animalele de control (w/t) au primit ulei singur. Reboxetina (REB) (Tocris Bioscience, SUA) și atipamezolul (APM) (Antisedan, Orion Pharma, Polonia) au fost administrate o dată pe zi, timp de 21 de zile consecutive, la doze de 20 mg/kg și, respectiv, 3 mg/kg. Grupurile martor au primit 0,9% NaCI. Toate analizele comportamentale și biochimice au fost efectuate la 7, 10 și 13 săptămâni după injecțiile TAM (TAM + 7, TAM + 10, TAM + 13), așa cum se vede în Fig. 1.
Diagramă de flux care rezumă proiectarea experimentală. TAM - tamoxifen, REB - reboxetină, APM - atipamezol; TAM + 7, TAM + 10, TAM + 13: 7, 10, 13 săptămâni după inducerea mutației (aplicarea tamoxifenului).
Test Rotarod
Testul rotarod a fost efectuat pentru evaluarea coordonării motorii. Testul a fost efectuat pe un rotarod accelerat (Ugo Basile, Italia). Evaluarea a fost precedată de o sesiune de antrenament cu o zi înainte de primul experiment (5 minute pe tija rotativă la o viteză constantă). În timpul sesiunilor experimentale efectuate în săptămânile 7, 10 și 13 după injecția cu tamoxifen, a fost măsurat timpul petrecut pe tija de accelerare (4 până la 40 rpm în 5 minute).
Analiza HPLC
Imunohistochimie
Procedura a fost efectuată așa cum s-a descris anterior 14, cu unele modificări. Pe scurt, creierele au fost îndepărtate, fixate timp de 48 de ore în paraformaldehidă (PFA) 4%, clătite și transferate la 0,4% PFA. După fixare, creierele au fost tăiate pe un vibratom (Leica, Germania) în secțiuni de 30 μm. Secțiunile din creierul mediu, inclusiv SN/VTA, au fost incubate peste noapte la 4 ° C cu anticorp anti-tirozin hidroxilază primară (TH) (1: 500, Millipore, SUA, nr. Pisică AB1542). Vizualizarea anticorpului primar legat de antigen a fost efectuată utilizând un anticorp secundar biotinilat adecvat urmat de incubare cu Complexul Avidin/Biotin (ABC; Vector Laboratories, SUA) și colorarea diaminobenzidinei (DAB; Sigma, SUA). Secțiunile colorate au fost achiziționate și analizate la microscopul cu lumină (Nikon Eclipse50i, Japonia) echipat cu o cameră și software NIS Elements. Cuantificarea celulelor TH-pozitive (TH +) a fost efectuată manual prin numărarea tuturor celulelor TH + pe secțiuni adiacente de la 6 animale din fiecare genotip/tratament într-un experiment cu un singur orb.
Culturi de celule midbrainiene embrionare primare și tratament medicamentos
analize statistice
Analiza statistică a fost efectuată cu software-ul Graph Pad Prism 7. Datele au fost evaluate prin analiza bidirecțională a varianței (ANOVA bidirecțională, genotip × tratament) cu comparații multiple ale grupurilor relevante din punct de vedere biologic (luând în considerare 3 puncte de timp diferite de analiză), urmate de testul post-hoc LSD Fisher. Valorile P mai mici de 0,05 au fost considerate semnificative statistic.
Rezultate
Tratamentul cu insuficiență motorie ameliorată de reboxetină la șoarecii TIF-IA DATCreERT2
Așa cum este indicat în Fig. 1, am indus ablația condiționată a TIF-IA prin injecție TAM și am început tratamentul de 21 de zile fie cu REB, fie cu APM la 4 săptămâni după TAM, timpul necesar unei recombinări eficiente induse de TAM. Pentru a investiga dacă REB sau APM pot avea vreun efect pozitiv asupra deficitelor motorii declanșate de pierderea progresivă a neuronilor dopaminergici la șoarecii TIF-IA DATCreERT2, am testat animalele de control și cele mutante la trei momente de timp diferite (7, 10 și 13 săptămâni după TAM (TAM + 7, TAM + 10 și TAM + 13) de către rotarod. Pe baza experimentelor anterioare acestea au fost etapele arătate anterior pentru a conduce la un parkinsonism progresiv, începând de la TAM + 7 (fără pierderi celulare) și dezvoltându-se în fenotipul comportamental sever. asociat cu degenerescență dopaminergică profundă la TAM + 13 11. După cum era de așteptat, șoarecii TIF-IA DATCreERT2 tratați cu VEH au relevat o scădere semnificativă a rezistenței (cu 57,7% față de control, animale tratate cu VEH, ANOVA cu două căi: genotipul F (2.218 ) = 12,63; p Figura 2
Tratamentul cu reboxetină a crescut supraviețuirea neuronilor DA la șoarecii TIF-IA DATCreERT2
Pentru a investiga în continuare impactul benefic sugerat al tratamentului REB asupra supraviețuirii neuronilor dopaminergici, am efectuat imunocolorare pentru a identifica celulele TH + din regiunea SN și VTA (Fig. 3), ceea ce a confirmat observațiile comportamentale inițiale. În special, șoarecii TIF-IA DATCreERT2 tratați cu REB au prezentat mai puține pierderi celulare în săptămâna 10 după inducerea tamoxifenului (TAM + 10). Șoarecii mutanți tratați cu VEH s-au caracterizat prin pierderea cu aproape 50% a celulei TH + comparativ cu animalele martor, care a fost semnificativ mai mică decât cea a mutanților tratați cu REB (49,7% față de 26,9%; 84,43; șoarecii p DATCreERT2 au prezentat pierderi semnificative de celule TH +, cu toate acestea pierderea celulară a fost ușor mai profundă la animalele tratate cu VEH. Un model similar de cinetică de degenerare a fost observat în VTA a TIF-IA DATCreERT2 tratată cu REB vs. șoareci (Fig. 3B, D).
Evaluarea neurodegenerării dopaminergice, astfel cum a fost dezvăluită prin imunocolorarea celulelor TH +. Colorarea imunohistochimică a celulelor TH + vizualizată în (A) SN și (B) Neuroni VTA; cuantificarea celulelor TH + efectuate în (C) SN și (D) Neuroni dopaminergici VTA. Barele reprezintă procentul controlului; TAM - tamoxifen, SAL - soluție salină, REB - reboxetină; TAM + 7, TAM + 10, TAM + 13: 7, 10, 13 zile după inducerea mutației (aplicare tamoxifen). Datele sunt media ± SEM; *** p # p DATCreERT2 la momentul relevant; n = 4.
Efectele tratamentului cu reboxetină asupra conținutului de dopamină și noradrenalină în striatul șoarecilor TIF-IA DATCreERT2
Deoarece nu a existat nicio diferență între grupurile experimentale la 7 săptămâni după inducerea TAM (TAM + 7) în ceea ce privește parametrii de performanță motorie și de numărare a celulelor TH +, datorită disponibilității limitate a șoarecilor mutanți, apoi ne-am concentrat asupra punctelor de timp TAM + 10 și TAM + 13 pentru a investiga în continuare efectele benefice ale REB asupra nivelului de dopamină (DA) în striatul șoarecilor TIF-IA DATCreERT2. După cum era de așteptat, mutația a produs o epuizare substanțială a DA la toate animalele la 13 săptămâni după inducerea tamoxifenului (TAM + 13) (ANOVA cu două căi: genotipul F (1,39) = 21,86; șoareci DATCreERT2 la 10 săptămâni după inducerea tamoxifenului ( TAM + 10) au prezentat niveluri semnificativ diferite de conținut de DA, în funcție de tratamentul medicamentos (ANOVA cu două căi: punctul de timp F (3,39) = 72,8; p Figura 4
Modificări ale nivelului țesutului de (A) dopamina (DA),B, C) metaboliții săi (DOPAC, HVA) șiD) nivelurile de noradrenalină (NA). Barele reprezintă valoarea reală a fiecărui neurotransmițător sau a metabolitului său în țesut pg/mg; TAM - tamoxifen, SAL - soluție salină, REB - reboxetină; TAM + 10, TAM + 13: -10, 13 zile după inducerea mutației (aplicare tamoxifen). Datele sunt media ± SEM; *** p ## p # p DATCreERT2 la momentul relevant; n = 6.
Fenilefrina agonistă alfa1-adrenergică a dezvăluit potențialul de supraviețuire în cultura de celule midbrain embrionare primare
Pentru a testa ipoteza dacă efectele benefice observate ale stimulării noradrenergice pot avea în sine un potențial neuroprotector posibil mediat de alpha1-AR, am efectuat un suplimentar in vitro experiment pe cultura primară a neuronilor embrionari ai creierului mediu derivate de la șoareci w/t C57Bl/6J. Celulele au fost tratate cu fenilefrină, un agonist selectiv al receptorului alfa1-AR. După adăugarea medicamentului și fără a mai schimba mediul, celulele au început să moară în timp. Fenilefrina a crescut supraviețuirea celulelor TH + în comparație cu culturile de celule netratate (Fig. 5A, B). Acest efect a fost similar cu aplicarea factorului de creștere GDNF, servind ca un control pozitiv. În special, aplicarea directă a fenilefrinei pe mediul de cultură a crescut semnificativ supraviețuirea celulelor TH + până la 49% față de celulele netratate, în timp ce eficacitatea tratamentului GDNF a atins 58% (Fig. 5B). Tratamentul cu REB nu a arătat niciun efect asupra numărului de celule TH +, cu toate acestea este important de reținut că REB acționează în principal ca un inhibitor al recaptării noradrenergice, cu o afinitate scăzută doar pentru receptorii alfa1-AR.
Discuţie
Deoarece rezultatele noastre anterioare au arătat că unele antidepresive administrate cronic, care acționează prin creșterea transmisiei noradrenergice, sporesc expresia alfa1-AR 19 și în lumina datelor care sugerează activitatea lor neuroprotectoare 20, aici, am decis să stabilim dacă tratamentul cronic cu reboxetină, un inhibitor noradrenergic foarte specific al recaptării, are orice efect pozitiv asupra evoluției simptomelor într-un model nou de parkinsonism progresiv. În plus, am extins această investigație prin includerea unui alt medicament, atipamezolul, un antagonist alfa2-AR cu potențial de a spori transmisia noradrenergică, dar cu un mecanism de acțiune farmacologic diferit prin blocarea autoreceptorilor alfa2-AR. Studiile experimentale pe animale sugerează că ar putea avea, de asemenea, efecte benefice în recuperarea după leziuni cerebrale și potențarea efectelor antiparkinsoniene ale medicamentelor dopaminergice 21 .
Spre surprinderea noastră, efectele benefice ale stimulării sistemului noradrenergic s-au limitat mai degrabă la tratamentul cu REB, nu la APM. Dintre șoarecii TIF-IA DATCreERT2 tratați cu medicamente, caracteristicile comportamentale au fost ameliorate de REB, nu de APM, reflectate de performanța motorului la testul rotarod la TAM + 13 (Fig. 2A, B). Aceste efecte pozitive ale tratamentului cu REB au fost aparent vizibile la nivel intracelular, în special la TAM + 10, o etapă în care am găsit un număr mai mic de neuroni dopaminergici SN după tratamentul cu REB și care, în plus, corespunde unui efect benefic al REB asupra nivelurilor de dopamină în striatul (Fig. 3, 4A).
Deoarece disponibilitatea animalelor transgenice este limitată, nu a fost posibil să se efectueze experimente cu mai multe doze din fiecare compus. Cu toate acestea, dozele de REB și APM au fost alese pe baza propriei experiențe anterioare și a datelor bine-cunoscute din literatura de specialitate cu privire la efectele acestor medicamente 22,23,24,25,26,27. În special, s-a dovedit că REB este extrem de eficient la o doză de 10 mg/kg 24,27 și sa demonstrat că APM sporește transmisia noradrenergică la o doză de 3 mg/kg 23. Cu toate acestea, alte rapoarte arată că diverși antagoniști alfa2-AR pot avea diferite efecte dependente de doză asupra comportamentului stimulat noradrenergic 28. În special, cel puțin la oameni, APM ar putea avea efectul secundar de reducere a abilităților de multitasking, care ar putea interfera cu capacitatea animalelor mutante mai vulnerabile de a face față cu tija accelerată 21. Cu toate acestea, pe baza constatărilor comportamentale inițiale care nu confirmă potențialul acestui medicament, am decis să efectuăm analize suplimentare numai la animalele tratate cu REB și la colegii lor de control.
Efectele potențiale benefice ale tratamentului REB asupra comportamentului motor în modelul TIF-IA DATCreERT2 au fost coroborate prin analiza pierderii neuronale SN/VTA, după cum se vede prin numărarea celulelor TH + (Fig. 3A - D), în special la 10 săptămâni după inducție. a mutației (TAM + 10) în regiunea SN. În acel moment, pierderea celulei TH + la șoarecii TIF-IA DATCreERT2 tratați cu VEH era clar vizibilă, în timp ce la mutanții tratați cu REB, nu diferea mult de colegii de control. Mai mult, a existat o diferență semnificativă între aceste două grupuri (Fig. 3C). La 13 săptămâni după inducerea tamoxifenului (TAM + 13), atât șoarecii tratați cu REB, cât și șoarecii TIF-IA DATCreERT2 tratați cu VEH au prezentat o pierdere clară a celulelor TH + în SN. Un model similar de modificări a fost observat în VTA (Fig. 3D).
În mod interesant, o lucrare anterioară a arătat efectele benefice ale REB asupra simptomelor nemotorii ale PD în modelul 6-hidroxidopamină (6-OHDA) 29. Mai mult, L-DOPA nu a modificat comportamentele depresive și anxioase în acest model 29. Deocamdată, nu avem dovezi ale simptomelor nemotorii la șoarecii TIF-IA DATCreERT2 și acest lucru va trebui abordat prin viitoare experimente.
Această idee este, de asemenea, în conformitate cu observația că medicamentele care vizează sistemele noradrenergice și serotoninergice (adică mirtazapina) pot fi terapeutice împotriva neurotoxicității MPTP la șoareci, posibil prin reglarea eliberării DA 35. Pentru a aborda această problemă, am analizat post-mortem niveluri de DA la două puncte de timp - 10 și 13 săptămâni după injecțiile cu tamoxifen. Am reușit să vedem efectele diferențiate ale tratamentului REB la 10 săptămâni după inducerea mutației (TAM + 10), astfel cum a fost dezvăluit de conținutul de dopamină în striatul șoarecilor TIF-IA DATCreERT2 tratați cu REB și tratați cu VEH (Fig. 4A). După 13 săptămâni (TAM + 13), nivelurile striatale de dopamină au fost profund diminuate la toți mutanții într-un grad similar, în ciuda tratamentului medicamentos (Fig. 4A). Acest lucru nu este surprinzător deoarece animalele din această etapă s-au dovedit a avea, de asemenea, măsuri mai mult sau mai puțin similare de pierdere a celulei TH + (Fig. 3A - D) și, așa cum sa menționat deja, ar fi foarte puțin probabil să ne așteptăm ca efectele a mutației poate fi amânată pentru o perioadă mai lungă de timp. Toate animalele tratate cu REB au fost, de asemenea, caracterizate prin niveluri mai ridicate de NA, care ar putea fi explicate prin modificări pe termen lung evocate prin tratament cronic, de 21 de zile, cu acest inhibitor de recaptare NA extrem de selectiv (Fig. 4D).
Ca rezumat, putem concluziona că tratamentul cu REB ar putea avea efecte benefice în PD. Cu toate acestea, rămâne neclar dacă aceste efecte sunt pur și simplu asociate cu modificări adaptive ca răspuns la stimularea sistemului noradrenergic sau cu o proprietate neuroprotectoare a stimulării noradrenergice asupra neuronilor dopaminergici. În această etapă, nu putem exclude faptul că fenotipul PD-like îmbunătățit la șoarecii TIF-IA DATCreERT2 tratați cu REB a fost, cel puțin parțial, asociat cu modificări adaptive după 3 săptămâni de tratament medicamentos și cu o transmisie noradrenergică intensificată, spori excitația și vigilența și astfel ar putea îmbunătăți capacitatea de a finaliza sarcina pe roata rotativă. Cu toate acestea, rezultatele noastre indică o posibilă influență a sistemului noradrenergic asupra neuronilor dopaminergici și susțin potențialul NA ca țintă terapeutică în PD, ceea ce a fost sugerat de alții 10,40,41 .
Referințe
Poewe, W. și colab. boala Parkinson. Nat Rev Dis Primers 3, 17013 (2017).
Braak, H., Ghebremedhin, E., Rub, U., Bratzke, H. & Del Tredici, K. Etapele dezvoltării patologiei legate de boala Parkinson. Cercetarea celulelor și a țesuturilor 318, 121-134 (2004).
- SteelSeries Rival 110, TrueMove1 personalizat, 7.200 CPI, 240 IPS, Prism RGB, Mouse optic pentru jocuri cu fir
- Rumer Willis Model dramatic de pierdere în greutate Mutare sau epavă emoțională E! Pe net
- Sfaturi pentru îngrijirea pielii Cum glicerina, apa de trandafiri și sucul de lămâie sunt benefice pentru piele
- Modelul rus Stefania Dubrovina are ochii scoși de sora geloasă
- Femeia de mărimea opt a spus că este prea grasă pentru a modela, în cele din urmă își găsește succesul după ce a câștigat trei pietre!