Abstract
fundal
Scopul acestui studiu a fost de a investiga ipoteza că suplimentarea alimentară cu tărâțe de orez fermentate cu Lentinus edodes (exo-biopolimer de tărâțe de orez, RBEP), o substanță cunoscută pentru a conține arabinoxilan, îmbunătățește activitatea celulelor natural killer (NK) și modulează producția de citokine la adulții sănătoși.
Metode
Acest studiu a fost conceput într-un format randomizat, dublu-orb, controlat cu placebo și în format paralel. Optzeci de participanți sănătoși cu număr de celule albe din sânge de 4.000-8.000 celule/μL au fost repartizați aleatoriu să ia șase capsule pe zi, fie cu 3 g RBEP, fie cu 3 g placebo timp de 8 săptămâni. Trei participanți la grupul placebo au fost excluși după inițierea protocolului; nu au fost raportate efecte adverse severe din suplimentarea RBEP. Activitatea celulelor NK a celulelor mononucleare din sângele periferic a fost măsurată folosind kituri de testare a citotoxicității non-radioactive și concentrațiile serice de citokine includ interferon (IFN) -γ, factor de necroză tumorală (TNF) -α, interleukină (IL) -2, IL-4, IL-10, și IL-12 au fost măsurate prin trusa de testare a citokinelor Bio-Plex. Acest studiu a fost înregistrat la Serviciul de informații pentru cercetarea clinică (KCT0000536).
Rezultate
Suplimentarea RBEP a crescut semnificativ producția de IFN-γ în comparație cu grupul placebo (P = 0,012). Cu toate acestea, suplimentarea cu RBEP nu a afectat nici activitatea celulelor NK, nici nivelul de citokine, inclusiv IL-2, IL-4, IL-10, IL-12 și TNF-α, comparativ cu grupul placebo.
Concluzii
Datele obținute în acest studiu indică faptul că suplimentarea cu RBEP crește secreția de IFN-γ fără a provoca efecte adverse semnificative și, prin urmare, poate fi benefică pentru persoanele sănătoase. Acest nou produs derivat din tărâțe de orez poate fi, prin urmare, potențial util pentru a include în formularea alimentelor solide și lichide concepute pentru tratamentul și prevenirea stărilor patologice asociate cu răspunsuri imune defecte.
fundal
Tărâțele de orez, un produs secundar major al procesării orezului, sunt în prezent o resursă subutilizată, chiar dacă este o sursă excelentă de compuși bioactivi valoroși, cum ar fi fibrele dietetice, vitaminele și antioxidanții [1]. Dintre fibrele dietetice conținute în tărâțe de orez, arabinoxilanul, pectina și β-glucanul au fost sugerate a fi polizaharide funcționale cu proprietăți de modificare a răspunsului biologic (BRM) [2]. De exemplu, s-a demonstrat că polizaharidele din tărâțe de orez activează celule imunologice care cuprind o parte a liniei de apărare a corpului împotriva cancerului [3, 4]. Cu toate acestea, funcționalitatea BRM-urilor care îmbunătățesc imunitatea în tărâțele de orez este limitată, deoarece BRM-urile sunt situate în peretele celular unde sunt complexate cu hemiceluloză [5].
Au fost dezvoltate procese enzimatice care separă polizaharidele biologic active de restul tărâțelor de orez, astfel încât aceste polizaharide să poată fi exploatate ca noi BRM [6, 7]. Tărâțe de orez fermentate cu Lentinus edodes (exo-biopolimerul cu tărâțe de orez, RBEP) este un supliment alimentar care se obține prin reacția tărâțelor de orez cu carbohidrați derivați din ciuperci Shiitake [8]. Mai mult, s-a demonstrat că RBEP suprimă creșterea celulelor canceroase ale melanomului prin îmbunătățirea activității celulelor natural killer (NK) la șoareci [2] și prin activarea ambelor celule macrofage in vivo și in vitro [5, 8]. S-a raportat, de asemenea, că diferite produse derivate din tărâțe de orez și coculturi de ciuperci cresc activitatea celulelor NK la pacienții cu mielom multiplu [9], șoareci canceroși [10] și limfocite [11, 12]. În special, suplimentarea nutrițională cu arabinoxilan, o polizaharidă derivată din tărâțe de orez, sa dovedit a crește activitatea celulelor NK la pacienții cu diferite tipuri de cancer [13].
Celulele NK joacă un rol crucial în apărarea anti-cancer a gazdei și, prin urmare, sunt strâns reglementate de mai multe mecanisme. Activarea celulelor NK pentru a distruge celulele țintă poate fi atât direct cât și indirect modulată de citokine, inclusiv interferon (IFN), interleukine (ILs) și factor de necroză tumorală (TNF) [14]. Studiile anterioare cu produse derivate din tărâțe de orez și coculturi de ciuperci au demonstrat, de asemenea, concentrații crescute de IFN-γ și TNF-α la pacienții cu mielom multiplu [9], pe lângă șoareci purtători de carcinom Ehrlich [10]. Cu toate acestea, nu s-au efectuat încă studii clinice la indivizi sănătoși pentru a investiga efectele suplimentării RBEP asupra activității celulelor NK și a concentrațiilor de citokine. Prin urmare, acest studiu randomizat, dublu-orb, controlat cu placebo, în paralel, a fost conceput pentru a testa ipoteza că suplimentarea RBEP îmbunătățește activarea celulelor NK și modulează producția de citokine la indivizii coreeni sănătoși.
Metode
Materiale de studiu
RBEP și placebo au fost preparate de Erom Corporation (Sungnam, Coreea) în conformitate cu metoda raportată de Yu și colab. [8]. Scurt, Lentinus edodes a fost coculturat în mediul său adecvat de creștere cu tărâțe de orez până când s-a observat o creștere semnificativă a miceliilor. Următorul, Lentinus edodes componentele miceliei și tărâțelor de orez insolubile au fost îndepărtate prin centrifugare. Folosind extracția alcalină și precipitarea etanolului, polizaharidele au fost colectate din supernatantele rezultate și apoi liofilizate. Acidul uronic a fost utilizat ca compus marker pentru RBEP. Tabelul 1 prezintă compoziția chimică a RBEP. Placebo a conținut 430,69 mg amidon de porumb, 69,29 mg coloranți alimentari și 2,51 mg acid stearic. S-au furnizat zilnic șase capsule cu 3 g RBEP sau placebo.
Design de studiu
Acest studiu a fost un studiu clinic de 8 săptămâni, randomizat, dublu-orb, controlat cu placebo și în grup paralel. Toate lucrările descrise aici au fost aprobate de Consiliul de Revizuire Instituțională al Spitalului Universitar Hanyang (HYUH 2012-05-008). Prezentul studiu a fost realizat în conformitate cu Declarația de la Helsinki și s-a obținut consimțământul scris în scris de la toți participanții. Acest studiu a fost înregistrat la Serviciul de informații pentru cercetarea clinică (KCT0000536).
În total, fiecare pacient a suferit 1 screening și 3 vizite în acest studiu. La screeningul inițial, participanții au fost intervievați pentru a colecta date de sociodemografie, iar istoricul medical a fost obținut printr-un interviu, iar numărul de celule albe din sânge (WBC) a fost măsurat. Înălțimea a fost măsurată fără pantofi folosind un stadiometru, iar greutatea a fost măsurată în timp ce participanții purtau haine ușoare fără pantofi folosind un Inbody 720 (Biospace Corporation, Seoul, Coreea). Vizitele au avut loc la următoarele ore după screening-ul inițial: vizita 1 (săptămâna 0), 7-10 zile după ecranare; vizitați 2, 4 săptămâni după ecranizare; și vizitați 3, 8 săptămâni după ecranizare. La toate vizitele, au fost luate măsurători ale rezultatelor și au fost efectuate evaluări ale siguranței. Probele de sânge și urină de post au fost colectate și depozitate la -20 ° C până la analiză. În săptămânile 4 și 8, conformitatea a fost monitorizată prin numărarea numărului de capsule rămase.
Participanții au fost rugați să nu ia produse de sănătate care conțin tărâțe de orez fermentate și să nu-și schimbe stilul de viață obișnuit și dieta în timpul studiului. Înregistrările dietetice de trei zile au fost utilizate pentru a monitoriza modificările dietelor în săptămânile 0, 4 și 8; aceste înregistrări au fost analizate cu CAN-pro 4.0 (Computer Aided Analysis Program 4.0 for professionals, Korean Society of Nutrition, Seoul, Korea).
Participanți
Participanții au fost recrutați prin afișe publicitare și ziare în septembrie 2012. Au fost selectați o sută șaizeci și trei de voluntari și 80 de participanți au fost eligibili să participe la acest studiu. Participanții au fost incluși în cazul în care aveau 25-70 de ani, nu erau însărcinate sau alăptau și aveau un număr WBC între 4.000-8.000 de celule/μL. Participanții au fost excluși dacă au avut vreo boală infecțioasă; o boală cronică, cum ar fi boli cardiovasculare, diabet zaharat, boli de rinichi, boli tiroidiene sau tulburări psihiatrice; sau a luat orice medicament sau supliment în mod regulat în ultimele 3 luni. Alte criterii de excludere au inclus un nivel de creatinină ≥ 2 ori limita superioară normală și un nivel de aspartat aminotransferază (AST) sau alanin aminotransferază (ALT) ≥ 3 ori limita superioară normală.
Măsurători ale rezultatelor
Activitatea celulelor NK și concentrațiile de citokine au inclus IFN-γ, TNF-α, IL-2, IL-4, IL-10 și IL-12 au fost măsurate la săptămânile 0, 4 și 8. Pentru a măsura activitatea celulelor NK, sângele periferic celulele mononucleare (PBMC) au fost preparate prin separarea gradientului de densitate. Celulele peletate au fost resuspendate în soluție salină tamponată cu fosfat, iar viabilitatea lor a fost determinată folosind soluție de albastru tripan. Pentru a măsura activitatea celulelor NK, s-au folosit truse de testare a citotoxicității non-radioactive (Promega Inc., Madison, WI, SUA). Celulele efectoare (PBMC) au fost însămânțate în plăci cu 96 de godeuri, cu celule K562 (Korean Cell Line Bank, Seoul, Coreea) utilizate ca celule țintă. Raportul dintre celulele efector și țintă a fost de 10: 1 și fiecare test a fost efectuat în triplicat. Testele au fost efectuate conform instrucțiunilor producătorului. Pe scurt, plăcile au fost incubate la 37 ° C cu 5% CO2 timp de 4 ore. Absorbanțele la 490 nm au fost apoi citite cu un cititor de microplacă iMark ™ (Bio-Rad Laboratories, Inc., Hercules, CA, SUA). Citotoxicitatea a fost calculată utilizând următoarea formulă:% citotoxicitate = [(experimental - efector spontan - țintă spontan)/(maxim țintă - țintă spontan)] × 100.
Concentrațiile serice de citokine au fost măsurate folosind kitul de testare a citokinelor Bio-Plex (Bio-Rad Laboratories, Inc., Hercules, CA, SUA) conform protocolului producătorului. Analiza datelor a fost efectuată cu software-ul Bio-Plex Manager 6.1 (Bio-Rad Laboratories, Inc.).
Evaluarea siguranței
Evenimentele adverse, consumul de droguri și tratamentul terapiei au fost înregistrate în timpul studiului. Testele de laborator de hematologie, testele de chimie a sângelui și analiza urinei au fost efectuate cu un hemocitometru Coulter STKS (Beckman Coulter Inc., Fullerton, CA, SUA), un analizor automat Hitachi 7150 (Hitachi Ltd., Tokyo, Japonia) și un automat Clinitek Atlas analizor de chimie a urinei (Siemens Healthcare Diagnostics, NY, SUA), respectiv. Toate analizele au fost efectuate la Laboratorul Biomedical din Coreea. Tensiunea arterială și frecvența pulsului au fost măsurate cu un dispozitiv Omron HEM-7051 (Omron Healthcare, Kyoto, Japonia); temperatura corpului a fost măsurată cu un termometru cu infraroșu (Thermoscan IRT-4020, Braun Corporation, Kronberg, Germania).
Randomizare
O statistică independentă, orbită de studiu, a pregătit o schemă de randomizare generată de computer, permițând randomizarea în blocuri. Containerele numerotate secvențial cu RBEP sau placebo au fost obținute de la producător și au fost alocate aleatoriu participanților la prima vizită. Codurile de identitate au fost ascunse în plicuri opace numerotate secvențial, gestionate de cercetătorii studiului și monitorizate de asociații de cercetare clinică (Neonutra Corporation, Seoul, Coreea). Tot personalul studiului și participanții au rămas orbiți de codurile de identitate pe tot parcursul studiului.
analize statistice
Acest studiu a vizat o dimensiune a eșantionului de 32 în fiecare grup, pentru a obține o putere statistică de 80% (P
Rezultate
Caracteristicile participanților
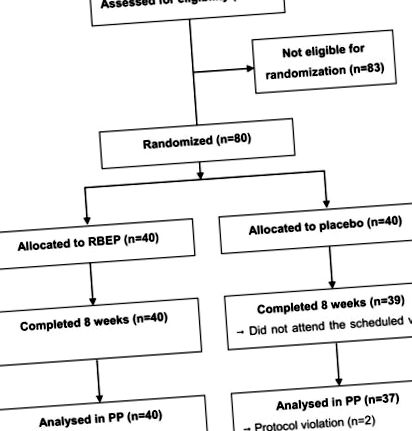
O diagramă schematică a fluxului de lucru al studiului este prezentată în Figura 1. În grupul placebo, 1 participant nu s-a prezentat la a doua vizită și 2 participanți au fost eliminați din studiu din cauza încălcărilor protocolului. Conformitatea nu a fost semnificativ diferită între grupurile RBEP și placebo (89,1 ± 10,8% față de 91,7 ± 8,2%; P = 0,240). În timpul studiului, nu s-au observat modificări semnificative ale aportului de nutrienți între cele două grupuri (datele nu sunt prezentate). De asemenea, cele două grupuri nu au prezentat diferențe semnificative în ceea ce privește vârsta, numărul WBC, nivelul hormonului stimulator al tiroidei, sexul, IMC, prezența istoricului familial legat de tulburări imune, numărul participanților căsătoriți sau șomeri sau numărul fumătorilor actuali sau băutor curent (Tabelul 2). Treisprezece participanți la grupul RBEP și unsprezece la grupul placebo au făcut exerciții regulate, de mai mult de 3 ori pe săptămână cu 30 de minute sau mai mult. În plus, doi participanți au avut tulburări musculo-scheletice, un participant a avut tulburări ale sistemului reproductiv și doi participanți au avut tulburări respiratorii în decurs de 6 luni înainte de studiu. Cu toate acestea, niciuna dintre tulburări nu a fost severă și nimeni nu a avut probleme actuale de sănătate.
Diagrama schematică a profilului de studiu. RBEP, tărâțe de orez fermentate cu Lentinus edodes.
Rezultate primare și secundare
La momentul inițial, primar, activitatea celulelor NK și rezultatele secundare, nivelurile de citokine nu au fost semnificativ diferite între cele două grupuri (Tabelul 3). Suplimentarea cu RBEP a crescut semnificativ nivelul IFN-γ comparativ cu grupul placebo în săptămâna 8 (P = 0,012). Cu toate acestea, suplimentarea cu RBEP nu a avut efecte semnificative asupra nivelurilor de IL-2, IL-4, IL-10, IL-12 sau TNF-α în comparație cu tratamentul cu placebo. Suplimentarea RBEP a îmbunătățit activitatea NK în grupul RBEP, dar nu a îmbunătățit activitatea celulelor NK atunci când grupul RBEP a fost comparat cu grupul placebo.
Evaluarea siguranței
Evenimente adverse minore au fost raportate la 11 participanți (26,19%, 15 cazuri) în grupul RBEP și 18 participanți (42,86%, 23 de cazuri) în grupul placebo; această diferență nu a fost semnificativă (P = 0,108; Tabelul 4). Numărul evenimentelor adverse considerate a fi posibil legate de intervenții, probabil care nu au legătură cu intervențiile și cu siguranță nu au legătură cu intervențiile au fost 3, 2 și 3 în grupul RBEP și, respectiv, 1, 10 și 19 în grupul placebo.
Numărul mediu de trombocite a fost semnificativ mai mic pentru grupul RBEP decât pentru grupul placebo doar la momentul inițial, iar numărul mediu de globule roșii a scăzut semnificativ în grupul RBEP (P = 0,016, Tabelul 5). Cu toate acestea, nu s-au observat diferențe semnificative în alți parametri hematologici, valorile chimiei sângelui, greutatea, tensiunea arterială, pulsul sau temperatura corpului între cele două grupuri. De asemenea, analiza urinei nu a evidențiat diferențe semnificative între cele două grupuri (datele nu sunt prezentate). Toți parametrii hematologici, valorile chimiei sângelui și rezultatele analizei urinei au rămas în limitele normale.
Discuţie
Acesta a fost primul studiu randomizat, dublu-orb, controlat cu placebo, în paralel, care a investigat efectele imun-modulatorii ale RBEP la adulții sănătoși. Acest studiu de grup a arătat că suplimentarea cu RBEP a crescut semnificativ nivelurile de IFN-γ în comparație cu grupul placebo, dar suplimentarea cu RBEP nu pare să îmbunătățească activitatea celulelor NK în comparație cu grupul placebo. Foarte important, suplimentarea RBEP nu a provocat efecte adverse semnificative în prezentul studiu.
În acord cu rezultatele obținute în prezentul studiu, studiile anterioare au raportat că un arabinoxilan izolat din tărâțe de orez a crescut semnificativ nivelurile de IFN-γ la pacienții cu mielom multiplu [9], la șoareci cu ascită Ehrlich [10] și la in vitro studii [11, 12, 20]. Mai mult, polizaharidele din Angelica sinensis și din rădăcina Sanguisorba officinalis s-a demonstrat că crește producția de IFN-γ în celulele splinei [21] și, respectiv, șoarecii purtători de tumori [22]. S-a propus că această acțiune de îmbunătățire imună a arabinoxilanului este legată de secreția crescută de IFN-γ care însoțește activarea celulelor NK [11]. Totuși, IFN-γ este produs nu numai de celulele NK, ci și de celulele T și B [23].
Studiile anterioare au raportat, de asemenea, că suplimentarea cu RBEP activează ambele macrofage in vivo și in vitro [5, 8]. Un arabinoxilan obținut din tărâțe de orez, frunzele verzi ale Litsea glutinosa, S-a demonstrat că și tărâțele de grâu cresc activitatea macrofagelor in vitro [24, 25] sau la șoareci purtători de tumori [26]. În plus, un arabinoxilan izolat din tărâțe de orez a crescut funcția celulelor T CD4 + în celulele dendritice derivate din monocite umane [20] și a crescut proliferarea celulelor T și B la ambii oameni cu și fără cancer [13, 27]. Studiile anterioare au raportat în mod constant că polizaharidele din primula de seară, Curcuma xanthorrhiza, și Angelica sinensis crește activitatea macrofagelor și/sau proliferarea celulelor T, fie in vivo sau in vitro [21, 28, 29]. Aceste date, în combinație cu datele prezentate în acest studiu, sugerează că producția crescută de IFN-γ rezultată din suplimentarea RBEP poate fi mediată fie de macrofage, celule B sau celule T și probabil că nu este mediată de celulele NK.
Kim și colab. a arătat că suplimentarea cu RBEP nu a prezentat toxicitate hematopoietică la un model de șoareci de tumori solide, oferind astfel dovezi importante că RBEP este sigur și ar putea fi utilizat atât pentru prevenirea, cât și pentru tratarea cancerului [2]. Creșterea numărului de globule roșii a fost observată la pacienții cu inflamație [30] și s-a dovedit a fi asociată cu o mortalitate crescută prin cancer [31]. În studiul de față, suplimentarea cu REBP a dus la o scădere neglijabilă a numărului de WBC; cu toate acestea, numărul de participanți WBC a rămas în intervalul normal și, prin urmare, această constatare este clinic nesemnificativă.
Concluzii
Acesta a fost primul studiu randomizat, dublu-orb, controlat cu placebo, în paralel, care a investigat efectele imun-modulatorii ale RBEP la adulții sănătoși. Datele prezentate aici sugerează că suplimentarea RBEP crește semnificativ producția de IFN-γ, dar nu îmbunătățește activitatea celulelor NK; în plus, suplimentarea cu RBEP nu este asociată cu efecte adverse semnificative.
- Efectele suplimentării dietetice cu picolinat de crom asupra glucozei, colesterolului și mineralelor serice
- Efectul fibrelor alimentare insolubile cu tărâțe de grâu cu dimensiuni diferite ale particulelor asupra texturii
- Tărâțul de orez scade colesterolul Alimentație sănătoasă SF Gate
- Suplimentarea dietetică a extractului de ciuperci îmbunătățește creșterea și nivelurile antioxidante ale Babiloniei
- Șoldul trandafir dietetic exercită efecte antiaterosclerotice și crește dilatarea mediată de oxidul azotic în