Abstract
fundal
Administrarea ceto-analogilor joacă un rol important în terapia complementară a bolii renale cronice cronice (CKD), cu toate acestea, studiile anterioare privind efectul lor reno-protector s-au concentrat în principal pe modificările patologice renale induse de nefrectomie. Acest studiu a fost conceput pentru a investiga mecanismele alternative subevaluate în prezent prin care comprimatele compuse α-cetoacide (KA) au influențat leziunile renale murine induse de ischemie - reperfuzie (IR) și pentru a testa starea actuală a administrării KA în ceea ce privește progresia CKD staving la pacienții cu CKD chinezi în diferite etape.
Metode
În experimentul pe animale, intervenția chirurgicală IR a fost efectuată pentru a imita leziunile renale cronice progresive, în timp ce KA a fost administrat pe cale orală. Pentru cercetarea clinică, a fost realizat un studiu de cohortă retrospectiv pentru a delimita utilizarea și efectele KA asupra atenuării exacerbării CKD. Evenimentul CKD al punctului final a fost definit ca o reducere cu 50% a ratei inițiale estimate de filtrare glomerulară (eGFR). Analiza Kaplan - Meier și modelul de regresie proporțională a pericolului COX au fost adoptate pentru a calcula probabilitatea cumulată de a atinge punctul final și raportul de pericol al deteriorării funcției renale.
Rezultate
Într-un studiu pe animale, KA a prezentat un efect protector asupra leziunilor renale și fibrozei induse de IR prin atenuarea infiltrării inflamatorii și a apoptozei prin inhibarea căilor factorului nuclear-kappa B (NF-κB) și a protein kinazei activate de mitogen (MAPK). În cercetările clinice, după ajustarea factorilor demografici de bază, pacienții din stadiile 4 și 5 din grupul KA au prezentat o incidență mult mai întârziată și mai lentă a scăderii eGFR comparativ cu cei din grupul fără KA (raport de risc (HR) = 0,115, interval de încredere de 95% (CI) 0,021-0,639, p = 0,0134), demonstrând un efect pozitiv al KA asupra staving progresia CKD.
Concluzie
KA a îmbunătățit leziunea renală cronică indusă de IR și fibroza și a părut a fi un factor de protecție prospectiv în boala renală în stadiu final.
fundal
Boala renală cronică (CKD) a devenit o problemă crucială în domeniul sănătății publice datorită modificărilor și complicațiilor sale patologice progresive, ireversibile, inclusiv anemie, dislipidemie și hiperparatiroidism. Studiile anterioare au demonstrat că metabolismul proteinelor, care provine în principal din dieta zilnică, este implicat în majoritatea acestor modificări patologice adverse [1]. Astfel, intervenția dietetică cu aport restricționat de proteine a fost propusă ca o strategie terapeutică extrem de importantă pentru a întârzia declinul progresiv al funcției renale și dezvoltarea CKD.
Modelul de leziune a ischemiei-reperfuziei renale (IR) conferă avantajul observării reparației renale după leziuni renale acute, în timp ce imită ischemia renală tranzitorie în cazuri clinice, cum ar fi insuficiența multiplă de organ și transplantul pre-renal, oferind astfel o perspectivă asupra supraviețuirii alogrefelor după transplantul de rinichi [ 15, 16]. Terapia ceto-analogilor cu LPD asigură un aport suficient de aminoacizi esențiali fără risipa de proteine și excesul de producție și acumulare de toxine metabolice. Înțelegerea în continuare a mecanismului său de acțiune în CKD ar fi benefică pentru extinderea aplicațiilor sale.
În acest studiu, am adoptat un model IR pentru a investiga mecanismul molecular al tabletelor compuse α-cetoacide (KA) în bolile renale din unghiul inflamației și apoptozei. Suplimentarea cu KA a inhibat căile factorului nuclear-kappa B (NF-κB) și a protein-kinazei activate cu mitogen (MAPK), rezultând o ameliorare a inflamației și apoptozei, reducând astfel progresia CKD. Experimentul pe animale a oferit dovezi suplimentare pentru a susține efectele reno-protectoare ale KA în CKD, așa cum s-a văzut în cercetarea noastră clinică.
Metode
Animale
Șoareci masculi C57BL/6 în vârstă de 2 luni (cântărind 25 g) au fost cumpărați de la Beijing Huafukang Laboratory Animal Technology Co., Ltd, Beijing, China și au fost aclimatizați timp de 1 săptămână. Șoarecii au fost anesteziați cu pentobarbital de sodiu 1% (0,01 mL/g, Sigma, SUA) prin injecție intraperitoneală. Chirurgie IR: rinichii bilaterali ai șoarecilor au fost strânși în 26 de minute (Roboz Surgical Instrument Co, Germania). Fluxul sanguin renal a fost restabilit în câteva secunde după îndepărtarea clemei de arteră murină. Operații întregi au fost efectuate la 36,6 ° C - 37,2 ° C folosind o mașină de control al temperaturii (FHC, SUA). Animalele au fost împărțite în trei grupe: Sham, IR + Nacl, IR + KA, n = 4-6/grup. Șoarecii din grupul fals au fost supuși aceleiași intervenții chirurgicale, cu excepția clampării vaselor renale. Șoarecii din grupul IR + Nacl au fost supuși unei intervenții chirurgicale IR și au fost tratați cu Nacl. Șoarecii din grupul IR + KA au fost operați cu intervenție chirurgicală IR și tratați cu KA (FreseniusKabi, Germania). Ambii rinichi au fost recoltați la 28 de zile după operația IR. Toate experimentele au fost aprobate de Comitetul de îngrijire și utilizare a animalelor din Spitalul Tongji (numărul IACUC: S851) și efectuate în conformitate cu orientările NIH.
Pregătirea și administrarea KA și LPD
Tabletele α-cetoacide compuse au fost confecționate printr-un amestec de 0,375 g α-cetoacid la 6 mL 0,9% Nacl, la o concentrație finală de 62,5 mg/mL și au fost administrate prin gavaj gastric. Concentrația de administrare a fost de 1000 mg per kg de greutate de șoarece pe zi. LPD a fost furnizat de WQJX BIO-Technology (Wuhan, China). Dieta a fost compusă din cazeină (6,5%), amidon (66,45%), glucoză (10%), ulei de soia (7%), fibrină (5%), sare minerală (3,5%), vitamină (1%), l -cistină (0,3%) și clorură de colină (0,25%) în conformitate cu dieta de rozătoare a Asociației Dietetice Americane, cu o calorie de 3,5 kcal/g pentru a satisface necesarul de energie. În grupul IR + KA, șoarecii au fost tratați cu KA și LPD. În comparație, șoarecii din grupul IR + Nacl au fost tratați cu 0,9% Nacl și LPD.
Detectare BUN, TC și TG
Azotul uree din sânge (BUN), colesterolul total (TC) și trigliceridele (TG) au fost testate folosind kituri (Changchunhuili, China) conform instrucțiunilor producătorului.
Colorare histologică, imunocitochimică și imunofluorescentă
Rinichii bilaterali ai șoarecilor au fost fixați în paraformaldehidă 4% și încorporați în parafină. Rinichii încorporați cu parafină au fost secționați la 3 μm. Colorarea patologică pentru colorarea periodică cu acid-Schiff (PAS) și roșu Sirius au fost efectuate pentru a evalua gradul de leziune tubulară renală și fibroza interstițială. Pentru colorarea imunofluorescentă (IF), secțiunile au fost colorate cu anticorp primar Kim-1 (1: 800; R&D), lectină tetragonolobus de lotus (LTL, 1: 100, Vector Lab), actină musculară alfa-netedă (α-SMA, 1: 100, Abcam), Colagen I (1: 100, Abcam), CD45 (1:50, Biolegend), CD3 (1:50, Guge, Wuhan) și Ly6G (1:50, Biolegend) la 4 ° C peste noapte și fluorescente anticorpi secundari marcați. Nucleii au fost colorați cu 4'-6-diamidino-2-fenilindol (DAPI). Datele au fost analizate de software-ul Image Pro Plus (Media Cybemetics, Rockville, MD, SUA) într-un mod orbit.
Western blot
Țesuturile renale au fost lizate în tampon de liză RIPA (Promoter, Wuhan, China) care conține inhibitor de protează (Promoter, Wuhan, China). Proteinele celulare au fost colectate în același mod. Concentrația totală de proteine a fost determinată utilizând un kit de testare a proteinelor BCA (Promoter, Wuhan, China). Proteinele au fost separate prin electroforeză pe gel de dodecil sulfat de sodiu - poliacrilamidă (SDS-PAGE) și transferate în membrane de difluorură de poliviniliden (PVDF, Millipore, Billerica, MA, SUA). Membranele au fost blocate cu lapte degresat 5% în TBS cu 0,1% Tween-20 timp de 1 oră la 37 ° C și apoi testate cu anticorpi împotriva α-SMA (1: 5000, Abcam), PDGFR-β (1: 3000, Abcam ), Fibronectin (1: 1000, Abcam), Bcl-2 (1: 1000, Abclonal), BAX (1: 1000, Abclonal), Caspase 3 (1: 1000, Abclonal), NFATc-1 (1: 1000, Abcam )), total și fosforilat-65, -38 și -ERK (1: 1000, tehnologie de semnalizare celulară, SUA) și GAPDH (1: 4000, Abbkine) la 4 ° C peste noapte. Bloturile au fost spălate a doua zi și incubate cu anticorpi secundari conjugați cu HRP timp de 1 oră la 37 ° C. Intensitățile semnalului benzii vizate au fost cuantificate folosind Image J (NIH, SUA).
PCR cantitativ în timp real
ARN-ul total a fost extras folosind reactivul Trizol conform instrucțiunilor producătorului (Invitrogen, SUA). O microgramă ARN a fost transcrisă invers în ADNc catenă primară folosind sistemul de transcripție inversă GoScript (Promega, SUA) într-un sistem de reacție de 20 μL. Parametrii de ciclu au fost utilizați după cum urmează: 40 de cicluri de denaturare a pf la 95 ° C timp de 15 s și recoacere la 60 ° C timp de 60 s. Au fost procesate experimente triplate pentru fiecare probă. PCR cantitativă a fost realizată folosind master master SYBR (Qiagen, Germania) pe lumina Roche 480II. Nivelurile de expresie ale ARNm ale mai multor markeri, inclusiv TGF-β, fibronectină și Colagen I, au fost efectuate prin metoda pragului de ciclu comparativ (Ct) și normalizate la nivelurile de expresie ale GAPDH. Secvențele primare au fost enumerate în Tabelul 1.
Informații de bază despre pacienții clinici cu CKD colectate de la spitalul Tongji
Un număr total de 894 de pacienți ambulatori și pacienți internați au fost recrutați din aprilie 2015 până în septembrie 2018 în spitalul Tongji, colegiul medical Tongji, universitatea de știință și tehnologie Huazhong pentru studii transversale și retrospective. Un număr total de 452 de pacienți au fost excluși, (1) hemodializă, dializă peritoneală sau transplant renal la începutul timpului înscris; (2) timpul de urmărire a fost mai mic de 2 ori; (3) datele de bază lipsesc substanțial. Dintre restul de 442 de pacienți înscriși, 119 au fost în stadiul 1 și 2, doar 9 pacienți au primit KA, ceea ce a influențat foarte mult rezultatul analizei. Pentru restul de 323 de pacienți din stadiul 3-5, 148 de pacienți au luat KA au fost împărțiți în grupul KA, ceilalți 175 de pacienți au fost împărțiți în grupul No-KA. Studiul clinic a fost aprobat de Comitetul de Etică Medicală al Spitalului Tongji, Colegiul Medical Tongji, Universitatea Huazhong de Știință și Tehnologie (TJ-IRB20180501). Ne-am înregistrat în Registrul de studii clinice din China (ChiCTR1800016536).
analize statistice
Datele au fost exprimate ca valoare a numărului (%) pentru variabilele categorice și media ± SD pentru variabilele continue. Comparațiile dintre cele două grupuri au fost făcute de nonparametric T test pentru variabilele continue în timp ce χ 2 test pentru variabilele categorice. Analiza Kaplan - Meier și modelul de regresie proporțională a pericolului COX au fost adoptate pentru a calcula probabilitatea cumulată de a atinge punctul final și raportul de pericol al deteriorării funcției renale. Analizele statistice au fost efectuate de SAS v9.4 (SAS, Inc., 200 Cary, NC, SUA) și toate valorile P calculate ca două fețe. Asocierea a fost considerată semnificativă cu valori p mai mici de 0,05.
Rezultate
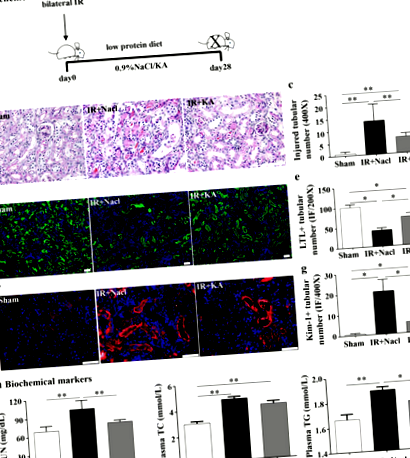
Suplimentul KA a protejat șoarecii de leziuni renale induse de IR și tulburări metabolice
Suplimentul KA a îmbunătățit fibroza interstițială indusă de IR
Suplimentul KA a atenuat infiltrarea inflamatorie indusă de IR și apoptoza
Suplimentul KA ar putea atenua inflamația și apoptoza induse de IR prin inhibarea activării căilor NF-κB și MAPK
Căile NF-κB și MAPK sunt două căi clasice de semnalizare care participă la inflamație și apoptoză [20,21,22,23,24]. În grupul IR + Nacl, expresia fosforilat-p65 a crescut, precum și cea a moleculei sale din aval NFATc-1, arătând că IR a promovat activarea căii NF-κB. Odată cu tratamentul KA, activarea fosforilată-p65 a fost parțial inhibată, iar expresia NFATc-1 a fost redusă (Fig. 5a). În același timp, am măsurat moleculele legate de calea MAPK și am observat o creștere similară a ERK fosforilat și a p38 în grupul IR + Nacl. În grupul IR + KA, activarea a fost inhibată cu o scădere de 50% în p-p38 și 80% în p-ERK comparativ cu grupul IR + Nacl (Fig. 5b). Rezultatele noastre sugerează că suplimentul KA ameliorează inflamația renală și apoptoza printr-o activare inhibată a căilor NF-κB și MAPK.
Caracteristicile demografice de bază ale pacienților clinici cu CKD în diferite stadii și diferența în starea funcției renale între persoanele cu și fără intervenție KA
Diagrama fluxului pacienților pe tot parcursul studiului
Efectele KA asupra probabilității de supraviețuire renală la pacienții cu BCR în diferite stadii
Am împărțit pacienții înrolați în stadiile de la CKD de la 3 la 5 în grupuri KA și No-KA în funcție de medicamentele lor. Un eveniment final a fost definit ca o reducere> 50% a eGFR inițială. Într-o analiză Kaplan-Meier, probabilitatea cumulată de a atinge punctul final a fost mai mică în grupul KA decât grupul No-KA (p = 0,0241) la pacienții din stadiile 4 și 5. Pentru pacienții din stadiile 3-5, KA a prezentat, de asemenea, un efect protector asupra funcției renale înainte de 30 de luni; după 30 de luni de tratament, pacienții din grupul KA au prezentat o deteriorare a stării renale. Luând în considerare doar pacienții din stadiul 3, incidența evenimentelor endocrine ale CKD în grupul KA a fost mai mică decât grupul No-KA. Cu toate acestea, incidența totală a evenimentelor finale (n = 0,035, 7 evenimente finale la 201 pacienți) a fost mai mică decât în stadiile 4 și 5 (n = 0,107, 13 din 122) (Fig. 7). După ajustarea pentru factorii demografici de bază (inclusiv sexul, vârsta, complicațiile, educația, ocupația, fumatul și istoricul consumului de alcool), persoanele din grupul KA au prezentat o incidență mult mai întârziată și mai lentă a scăderii eGFR comparativ cu grupul fără KA raport, 0,115; IC 95% 0,021 până la 0,639; p = 0,0134 (Tabelul 4)] la pacienții din stadiile 4 și 5, prezentând un efect pozitiv al KA asupra progresiei CKD.
Efectul KA asupra probabilității de supraviețuire renală la pacienții cu BCR în diferite stadii. Probabilitatea de a atinge punctul final a fost mai mică în grupul KA decât grupul fără KA în etapele CKD 4 și 5 atunci când a fost ajustat într-un test de rang log (p = 0,0241). Pentru pacienții din stadiul 3-5, KA a prezentat, de asemenea, un efect protector asupra funcției renale înainte de 30 de luni, după 30 de luni, pacienții din grupul KA au prezentat o situație renală deteriorată. Pentru pacienții din stadiul 3, incidența punctului final (n = 0,035, 7/201) în grupul KA a fost mai mică decât grupul fără KA, cu toate acestea, incidența generală a punctului final a fost destul de mică decât în stadiul 4 și 5. (n = 0,107, 13/12)
Discuţie
Concluzii
Am demonstrat dovezi experimentale care indică faptul că KA a jucat un rol protector în leziunile renale induse de IR și fibroza, printr-o inhibare a căii NF-κB și MAPK pentru a atenua inflamația și apoptoza. Între timp, am observat efectul terapeutic al KA asupra staving progresia CKD în cadrul clinic, în principal la pacienții în stadiul final. Studiul nostru a oferit sprijin teoretic pentru tratamentul KA în ameliorarea progresiei leziunii renale ischemice în CKD.
- Suplimentele antioxidante dietetice și acidul uric în bolile renale cronice O revizuire
- Efectul expunerii la solvent organic asupra progresiei bolii cronice renale Cohorta GN-PROGRESS
- Consumul de fosfat dietetic la australieni cu stadiile 3b și 4 de boală cronică a rinichilor -
- Managementul alimentar al hiperfosfatemiei în bolile renale cronice - ScienceDirect
- Alimente cu niveluri mai mici de creatinină din ser mai scăzut de fibre la pacienții cu boli renale cronice -