Departamentul de Științe Nutriționale, Universitatea Purdue, West Lafayette, Indiana, SUA
Secția de medicină comparată, Școala de medicină Yale, New Haven, Connecticut, SUA
Departamentul de Imunobiologie, Școala de Medicină Yale, New Haven, Connecticut, SUA
Departamentul de Științe Nutritive, Universitatea Purdue, West Lafayette, Indiana, SUA
Secția de medicină comparată, Școala de medicină Yale, New Haven, Connecticut, SUA
Departamentul de Imunobiologie, Școala de Medicină Yale, New Haven, Connecticut, SUA
Agenții de finanțare: Cercetarea în laboratorul Dixit este susținută parțial de National Institutes of Health (AG043608, AG31797, DK090556 și AI105097). Ryan Grant este susținut de Universitatea Purdue.
Dezvăluire: Autorii nu au declarat niciun conflict de interese.
Contribuțiile autorului: Ambii autori au contribuit la concepția, scrierea și editarea manuscrisului.
Abstract
Obiectiv
Această revizuire se va concentra pe aspectele imunologice ale țesutului adipos și rolul său potențial în dezvoltarea inflamației cronice care instigă la comorbidități asociate obezității.
Metode
Revizuirea a folosit căutările PubMed din literatura actuală pentru a examina leucocitoza țesutului adipos.
Rezultate și concluzii
Țesutul adipos al subiecților obezi se inflamează și contribuie la dezvoltarea rezistenței la insulină, a diabetului de tip 2 și a sindromului metabolic. Numeroase celule imune, inclusiv celule B, celule T, macrofage și neutrofile, au fost identificate în țesutul adipos, iar obezitatea influențează atât cantitatea, cât și natura subtipurilor de celule imune, care apare ca un organ imunologic activ capabil să modifice metabolismul întregului corp prin paracrine și mecanisme endocrine. Țesutul adipos este un organ activ imunologic mare în timpul obezității și prezintă semnele distinctive ale răspunsului imun înnăscut și adaptativ. În ciuda prezenței celulelor descendente hematopoietice în țesutul adipos, nu este clar dacă compartimentul adipos are un rol direct în supravegherea imunitară sau în apărarea gazdei. Înțelegerea interacțiunilor dintre leucocite și adipocite poate dezvălui căile relevante clinic care controlează inflamația țesutului adipos și este probabil să dezvăluie mecanisme prin care obezitatea contribuie la o susceptibilitate crescută atât la boli metabolice, cât și la anumite boli infecțioase.
Introducere
Incidența în creștere a excesului de greutate și a obezității a contribuit la accelerarea ratelor diabetului de tip 2 și a sindromului metabolic, care au implicații mari pentru sănătatea globală. Dovezile epidemiologice indică faptul că obezitatea reprezintă aproximativ 18% din totalul deceselor la persoanele cu vârsta cuprinsă între 40 și 85 de ani în Statele Unite (1). Astfel, este necesară dezvoltarea unor tratamente sigure și eficiente pentru obezitate și comorbiditățile acesteia, în special diabetul de tip 2. Recunoașterea faptului că inflamația cronică de nivel scăzut contribuie la comorbiditățile asociate obezității și că țesutul adipos este un organ activ imunologic major care contribuie la această inflamație este în creștere.
Inflamație și obezitate metabolică sănătoasă și nesănătoasă
Deși indivizii obezi sănătoși din punct de vedere metabolic par a fi protejați de boala asociată cu obezitatea, este de la sine înțeles că dezvoltarea inflamației și a rezistenței la insulină în timpul obezității ar putea fi un mecanism adaptativ pentru controlul disfuncției organelor asociate cu stocarea excesului de energie. De exemplu, în ultimele două decenii există dovezi puternice din studiile efectuate pe indienii Pima și alte populații că ratele mai mici de glucoză: oxidarea lipidelor sau un coeficient respirator scăzut este asociat cu o rată redusă de creștere în greutate (8-10). Din aceste studii timpurii, s-a emis ipoteza că o rată scăzută de oxidare a glucozei duce la o reducere concomitentă a eliminării glucozei, iar rezistența la insulină ar putea fi o adaptare biologică la creșterea mai mică în greutate prin stocarea redusă a energiei în țesutul adipos.
Leucocitoza țesutului adipos
Înțelegerea leucocitozei țesutului adipos a început cu identificarea macrofagelor din țesutul adipos. Descoperiri seminale de Weisberg și colab. și Xu și colab. a demonstrat că macrofagele sunt crescute în țesutul adipos în timpul obezității și că macrofagele sunt sursa primară de TNF (13, 14). Pe lângă macrofage, au fost identificate și alte celule imune, inclusiv: celule B (15), celule T (16), neutrofile (17, 18), eozinofile (19) și mastocite (20, 21). Compoziția celulară a țesutului adipos este plastică și este reglementată atât de stimuli acuti, cât și de stimuli cronici, inclusiv dieta (13, 14, 18), starea greutății corporale (13, 14), expunerea la frig (22) și hrănirea și postul (23). Evoluția exactă a evenimentelor care au condus la modificări ale compoziției celulare a țesutului adipos ca răspuns la o dietă bogată în grăsimi nu este încă definită. Cu toate acestea, se știe că neutrofilele sunt recrutate în țesutul adipos în decurs de 3 zile, macrofagele în decurs de 2 săptămâni, iar celulele B și celulele T sunt crescute în 4 săptămâni de dietă bogată în grăsimi la șoareci (15, 18) .
Numărul total al fiecărui tip de celulă este important, dar există și modificări ale calității acestor populații de celule. Obezitatea și rezistența la insulină au capacitatea de a distorsiona celulele imune de la subtipurile antiinflamatorii către subtipuri mai proinflamatorii. Aceasta include o comutare a polarizării macrofagelor de la celule asemănătoare M2 la celule M1 mai proinflamatorii (24) și pierderea celulelor T reglatoare în țesutul adipos (25). Efectele locale ale acestor modificări compoziționale în timpul obezității determină inflamația țesutului adipos și influențează capacitatea adipocitelor de a stoca lipidele, sensibilitatea la insulină adipocitară, metabolismul sistemic al glucozei și homeostazia metabolică. Factorii care stau la baza și tipurile de celule care determină inflamația țesutului adipos este un domeniu de cercetare foarte activ, totuși există încă mulți factori necunoscuți în etiologia bolii mediate de obezitate.
Stresul adipocitar și tiparele moleculare asociate pericolului
Ca răspuns la excesul de energie, adipocitele suferă hipertrofie și/sau hiperplazie. Mărimea adipocitelor este corelată cu sensibilitatea la insulină la om, iar cei cu adipocite mai mici au markeri mai mici de inflamație (26, 27); cu toate acestea, modelele de rozătoare indică faptul că, în absența anumitor proteine, adipocitele pot fi mari în timp ce animalul menține sensibilitatea la insulină (28). Analiza histologică a țesutului adipos relevă prezența unor structuri asemănătoare coroanei, care constau din celule imune care înconjoară adipocite moarte care colorează perilipina negativă în jurul picăturilor lipidice (29). Apariția structurilor asemănătoare coroanei și moartea adipocitelor urmează un curs de timp în care există o incidență crescândă de la debutul hrănirii cu conținut ridicat de grăsimi până în săptămâna 16. Până în săptămâna 20, structurile asemănătoare coroanei sunt scăzute comparativ cu săptămâna 16, deși comparativ cu la animale slabe de control, numărul este încă ridicat, iar șoarecii rămân rezistenți la insulină, deși într-un grad mai mic decât la vârful incidenței structurii asemănătoare coroanei (29). Acest lucru indică faptul că remodelarea țesutului adipos este un răspuns adaptiv, dar nu poate compensa pe deplin excesul de nutrienți și, în cele din urmă, limitează depozitarea lipidelor, ducând la disfuncție tisulară.
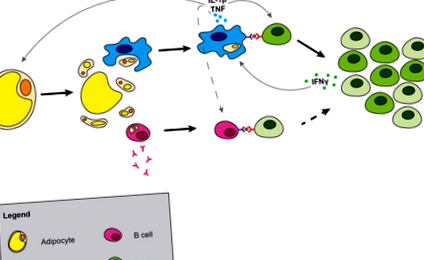
Nu este clar modul exact în care mor adipocitele; cu toate acestea, studii recente indică faptul că moartea adipocitelor poate avea loc prin piroptoză (30). Piroptoza este o formă specializată de moarte celulară dependentă de caspază - 1 care implică scurgerea constituenților citosolici în spațiul extracelular. Scurgerea constituenților citosolici și expunerea picăturii lipidice în țesut determină eliberarea tiparelor moleculare asociate pericolului (DAMP) care pot fi sesizate de receptorii de recunoaștere a tiparului (Figura 1). DAMP-urile metabolice includ acizi grași liberi (31), concentrații mari de glucoză (32), ATP (33), ceramide (34) și alte sfingolipide și colesterol (35, 36) și cristale de urat. Recent, s-a demonstrat că adipocitele sintetizează acidul uric, iar producția de acid uric din țesutul adipos crește în timpul obezității (37). Aceste DAMP metabolice sunt capabile să provoace activarea macrofagelor și să inițieze inflamația țesutului adipos.
Generarea inflamației în țesutul adipos. Moartea adipocitelor eliberează constituenți citosolici și expune picătura lipidică. Macrofagele înghit sau sunt activate de constituenții adipocitelor, ducând la producerea de macrofage de citokine. Celulele B sunt, de asemenea, activate, ducând la producerea de anticorpi și interacțiunea celulelor T dependente de MHCII, care pot contribui la rezistența la insulină. IL-1β secretat de macrofage și prezentarea antigenului determină expansiunea clonală a celulelor T și deplasează echilibrul celulelor T din țesutul adipos de la celulele de memorie naive la celele efector. Liniile întrerupte indică posibile interacțiuni între celule.
Detectarea macrofagelor DAMP ale țesutului adipos și prezentarea antigenului
DAMP-urile metabolice și modelele moleculare asociate cu agenții patogeni (PAMP) sunt detectate de celulele imune înnăscute și duc la activarea căilor inflamatorii prin receptori de recunoaștere a modelelor, cum ar fi domeniul oligomerizării cu taxă și legarea nucleotidelor care conține familii de receptori asemănători proteinelor (TLR și NLR ).). Analiza distribuției acestor receptori, precum și a markerilor macrofagici a fost dificilă datorită dispersiei enzimatice a țesutului adipos. Dispersia enzimatică a țesutului adipos separă țesutul adipos într-o fracțiune adipocitară plutitoare și o peletă vasculară stromală; cu toate acestea, este limitată datorită asocierilor strânse dintre adipocite și macrofage și prezenței macrofagelor plutitoare libere în fracțiunea adipocitelor (38) .
Toți membrii familiei TLR (TLR 1-9) sunt exprimați în țesut adipos în grade variate în cadrul fracțiunilor vasculare stromale și adipocite (39). În ceea ce privește inflamația țesutului adipos, TLR4 a primit cea mai mare atenție. Interacțiunea TLR4 și a acizilor grași a fost legată de proteina fetuină A (40). Fetuina A a fost identificată ca fiind un ligand endogen al TLR4 și este produsă în cantități mari de țesut adipos (40). În sistemele de cocultură, fetuina A este eliberată de adipocite după expunerea la acizi grași liberi și este capabilă să polarizeze macrofagele de la un fenotip asemănător M2 la un fenotip asemănător M1, similar cu schimbarea care are loc în țesutul adipos în timpul dezvoltării obezității ( 40). În plus față de activitățile sale de polarizare, fetuina A servește și ca chimioactiv pentru macrofage, ducând la creșterea traficului către țesut (40). Ablația TLR4 reduce inflamația țesutului adipos, dar efectele sale asupra sensibilității la insulină la nivelul întregului corp nu au fost consistente în toate studiile, unele arătând sensibilitate crescută la insulină (41, 42), în timp ce altele nu prezintă nicio modificare (42) .
Subseturi de celule T, expansiune și contracție a populațiilor
Contribuția celulelor B la inflamația țesutului adipos și la rezistența la insulină
Structuri imunologice ale țesuturilor adipoase
Țesutul adipos nu este uniform în distribuția sa și are o regionalitate bazată pe structuri imune, inclusiv structuri asemănătoare coroanei, clustere limfoide asociate grăsimilor (FALC) și pete lăptoase, dar și pe apariția adipocitelor brite/bej. Cu toate acestea, influența regionalității țesutului adipos asupra funcției adipoase nu este bine înțeleasă. Unele depozite de țesut adipos, inclusiv depozitul inghinal la rozătoare și multe depozite mici la om și alte mamifere, conțin ganglioni limfatici (67). Studiile inițiale pe depozitele de țesut adipos de cobai au demonstrat că explantele de țesut adipos localizate în apropierea ganglionilor limfatici în comparație cu țesutul adipos care nu este adiacent ganglionilor limfatici au avut o capacitate sporită de a suprima proliferarea stimulată de mitogen a unui preparat mixt de leucocite a ganglionilor limfatici (67). Interesant este că efectele asupra proliferării au fost inversate prin tratamentul cu insulină. Aceste descoperiri indică faptul că produsele secretate ale țesutului adipos lângă ganglionii limfatici au capacitate imunosupresivă, dar mecanismul din spatele acestui lucru nu este cunoscut. Aceste studii au folosit explanți de țesut adipos intact, deci nu este clar dacă produsele secretate ale adipocitelor sau celulelor imune au avut efecte biologice.
Inflamația asociată cu obezitatea și răspunsul la agenți patogeni
Obezitatea este asociată cu numeroase boli, inclusiv: diabet de tip 2, gută, artrită, ateroscleroză, boli hepatice și susceptibilitate crescută la anumiți agenți patogeni. Atât modificările metabolice, cât și cele inflamatorii ale țesutului adipos determină patologia asociată cu obezitatea. TNF, IL-1β și IL-6 au capacitatea de a afecta acțiunea insulinei și absorbția glucozei în țesutul periferic. Deși creșterea concentrațiilor sistemice de IL-6 este frecvent observată, modificările sistemice de IL-1β și TNF sunt mai dificil de detectat din cauza cantităților reduse de circulare ale acestor citokine. La nivel local, aceste citokine din țesutul adipos au capacitatea de a modula lipoliza și diferențierea adipocitelor. Astfel, aceste citokine au capacitatea de a limita depozitarea grăsimilor în țesutul adipos și de a redistribui această grăsime către alte țesuturi care produc grăsimi ectopice.
Concluzie
Mulțumiri
Autorii îi mulțumesc lui Ann Liu pentru asistență la proiectarea și crearea figurilor.
- Bladderwrack; Kelp - Fitofarmacie - Biblioteca online Wiley
- Calcitriol și metabolismul energetic - Zemel - 2008 - Recenzii nutriționale - Biblioteca online Wiley
- Inflamația țesutului adipos contribuie la pierderea în greutate corporală indusă de alimentele cronice experimentale
- 100 de prelegeri și 8 ore de fitness - Plan de pierdere în greutate - Educație în bibliotecă online - EllEdu
- Distribuția țesutului adipos prezice supraviețuirea în scleroza laterală amiotrofică