Abstract
fundal
Tamponul de grăsime infrapatelar (IFP) al articulației genunchiului a primit multă atenție recent datorită rolului său emergent în patogeneza osteoartritei (OA), unde prezintă un fenotip inflamator. Scopul prezentului studiu a fost de a examina compoziția de acid gras infrapatellar (FA) la un iepureOryctolagus cuniculus) modelul OA timpuriu creat prin tranziția ligamentului încrucișat anterior (ACLT).
Metode
OA a fost indusă în mod aleatoriu în articulația genunchiului stâng sau drept a iepurilor albi din Noua Zeelandă maturi din punct de vedere scheletic prin ACLT, în timp ce genunchiul contralateral a fost lăsat intact. Un grup separat de iepuri neoperiți a servit drept controale. IFP al genunchilor ACLT, contralateral și martor au fost recoltați după eutanasie la 2 sau 8 săptămâni după ACLT și compoziția lor FA a fost determinată prin cromatografie gazoasă - spectrometrie de masă.
Rezultate
Raportul FA polinesaturat n-3/n-6 (PUFA) s-a deplasat într-o direcție pro-inflamatorie după ACLT, observat deja la 2 săptămâni după operație (0,20 ± 0,008 față de 0,18 ± 0,009). La 8 săptămâni, profilul FA al grupului ACLT a fost caracterizat prin procente crescute de 20: 4n-6 (0,44 ± 0,064 vs. 0,98 ± 0,339 mol-%) și 22: 6n-3 (0,03 ± 0,014 vs. 0,07 ± 0,015 ). mol-%) și cu sume FA monoinsaturate (MUFA) scăzute (37,19 ± 1,586 față de 33,20 ± 1,068 mol-%) și rapoartele n-3/n-6 PUFA (0,20 ± 0,008 vs. 0,17 ± 0,008). Semnătura FA a genunchilor contralaterali seamănă cu cea a controalelor neoperate în cele mai multe aspecte, dar a avut proporții crescute din totalul n-3 PUFA și sume reduse MUFA.
Concluzii
Aceste descoperiri furnizează informații noi despre efectele OA timpurii asupra profilului FA infrapatelar în modelul ACLT de iepure. Reducerea raportului PUFA n-3/n-6 al IFP este în concordanță cu inflamația și degradarea cartilajului în OA timpurie și ar putea contribui la patogeneza bolii.
fundal
Osteoartrita (OA) este o boală degenerativă a articulațiilor și o cauză majoră de durere și dizabilitate la vârstnici [1]. Se caracterizează prin degradarea progresivă a cartilajului articular, remodelarea osului subcondral și sinovita. Principalii factori de risc pentru dezvoltarea OA sunt vârsta, sexul feminin, obezitatea, leziunile articulare traumatice și încărcarea articulației ocupaționale [2]. S-a presupus că obezitatea este un factor predispozant pentru OA datorită supraîncărcării mecanice, dar țesutul adipos și infiltrarea celulelor imune pot contribui, de asemenea, la patogeneza OA, producând adipokine și citokine [3, 4]. În general, obezitatea se caracterizează printr-o stare inflamatorie sistemică și un profil de acid gras polinesaturat (PUFA) dezechilibrat în organism [5, 6]. Mai mult, o creștere a raportului n-6/n-3 PUFA în plasmă este legată de durerea crescută a genunchiului și funcția redusă [7], ceea ce sugerează implicații potențiale în OA. Pe de altă parte, tranziția ligamentului încrucișat anterior (ACL) (ACLT) este un model chirurgical bine stabilit al OA [8]. Leziunea ACL poate duce la producerea de mediatori inflamatori datorită încărcării anormale, traumatice a cartilajului, contribuind la progresia OA [9].
Tamponul de grăsime al lui Hoffa, sau tamponul de grăsime infrapatelar (IFP), a apărut recent ca o sursă de inflamație în OA a genunchiului [4]. Este o structură de țesut adipos intracapsular, dar extrasinovial al articulației genunchiului, unde 98% din grăsime constă din lipide neutre (în principal triacilgliceroli, TAG) și 1% din fosfolipide (PL) [10]. IFP se credea anterior a fi în principal țesut adipos structural necesar unei funcții adecvate a genunchiului, dar datele recente indică faptul că este un loc activ din punct de vedere metabolic al articulației care poate afecta integritatea țesuturilor învecinate [4]. IFP poate interacționa cu sinoviocitele și cartilajul și poate induce atât activități de protecție, cât și activități agravante ale bolii în OA. Ca organ endocrin, secretă adipokine, citokine, acizi grași (FA) și mediatori de lipide derivate din PUFA (LM). IFP al pacienților cu OA are un fenotip inflamator caracterizat prin secreția de adipokine și citokine și compoziția celulelor imune [3].
Deoarece FA prezintă proprietăți imunomodulatoare, s-a emis ipoteza că profilurile lor în circulație și lichidul sinovial pot fi modificate în OA, contribuind astfel la progresia bolii [11]. N-3 și n-6 PUFA sunt actori importanți în multe stări de boală, deoarece sunt convertiți în diferite serii de eicosanoizi de ciclooxigenaze (COX), lipoxigenaze și monooxigenaze ale citocromului P450 [12]. N-6 PUFA sunt precursori ai LM pro-inflamatorii, în timp ce n-3 PUFA produc mai puține LM inflamatorii sau rezolvante. N-3 PUFA înlocuiește parțial 20: 4n-6 din membrana PL și concurează cu n-6 PUFA pentru desaturaze, elongaze și COX [13]. Creșterea cantității de PUFA n-3 din dietă poate muta echilibrul eicosanoidelor produse într-o direcție mai benefică [5]. N-3 PUFA poate, de asemenea, să suprime inflamația prin reglarea expresiei genelor prin interacțiuni cu receptorii nucleari și factori de transcripție. Uleiurile de pește care conțin PUFA n-3 cu lanț lung pot fi considerate nutraceutice cu efecte potențial benefice asupra profilelor lipidice circulante [14].
Metode
Toate procedurile experimentale au fost aprobate de Comitetul pentru îngrijirea animalelor de la Universitatea din Calgary (# AC11–0035) și efectuate în conformitate cu liniile directoare ale Consiliului canadian pentru îngrijirea animalelor. Iepuri albi din Noua Zeelandă maturi scheletic (tulpina 052 CR, n = 22 femele, 12 luni, 4,8 ± 0,08 kg) au fost obținute de la Charles River Laboratories Inc. (Saint-Constant, QC, Canada). Iepurii au fost transportați la Universitatea din Calgary, unde au fost adăpostiți în cuști individuale (76 × 64 × 41 cm) la 12 L: 12D și ± 23 ° C timp de 4 săptămâni înainte de experiment. Iepurii au avut acces gratuit la apă și o dietă de întreținere peletată (5326 * Laboratory Rabbit Diet HF, LabDiet, St. Louis, MO, SUA; http://www.labsupplytx.com/wp-content/uploads/2013/07/ 5326-Laboratory-Rabbit-Diet-HF.pdf).
După 2 sau 8 săptămâni, animalele au fost anesteziate cu izofluran, așa cum s-a descris mai sus, ulterior eutanasiate cu o injecție intracardică de sodiu pentobarbital (200 mg/kg; Eutanil, Bimeda-MTC Animal Health Inc., Cambridge, ON) și prelevate la 07.00–12.00 Genunchii au fost disecați la 2-3 cm deasupra și sub articulația genunchiului, iar mușchii au fost îndepărtați permițând vizualizarea clară a tuturor ligamentelor. IFP a fost disecat cu foarfece în spatele ligamentului rotulian, plasat într-un tub de probă de 1,5 ml, congelat rapid în azot lichid și depozitat la -80 ° C. Numărul probelor de control, ACLT și contralaterale au fost 6, 8 și 8 la 2 săptămâni și respectiv 8, 7 și 7 la 8 săptămâni după ACLT. Probele au fost transportate pe gheață uscată în Finlanda pentru prelucrare ulterioară. Aceleași animale experimentale au fost raportate anterior pentru a prezenta semne de OA timpurie [22].
Pentru analizele FA, submostele IFP au fost transmetilate în H2SO4 metanolic sub atmosferă de azot [23] și esterii metilici FA formați (FAME) au fost extrasați cu hexan și analizați printr-un cromatograf de gaz Shimadzu GC-2010 Plus (Shimadzu, Kyoto, Japonia ) echipat cu un autoinjector, un detector de ionizare a flăcării (FID) și coloane capilare de ceară ZB (Phenomenex, Torrance, CA, SUA). Identitățile structurilor FAME au fost confirmate prin utilizarea spectrelor de masă cu impact de electroni înregistrate de un Shimadzu GCMS-QP2010 Ultra cu un detector selectiv de masă. Vârfurile cromatografice rezultate din FID au fost integrate manual cu software-ul GCsolution (v2.41.00) de Shimadzu. Rezultatele sunt reprezentate ca compoziția FA (mol-%) a lipidelor totale IFP. Raporturile produs/precursor ale n-3 și n-6 PUFA au fost calculate după cum urmează: (20: 5n-3 + 22: 6n-3)/18: 3n-3 și 20: 4n-6/18: 2n -6.
Comparațiile statistice ale profilurilor FA între grupurile de studiu au fost efectuate folosind un model liniar generalizat (IBM SPSS vSoftware 21.0, IBM, Armonk, NY, SUA). Modelul a fost realizat cu distribuția normală a probabilității reziduurilor. Parametrul examinat a fost selectat ca variabilă dependentă, grupul experimental ca factor de model și timpul ca o covariabilă. Modelul a inclus atât efectul principal, cât și timpul experimental, precum și interacțiunea timp × grup. Modificările masei corporale au fost testate folosind probe asociate t-teste. p valoare
Rezultate
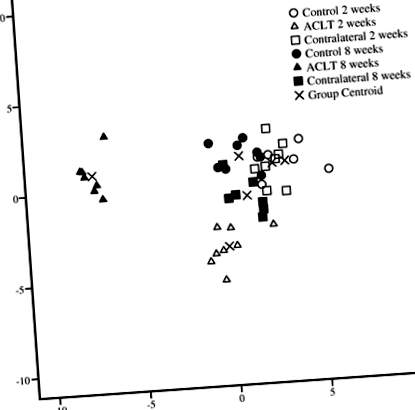
În analiza discriminantă, grupurile ACLT de 2 și 8 săptămâni au fost clasificate separat unul de celălalt și separat de genunchii lor de control și contralaterali corespunzători, aceștia din urmă fiind grupați toți pe baza compoziției IFP FA (Fig. 1) . FA primară care separă grupurile a inclus 16: 1n-9, 22: 6n-3, 22: 5n-3, 20: 4n-6, 20: 3n-6 și 20: 5n-3 (pentru funcția 1) și 18: 2n-6 (pentru funcția 2). Analiza a clasificat 100% din probe corect pe baza grupului de studiu.
Analiză discriminantă care descrie clasificarea semnăturilor acizilor grași ai tamponului de grăsime infrapatelar de iepure în diferite grupuri de studiu pe baza funcțiilor discriminante 1 și 2. Transecția ligamentului încrucișat anterior ACLT
În ceea ce privește FA individuală la 2 săptămâni după ACLT, IFP din grupul ACLT a avut proporții mai mari de 16: 1n-9, C20-22 FA saturată (SFA) și 24: 1n-9, procentaje mai mici de 17: 1n-8, și raporturi PUFA n-3/n-6 mai mici decât controalele (Fig. 2 și 3; Fișier suplimentar 1: Tabel S1). Profilele FA în genunchii contralaterali au fost similare cu cele obținute pentru genunchii grupului de control, dar au diferit de grupul ACLT după cum urmează: proporțiile de 17: 1n-8 și raporturile PUFA n-3/n-6 au fost mai mici în ACLT grupul și procentele de 18: 3n-6, C20-24 SFA, 20: 1n-9, 22: 1n-7, 22: 4n-6 și 24: 1n-9 au fost mai mari.
Modificările relative (%) în proporțiile acizilor grași selectați (FA) în tamponul de grăsime infrapatelar al iepurilor la 2 și 8 săptămâni după tranziția ligamentului încrucișat anterior (ACLT) comparativ cu martorii în aceleași momente de timp. Valorile negative indică faptul că un FA a scăzut proporțional din cauza ACLT, iar valorile pozitive indică creșterea acestuia, valorile calculate ca (mol-% mediu în ACLT - mol-% mediu în control)/mol-% mediu în Control
După 8 săptămâni, IFP al grupului ACLT a avut proporții mai mari de 15: 0, 16: 1n-9, 17: 0eu, 17: 0ai, 18: 3n-6, C20-24 SFA, 20: 4n-6, 20: 4n-3, 22: 1n-9, 22: 4n-6, 22: 5n-3, 22: 6n-3 și 24: 1n-9 decât controalele și procentaje mai mici de FA monoinsaturate totale (MUFA) și raporturi PUFA mai mici n-3/n-6 (Fig. 2 și 3; Fișier suplimentar 1: Tabel S1). Procentele au fost mai mari pentru 18: 3n-3 și total n-3 PUFA și mai mici pentru 17: 1n-8, 20: 1n-7 și total MUFA în genunchii contralaterali decât în controale. Genunchii ACLT au prezentat proporții mai mari de 15: 0, 16: 1n-9, 17: 0eu, 17: 0ai, C20–24 SFA, 20: 1n-9, 20: 4n-6, 20: 4n-3, 22: 4n-6, 22: 5n-3, 22: 6n-3 și majoritatea C22–24 MUFA și n mai mare -3 și n-6 PUFA raporturi produs/precursor comparativ cu grupul contralateral, în timp ce procentele de 18: 3n-3 și total n-3 PUFA, precum și raporturile de n-3/n-6 PUFA au fost mai mici.
Comparând animalele de 2 săptămâni și cele de 8 săptămâni, a existat o creștere a proporțiilor IFP de 16: 1n-9, 18: 1n-9, 19: 1n-8, 20: 0, 20: 4n-3, 24: 0, 22: 6n-3 și rapoartele produs/precursor pentru n-3 PUFA și o reducere pentru 18: 2n-6, 18: 3n-3, n-6 PUFA, n-3 PUFA și PUFA total de la 2 săptămâni până la 8 săptămâni, în special în ceea ce privește grupurile ACLT (Fig. 2; Fișier suplimentar 1: Tabelul S1). Interacțiune semnificativă între timp și grup a fost observată pentru 16: 1n-9, 17: 0eu, 17: 1n-8 și 24: 0 (Fișier suplimentar 1: Tabel S1).
Iepurii operați au avut un echilibru energetic ușor negativ și au pierdut 8,7 ± 1,30% din masa corporală la 2 săptămâni după operație și 8,0 ± 2,71% la 8 săptămâni comparativ cu masa corporală inițială (împerecheați) t-Test, p
Discuţie
Efectele OA în stadiu incipient asupra compoziției FA a IFP au fost examinate în modelul ACLT de iepure, la 2 și 8 săptămâni după intervenția chirurgicală. Principalele constatări ale acestui studiu au fost că eu) ACLT a modificat raportul PUFA n-3/n-6 infrapatelar către un fenotip proinflamator, ii) profilul FA al IFP a fost modificat încă din 2 săptămâni după ACLT, iii) modificările induse de ACLT în proporțiile anumitor FA au devenit mai pronunțate la 8 săptămâni și iv) semnătura FA a genunchiului contralateral seamănă cu cea a controlului neoperat în majoritatea aspectelor, dar cu unele excepții demne de remarcat.
Reducerea observată a raportului n-3/n-6 PUFA al IFP poate contribui la inflamație și degradarea cartilajului în OA timpurie. De asemenea, este în concordanță cu datele noastre care arată o expresie mARN crescută a factorilor inflamatori și de degradare a cartilajului interleukina IL-6, metaloproteinaza matricială MMP-3 și MMP-13 în cartilajul articular al iepurilor tratați în mod similar la 2 săptămâni după ACLT [24]. ]. Ca organ extrasinovial, IFP nu interacționează direct cu cartilajul, dar s-a propus a fi o sursă de adipokine, citokine, FA și LM care ar putea contribui la procesele fiziopatologice din OA [3, 15]. Alte probleme de sănătate asociate cu OA includ obezitatea și inflamația sistemică de grad scăzut [2, 25]. Obezitatea este, de asemenea, legată de modificarea dietei și, în consecință, a echilibrului PUFA n-3/n-6 al corpului care are implicații potențiale în OA [6, 7]. Raportul n-3/n-6 PUFA este important, deoarece n-6 PUFA crește nivelul proteinelor COX-2 și producția de PGE2 în condrocite [11, 26]. Proporția crescută de 20: 4n-6 în IFP a grupului ACLT este în concordanță cu constatările anterioare ale lui Gierman și colab., Care au observat că secreția de 20: 4n-6 a fost mai mare din IFP a pacienților cu OA comparativ cu post -donatori mortem fără OA [15].
În schimb, PUFA n-3 sunt metabolizate în LM mai puțin inflamatorii sau pro-rezolvante [12, 27] și au efecte anti-distructive asupra cartilajului [16, 17]. În condrocite, n-3 PUFA, cu 20: 5n-3 fiind cel mai eficient, reduc expresia COX-2, IL-1α și IL-1β, factor de necroză tumorală-α, aggrecanaze ADAMTS4-5, MMP-3 și MMP-13 [16]. În plus, n-3 PUFA poate participa la remodelarea osoasă favorizând osteoblastogeneza [28]. Procentul crescut de 22: 6n-3 în genunchii ACLT ai iepurilor este similar cu descoperirile anterioare de la pacienții cu OA [15]. Deoarece s-a demonstrat că IFP induce atât activități de protecție, cât și activități agravante ale bolii în OA [4], LM pro-rezolvant, cum ar fi rezolvine, protectine și maresine, derivat din 22: 6n-3 ar putea contribui potențial la căile de rezoluție care sunt activate în OA [27, 29]. Pe lângă sănătatea articulațiilor, PUFA n-3 cu lanț lung poate avea efecte benefice asupra dislipidemiei și a sistemului cardiovascular [14].
Profilul FA al IFP a fost deja modificat la 2 săptămâni după ACLT. FA afectate au fost în general de proporții minore, iar cea mai interesantă modificare a fost reducerea raportului n-3/n-6 PUFA. Conform descoperirilor anterioare din modelul de iepure, primele semne ale OA au fost de obicei documentate la 4 săptămâni după ACLT [21, 30,31,32]. Acestea includ conținut redus de proteoglican (PG), fibrilație și rigiditate biomecanică redusă [20, 33]. Densitatea minerală osoasă s-a dovedit a fi scăzută și fluxul sanguin a crescut în osul periarticular la 2 săptămâni după ACLT [34]. Ojanen și colab. a raportat o pierdere a densității de sarcină fixă din cartilajul articular la 2 săptămâni după ACLT [22]. Se știe că semnătura FA în țesutul adipos/plasmă se schimbă rapid ca răspuns la diferiți stimuli, de exemplu, postul și modificările dietetice [35, 36]. În acest context, profilurile FA modificate după 2 săptămâni de intervenție erau de așteptat și ar putea reprezenta răspunsuri timpurii la inflamație și leziuni tisulare. Acest lucru ar putea fi, de asemenea, conectat la densitatea de încărcare fixă redusă a PG raportată anterior [22].
Proporția totală a MUFA a fost, de asemenea, redusă la genunchii ACLT la 8 săptămâni după ACLT. Posibilul rol al MUFA în OA nu este clar, dar 18: 1n-9 a exercitat efecte anti-distructive și antiinflamatorii asupra condrocitelor și cartilajelor in vitro [11]. Descoperirile prezente sunt în concordanță cu această noțiune, deoarece proporția MUFA totală a fost redusă după ACLT, chiar dacă tendința de scădere în 18: 1n-9, cel mai abundent MUFA individual, nu a atins semnificația. Anterior, 18: 1n-9 a fost identificat ca un metabolit critic pentru discriminarea între OA în stadiu incipient și tardiv, cu niveluri crescute de lichid sinovial în timpul progresiei bolii [18]. În ceea ce privește SFA, 16: 0 a fost documentat pentru a inhiba distrugerea cartilajului in vitro [11], dar studiul de față nu a găsit niciun efect al ACLT asupra proporțiilor SFA majore.
Progresia OA în modelul ACLT de iepure este rapidă [8]. Etapele timpurii ale OA secundar se pot dezvolta în câteva săptămâni și, prin urmare, modelul selectat a servit bine pentru a aborda obiectivele acestui studiu. Speciile mai mici, cum ar fi șobolanii și șoarecii, au suprafețe ale articulațiilor genunchiului care sunt prea mici pentru a permite experimentele de deformare celulară care au fost efectuate la aceste animale. Alegerea noastră de iepuri permite comparații cu studii anterioare cu același protocol chirurgical. Prezentul studiu oferă informații noi despre rolul IFP în inflamație, care are relevanță în progresia OA [4]. Studierea încărcării normale și anormale a articulației genunchiului și a articulațiilor rotulofemorale și tibiofemorale nu este posibilă în culturile celulare sau în explante. Genunchiul iepurelui diferă în anatomie și dimensiunea structurilor intraarticulare, precum și în domeniul mișcării de la genunchiul uman [42]. Aceste diferențe trebuie luate în considerare atunci când traducem rezultatele actuale în contextul OA timpuriu la om. Cu toate acestea, structurile osoase, ligamentoase și musculare de bază sunt similare [42, 43], iar dezvoltarea OA, deși mult mai rapidă la iepuri decât la oameni, include o serie similară de evenimente patologice [8]. Astfel, fenomenele FA descrise aici ar putea avea relevanță în dezvoltarea OA umană.
Concluzii
IFP a avut un profil lipidic mai pro-inflamator la iepurii ACLT comparativ cu martorii încă din 2 săptămâni după ACLT. Echilibrul PUFA n-3/n-6 modificat sugerează implicarea IFP în procesele inflamatorii ale OA în genunchi. În plus, divergența genunchiului contralateral de profilul FA al genunchiului de control indică faptul că acesta este în sine o țintă interesantă de cercetare. Chiar dacă semnătura FA a genunchiului contralateral a rămas similară cu cea a articulației de control neoperate în cele mai multe aspecte, utilizarea acesteia ca control neafectat în interiorul animalelor pentru studierea profilelor FA ale IFP nu poate fi recomandată fără prudență. Reducerea indusă de ACLT în raportul n-3/n-6 PUFA al IFP este în concordanță cu inflamația și degradarea cartilajului în OA timpurie. Poate fi un nou factor care contribuie și, prin urmare, o posibilă țintă terapeutică, în studiul și tratamentul patogenezei bolii.
- Evaluarea cerinței esențiale de acid gras în gerbili prin raportul acidului gras polinesaturat
- 40-30-30 Bara de echilibru a principiului nutriției
- Blog - Pagina 2 din 6 - Nutriția echilibrului corect
- Refluxul acid la sugari a căror formulă este cea mai bună
- Reflux acid vs arsuri la stomac vs GERD Care este diferența Evens