Charlotte Gröschel
Maximilian Prinz-Wohlgenannt
Ildiko Mesteri
2 Institutul de Patologie Überlingen, 88662 Überlingen, Germania; [email protected]
Sobha Karuthedom George
Lena Trawnicek
Denise Heiden
Abhishek Aggarwal
Samawansha Tennakoon
Maximilian Baumgartner
3 Divizia de Gastroenterologie și Hepatologie, Departamentul de Medicină Internă 3, Universitatea de Medicină din Viena, 1090 Viena, Austria; [email protected] (MB); [email protected] (C.G.); ten.ygoloce-laiborcim@gnal (ML)
Christoph Gasche
3 Divizia de Gastroenterologie și Hepatologie, Departamentul de Medicină Internă 3, Universitatea de Medicină din Viena, 1090 Viena, Austria; [email protected] (MB); [email protected] (C.G.); ten.ygoloce-laiborcim@gnal (ML)
Michaela Lang
3 Divizia de Gastroenterologie și Hepatologie, Departamentul de Medicină Internă 3, Universitatea de Medicină din Viena, 1090 Viena, Austria; [email protected] (MB); [email protected] (C.G.); ten.ygoloce-laiborcim@gnal (ML)
Rodrig Marculescu
4 Departamentul de Medicină de Laborator, Universitatea de Medicină din Viena, 1090 Viena, Austria; [email protected]
Teresa Manhardt
Martin Schepelmann
Enikö Kallay
Date asociate
Abstract
Boala inflamatorie a intestinului crește șansele de a dezvolta cancer asociat colitei. Am emis ipoteza că dieta în stil occidental (WD) agravează azoximetanul (AOM)/sare de sodiu sulfat de dextran (DSS), tumorigeneză asociată colitei și că trecerea la dieta standard AIN93G va ameliora simptomele bolii chiar și după inițierea cancerului. Șoarecii femele BALB/c au primit fie WD (grup WD), fie dieta standard AIN93G (grup AIN) pentru întreaga perioadă experimentală. După cinci săptămâni, șoarecii au primit 12,5 mg/kg AOM intraperitoneal, urmat de trei cicluri DSS. Într-un grup de șoareci, WD a fost trecut la AIN93G cu o zi înainte de începerea primului ciclu DSS (grup WD/AIN). Hrănirea WD pe parcursul întregii perioade experimentale a agravat simptomele colitei, a scurtat colonul (p Cuvinte cheie: boală inflamatorie intestinală, cancer asociat colitei, microbiom, dietă occidentală, vitamina D, boală hepatică grasă nealcoolică, CYP24A1, cale Wnt, focare criptare aberante, regenerare mucoasă
1. Introducere
Incidența bolilor inflamatorii intestinale (IBD) crește continuu. Terapiile standard pentru colita ulcerativă și boala Crohn au o eficacitate limitată [1]. Incidența crescândă a IBD în regiunile industrializate ale lumii și noua apariție în țările care adoptă un stil de viață occidental sugerează că o schimbare a obiceiurilor nutriționale către o dietă tipică occidentală contribuie la IBD [2,3]. Pacienții cu IBD prezintă un risc crescut de a dezvolta cancer colorectal (CAC) asociat inflamației [4]. O meta-analiză recentă a raportat că tumorigeneză la pacienții cu IBD apare mai degrabă în colonul proximal și este asociată cu un prognostic mai prost comparativ cu cancerul colorectal sporadic (CRC) [5]. Există unele dovezi că tumorile proximale ale colonului se dezvoltă mai des la femei [6].
Datele epidemiologice sugerează o corelație pozitivă între dietele bogate în grăsimi și incidența crescută a IBD și CRC [7,8]. Grăsimile derivate de la animale sunt un factor de risc pentru cancerul de colon, în timp ce cantități adecvate de acizi grași n-3-polinesaturați, care se găsesc în uleiul de soia [9], reduc riscul de a dezvolta CRC [10] și ameliorează inflamația [11,12 ]. Cantitatea totală de grăsimi dietetice și sursa și compoziția lipidelor tumorigeneză gripală și a proceselor inflamatorii [13]. Acizii grași saturați au proprietăți pro-inflamatorii [14]. Grăsimea din unt promovează inflamația intestinală prin creșterea producției de factor de necroză tumorală intestinală-α la șoareci [15]. Eliberarea citokinelor inflamatorii și inducerea stresului oxidativ din celulele imune înnăscute și adaptive activează β-catenina și factorul nuclear kappa-lantul ușor de potențare a celulelor B activate (NF-κB), doi factori de transcripție care reglează vindecarea rănilor epiteliale intestinale dar, de asemenea, duc la transformarea malignă [16,17,18].
Inducerea chimică a tumorigenezei induse de inflamație de către azoximetan (AOM) și DSS este un model care seamănă cu CAC uman în ceea ce privește caracteristicile histopatologice și inflamatorii [33]. Deteriorarea țesutului indusă de DSS afectează preferențial compartimentul proliferativ al criptei, sursa regenerării epiteliale [34].
Am investigat dacă efectul negativ al așa-numitei „diete în stil occidental” (WD), bogat în grăsimi animale, dar deficitar în calciu, vitamina D, donatori de metil și fibre, asupra formării tumorilor asociate colitei poate fi prevenit prin schimbarea WD la dieta normală „sănătoasă” AIN93G, care conține ulei de soia și niveluri adecvate de micronutrienți și fibre.
2. Materiale și metode
2.1. Animale, diete și modelul tumorilor AOM/DSS
Șoareci BALB/c de sex feminin în vârstă de patru săptămâni (Charles River, Germania) au fost găzduiți la unitatea de animale a Institutului de Cercetare Fiziopatologică și Alergică a Universității de Medicină din Viena într-un mediu controlat cu un ciclu de lumină - întuneric de 12 ore. Liniile directoare ale Regulamentelor Uniunii Europene privind îngrijirea și utilizarea animalelor de laborator au fost respectate la menținerea condițiilor de viață și la efectuarea experimentelor. Studiul a fost aprobat de Comitetul de Etică al Universității Medicale din Viena, precum și de Ministerul Federal Austriac pentru Știință, Educație și Cercetare (nr: BMWF-66.009/0069-WF/V/3b/2015). La livrare, șoarecii au fost împărțiți în mod aleatoriu în trei grupuri și au fost aclimatizați timp de 14 zile pe un chow obișnuit, înainte de a primi fie dieta AIN93G, fie WD (ssniff EF R/M acc. TD88137 mod.) Modificat pentru grăsimi, calciu, vitamina D, donatorii de metil și fibre, asemănătoare cu New Western Diet de la Newmark și colab. [20] (Tabelul S1).
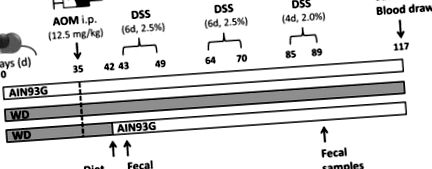
Un grup a primit exclusiv dieta AIN93G (grupul AIN, opt animale) în timp ce altul a primit doar WD (grupul WD, nouă animale) pe parcursul perioadei experimentale. Al treilea grup a fost menținut pe WD timp de 42 de zile înainte ca dieta să fie trecută la dieta AIN93G (grup WD/AIN, opt animale) cu o zi înainte de începerea primului ciclu DSS (MP Biomedicals, Solon, OH, SUA). După 35 de zile de hrănire cu dieta WD sau AIN93G, șoarecii au primit 12,5 mg/kg AOM (Sigma Aldrich, St. Louis, MO, SUA) prin injecție intraperitoneală (i.p.) pentru a induce tumorigeneză. Șoarecii au fost tratați cu trei cicluri de DSS (primul și al doilea ciclu DSS: șase zile, 2,5% pe ciclu, al treilea ciclu: patru zile, 2% DSS), adăugate la apa de la robinet autoclavată pentru a induce inflamația pentru promovarea tumorii. Șoarecii au fost eutanasiați la 28 de zile după sfârșitul celui de-al treilea ciclu DSS, în ziua 117 (Figura 1). Sângele a fost colectat prin puncție cardiacă. Rinichiul, ficatul, splina și colonul au fost îndepărtate. Colonul a fost clătit în soluție salină tamponată cu fosfat rece (PBS) și 0,5 cm de la fiecare capăt a fost tăiată și congelată în azot lichid. Colonul rămas a fost laminat într-o rolă elvețiană [35], fixat în formaldehidă-PBS 4% și ulterior încorporat în parafină. Ficatele și rinichii au fost tăiați în două jumătăți pentru înghețarea rapidă și încorporarea parafinei, așa cum este descris mai sus.
Reprezentarea grafică a protocolului de tratament. Trei grupuri de șoareci femele BALB/c au primit fie dieta AIN93G, fie dieta în stil occidental (WD) timp de 35 de zile, înainte de a primi azoximetan (AOM) intraperitoneal (ip) cu o zi înainte de începerea primului ciclu de dextran sulfat de sodiu sare (DSS), într-un grup, WD a fost trecut la dieta AIN93G. Șoarecii au fost sacrificați la 28 de zile după cel de-al treilea ciclu de DSS.
2.2. Analiza microbiotei
Fecalele au fost colectate în prima zi a primei și în ultima zi a celui de-al treilea ciclu DSS. Probele au fost congelate rapid în azot lichid și depozitate la -20 ° C. ADN-ul a fost izolat folosind QIAamp Fast DNA scaun Mini kit (Qiagen) conform instrucțiunilor producătorului, cu bătăi de margele folosind tuburi Lysing Matrix E (MP Biomedicals) înainte de extracție. Secvențierea ampliconului genei ARNr 16S și pregătirea bibliotecii au fost efectuate utilizând un protocol Illumina standard [36]. Citirile au fost procesate folosind pachetele software DADA2 [37] și SINA [38]. Pentru analiza similitudinii eșantioanelor s-au folosit scripturi Rhea modificate [39]. Distanțele generalizate UniFrac au fost vizualizate utilizând scalarea multidimensională [40]. Am evaluat semnificația clusterului folosind analiza variației permutational multivariat. Testarea diferențelor semnificative în diversitate și abundențe bacteriene a fost efectuată utilizând testul Kruskal-Wallis Rank Sum Test cu metoda Benjamin-Hochberg pentru corecție pentru comparații multiple. Am folosit testul Mann-Whitney U pentru a compara distanțele filogenetice.
2.3. Probele de țesut, izolarea ARN, transcrierea inversă și RT-PCR cantitativă
Țesutul înghețat rapid a fost omogenizat cu omogenizatorul Precellys 24-Dual (Precellys, Franța) în reactiv TRIzol (Life technologies, SUA) și ARN-ul a fost izolat conform instrucțiunilor producătorului. Integritatea ARN a fost verificată pe gelurile de agaroză colorate cu Gel Green (Peqlab, Austria). Transcrierea inversă și qRT-PCR au fost efectuate așa cum s-a descris mai înainte [41]. Pentru calcul în conformitate cu metoda ∆∆Ct, expresia genei țintă a fost normalizată la două gene de referință, beta-actina șoarecelui (ActB) și factorul de alungire a traducerii eucariote de șoarece 1 beta 2 (Eef1β2) și a fost setată în raport cu un calibrator total de ARN (Clontech, Mountain View, CA, SUA). Exemple de secvențe ale genelor de referință [42] și ale Occludin și Tlr4 [27] au fost descrise anterior. Exemple de secvențe ale celorlalte gene de interes sunt prezentate în Tabelul S2.
2.4. Examinarea histologică a secțiunilor de colon
Secțiuni de țesut de patru microni au fost tăiate din rulouri elvețiene colonice încorporate în parafină și au fost colorate cu soluție de hematoxilină Mayer și eozină (Sigma Aldrich). Un patolog a evaluat inflamația cronică și tumorigeneză orbite pentru tratamente și a evaluat gradul de colită pe baza numărului de leziuni, precum și a severității acestora, atribuind un scor histopatologic (0-4), 0 = fără colită, 4 = colită severă [ 43]. Au fost diagnosticate focare criptare aberante (ACF), displazie și carcinom in situ, iar dimensiunea leziunilor a fost cuantificată prin numărarea criptelor afectate. Scorul displaziei a fost determinat conform metodei de Riddell și colab. [44].
2.5. Imunohistochimie și imunofluorescență
2.6. Analize statistice
Toate analizele statistice au fost efectuate cu SPSS versiunea 22 (IBM, SUA), iar graficele au fost desenate de GraphPad Prism versiunea 7 (GraphPad Software Inc., San Diego, SUA). Datele distribuite în mod normal au fost transformate în log pentru a obține o distribuție normală și analizate prin ANOVA unidirecțională cu testul post-hoc Tukey, după caz. Valorile aberante semnificative au fost detectate prin testul anormal al lui Grubbs și au fost excluse din analiză. Datele distribuite în mod normal au fost analizate de Kruskal Wallis cu testul post-hoc al lui Dunn.
- Dieta Sophie Wessex Singurul aliment care îi dă contesei strălucirea ei sănătoasă
- Femeile obeze care au o dietă cu conținut scăzut de energie, orez și fasole, au efecte de leucina, arginina sau glicina
- PURE Healthy Diet, inclusiv lactatele și carnea pot fi bune pentru inimile din întreaga lume - American College of
- Naomi Campbell Rutină de antrenament și plan de dietă - Celeb sănătos
- Cea mai populară dietă strictă naturală pentru a pierde în greutate rapid sănătoasă - Managementul HazMat