AK Ovsyannikova
1 Institutul de Medicină Internă și Preventivă - filiala Institutului de Citologie și Genetică, Filiala Siberiană a Academiei Ruse de Științe, Novosibirsk, Rusia
2 Universitatea de Stat Novosibirsk, Novosibirsk, Rusia
O. D. Rymar
1 Institutul de Medicină Internă și Preventivă - filiala Institutului de Citologie și Genetică, Filiala Siberiană a Academiei Ruse de Științe, Novosibirsk, Rusia
D. E. Ivanoshchuk
1 Institutul de Medicină Internă și Preventivă - filiala Institutului de Citologie și Genetică, Filiala Siberiană a Academiei Ruse de Științe, Novosibirsk, Rusia
2 Universitatea de Stat Novosibirsk, Novosibirsk, Rusia
3 Institutul de citologie și genetică al Centrului Federal de Cercetare, filiala siberiană a Academiei de Științe din Rusia, Novosibirsk, Rusia
Svetlana V. Mihailova
3 Institutul de citologie și genetică al Centrului Federal de Cercetare, filiala siberiană a Academiei de Științe din Rusia, Novosibirsk, Rusia
E. V. Shakhtshneider
1 Institutul de Medicină Internă și Preventivă - filiala Institutului de Citologie și Genetică, Filiala Siberiană a Academiei Ruse de Științe, Novosibirsk, Rusia
2 Universitatea de Stat Novosibirsk, Novosibirsk, Rusia
P. S. Orlov
1 Institutul de Medicină Internă și Preventivă - filiala Institutului de Citologie și Genetică, Filiala Siberiană a Academiei Ruse de Științe, Novosibirsk, Rusia
2 Universitatea de Stat Novosibirsk, Novosibirsk, Rusia
3 Institutul Federal de Cercetare al Institutului de Citologie și Genetică, filiala siberiană a Academiei de Științe din Rusia, Novosibirsk, Rusia
E. S. Malakhina
2 Universitatea de Stat Novosibirsk, Novosibirsk, Rusia
4 Institutul de biologie moleculară și celulară, filiala siberiană a Academiei de Științe din Rusia, Novosibirsk, Rusia
M. I. Voevoda
1 Institutul de Medicină Internă și Preventivă - filiala Institutului de Citologie și Genetică, Filiala Siberiană a Academiei Ruse de Științe, Novosibirsk, Rusia
2 Universitatea de Stat Novosibirsk, Novosibirsk, Rusia
3 Institutul Federal de Cercetare al Institutului de Citologie și Genetică, filiala siberiană a Academiei de Științe din Rusia, Novosibirsk, Rusia
Date asociate
Seturile de date în timpul și/sau analizate în timpul studiului curent sunt disponibile de la autorul corespunzător, la cerere rezonabilă.
Abstract
Diabetul zaharat cu moștenire autozomală dominantă, adică diabetul cu debut la maturitate al tinerilor (MODY), este o formă genetică a diabetului zaharat. Fenotipul MODY este asociat cu mutații genetice care duc la disfuncția pancreatică a celulelor β. Aici, prezentăm cazul clinic al unui proband în vârstă de 50 de ani cu diabet zaharat familial în cinci generații (proband, mama ei, bunica, străbunicul și fiul). Această boală este asociată cel mai probabil cu noua mutație Ser6Arg din gena HNF1A, care a fost identificată la patru membri ai familiei. Mutația nu a fost detectată la pacienții MODY (126 subiecți), la pacienții cu diabet zaharat de tip 2 (188 subiecți) și la un eșantion general de populație (564 subiecți).
Material suplimentar electronic
Versiunea online a acestui articol (10.1007/s13300-017-0350-8) conține materiale suplimentare, care sunt disponibile utilizatorilor autorizați.
Introducere
Diabetul zaharat (DM) cu moștenire autosomală dominantă, adică DM cu debut la maturitate al tânărului (MODY), este un grup eterogen de boli cauzate de mutații genetice care au ca rezultat disfuncția pancreatică a celulelor β [1 - 4]. Verificarea MODY permite gestionarea cu succes a pacientului, asigurând o sarcină sănătoasă și oferind consiliere genetică familiilor [5 - 7]. Examinarea rudelor probandilor MODY face posibilă diagnosticarea hiperglicemiei în faza preclinică.
Până în prezent, 14 gene au fost identificate pentru a fi asociate cu MODY. Mutațiile din fiecare dintre aceste gene conduc la dezvoltarea diferitelor subtipuri MODY, diferind în ceea ce privește distribuția populației, caracteristicile clinice și strategiile de management [1, 8 - 10]. În ciuda variației semnificative a prevalenței formelor individuale ale bolii în diferite populații, mutațiile genelor care codifică factorul nuclear hepatocitar 1α (HNF1A) și glucokinaza (GCK) sunt tipuri dominante de mutație asociate cu MODY, și anume subtipurile MODY3 -HNF1A ) și MODY2 (MODY-GCK), respectiv [11]. Aceste subtipuri reprezintă până la 90% din toate cazurile MODY [12]. În Marea Britanie, Olanda și Danemarca, cea mai comună formă de diabet monogen este MODY-HNF1A, în timp ce în Spania, Italia, Franța, Germania și Republica Cehă prevalează MODY-GCK [13]. În Rusia, incidența MODY-GCK și MODY-HNF1A este aproximativ egală [14].
În acest raport, descriem un caz clinic într-o familie cu MODY-HNF1A asociată cu o mutație nouă în HNF1A.
Descrierea cazului
O femeie în vârstă de 50 de ani cu DM a vizitat în mod regulat departamentul nostru și starea ei a fost monitorizată îndeaproape. În timpul examinării inițiale din septembrie 2015, ea sa plâns de senzația de arsură la nivelul picioarelor în timpul zilei, dureri de cap periodice și oboseală.
Datorită istoricului familial de DM, fiul probandului și-a limitat consumul de carbohidrați ușor digerabili în copilărie și adolescență și a fost monitorizat în mod regulat pentru glicemie; hiperglicemia nu a fost detectată până în prezent. În aceleași perioade, nu au existat probleme cu greutatea corporală. La vârsta de 21 de ani, a dezvoltat simptome asociate stresului, dureri de cap, oboseală și tulburări de somn. Examinarea a identificat hiperglicemia postului (8-10 mmol/L) și postprandial (12,8 mmol/L), rezultând un diagnostic de DM. A fost recomandat tratamentul cu preparate de sulfoniluree (SU), dar pacientul a optat pentru regimul bazal-bolus al terapiei cu insulină. În prezent, folosește insulină degludec la 6 U/zi și insulină aspart la 1 U/CU (în medie 15 U/zi). Anticorpii împotriva celulelor β și GAD sunt absenți. Nivelul bazal al peptidei C este scăzut: 260 pmol/L (interval de referință 298–2350); HbA1c este de 7,1%. Analiza biochimică a sângelui a relevat o creștere a colesterolului LDL (3,2 mmol/L; valori de referință 2 .
Mama probandului are acum 72 de ani. Diagnosticul de DM la fiica ei a contribuit la controlul regulat al glucozei. Hiperglicemia a fost diagnosticată la vârsta de 45 de ani în timpul unei examinări de rutină; nu s-au înregistrat plângeri și nu a avut probleme cu greutatea. De obicei s-a observat hiperglicemie postprandială. Pacientul a atins și menținut normoglicemia prin dietoterapie timp de 2 ani, apoi luând gliclazidă timp de 5 ani. La vârsta de 52 de ani (1997), decompensarea metabolismului carbohidraților s-a prezentat, mai ales ca hiperglicemie postprandială; s-a prescris insulină actrapidă (în loc de gliclazidă) la 0,5 U/CU, pe care pacientul o ia în prezent. Mama probandului a fost diagnosticată cu polineuropatie diabetică periferică cu dislipidemie. Printre comorbidități, există hipertensiune arterială de la vârsta de 40 de ani (fără terapie hipotensivă permanentă) și diverticul esofagian.
Probandii, mama ei și fiul ei au primit studii superioare, nu fumează și respectă regimul dietetic și de exerciții fizice recomandat pentru DM.
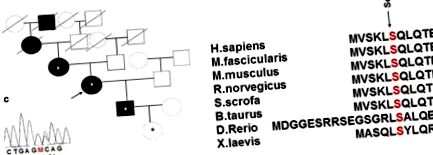
În istoria familială a probandului, DM a fost prezentă și în bunica și străbunicul ei matern, adică în cinci generații (Fig. 1 a). Boala la ambele rude s-a manifestat la vârsta de 65-66 de ani pe fondul condițiilor stresante pe termen lung. Străbunicul a luat medicamentele SU (carbutamidum) și a murit la vârsta de 74 de ani după o boală cerebrovasculară acută repetată. Bunica a luat, de asemenea, medicamente SU (gliclazidă) în doze mai mici decât cele terapeutice medii, cu un control glicemic bun, și a murit la vârsta de 91 de ani; istoricul ei medical a inclus hipertensiune arterială și o boală cerebrovasculară acută recurentă.
A Istoria familiei și noua variantă a genei care codifică factorul nuclear 1α al hepatocitelor (HNF1a) într-o familie cu diabet zaharat moștenit (DM). Asteriscul indică purtătorii mutației HNF1a Ser6Arg examinați medical. b Secvența de aminoacizi conservată a genei HNF1a printre diferite specii. c Secvență cu substituție de aminoacizi
Probandul, fiul ei și mama ei au prezentat dislipidemie la o vârstă fragedă, iar alte rude care aveau DM au dezvoltat complicații macrovasculare la o vârstă avansată. Aproape toți acești pacienți au obținut și au menținut normoglicemia de ceva timp prin dieta recomandată; acest rezultat este indicativ al unui debut neagresiv al acestui tip de DM. În proband, fiul ei și mama ei, toți utilizând farmacoterapia pentru a-și gestiona DM, s-a dezvoltat în cele din urmă decompensarea metabolismului glucidic indusă de stres, ceea ce a dus la creșterea dozei.
Datorită trăsăturilor caracteristice ale bolii (agregare familială a DM, dislipidemie și complicații macrovasculare, o creștere a glicemiei la masa corporală normală, utilizarea dozelor mici de insulină, nivelul stabil al peptidei C și lipsa anticorpilor anti-insulă ), MODY-HNF1A a fost suspectat.
Protocolul de studiu a fost aprobat de Comitetul de Etică local al Institutului de Medicină Internă și Preventivă (o ramură a Institutului de Citologie și Genetică, Filiala Siberiană a Academiei Ruse de Științe, Novosibirsk, Rusia). Consimțământul informat scris pentru a fi examinat și pentru a participa la studiu a fost obținut de la fiecare pacient. Pentru persoanele cu vârsta sub 18 ani, consimțământul informat a fost semnat de un părinte sau de un tutore legal. ADN-ul genomic pentru secvențiere a fost izolat din leucocite din sângele venos prin extracția fenol-cloroform [15].
Primerii înainte și invers pentru exoni și limitele exonului au fost proiectați în software-ul Primer-Blast (https://www.ncbi.nlm.nih.gov/tools/primer-blast/). Oligonucleotidele sunt prezentate în tabelul cu materiale suplimentare electronice 1. PCR-urile au fost stabilite folosind BioMaster LR HS-PCR (2 ×) (BiolabMix, Novosibirsk, Rusia). Programul PCR a constat într-o denaturare inițială la 94 ° C timp de 3 minute, urmată de 35 de cicluri la 94 ° C timp de 30 s, 68 ° C timp de 30 s și 72 ° C timp de 50 s. Produsele PCR au fost evaluate prin electroforeză într-un gel de poliacrilamidă 5% după vizualizare cu o soluție de bromură de etidiu. O scară de ADN de 100 bp (SibEnzyme, Novosibirsk, Rusia) a fost rulată pe fiecare gel ca markeri de dimensiune moleculară. Ampliconii au fost purificați folosind margele Agencourt AMPure Xp (Beckman Coulter, Palo Alto, CA). Reacțiile de secvențiere au fost efectuate pe un secvențiator automat ADN 3500 ADN (Thermo-Fisher Scientific, Waltham, MA) cu kitul BigDye Terminator v3.1 Cycle Sequencing (Thermo Fisher Scientific). Secvențele au fost analizate utilizând software-ul Vector NTI® Advance (Thermo Fisher Scientific). Versiunea hg19 a genomului uman a servit ca o secvență de referință pentru alinierea.
Metoda secvențierii automate Sanger directe a fost aplicată ADN-ului probandului și ADN-ului membrilor disponibili ai familiei sale, adică mama, fiul și nepoata normoglicemică a probandului în vârstă de 2 luni, pentru a analiza exonii și locurile de îmbinare a Gena HNF1A. Examinarea a relevat o nouă substituție heterozigotă Ser6Arg (AGC> AGA) în exonul 1 al genei HNF1A la toți membrii familiei testați. Această substituție se află într-o regiune foarte conservată. Poziția afectată este, de asemenea, conservată în rândul speciilor (Fig. 1 b) și se află în domeniul responsabil pentru dimerizarea proteinelor [16]. Efectele funcționale și semnificative posibile ale variantelor de tip HNF1A au fost prezise prin intermediul instrumentelor in silico PolyPhen-2 v.2.2.5 [17], SIFT și PROVEAN [18]. Serviciile web PolyPhen-2 v.2.2.5 și PROVEAN/SIFT prezic un posibil impact al substituției aminoacizilor asupra structurii și funcției unei proteine umane. Varianta detectată a fost prezisă ca fiind „potențial patogenă” de PolyPhen-2, cu un scor de 0,815 și „dăunătoare” de SIFT cu un scor de 0,001.
În studiul HUNT2, mutația potențial patogenă Ser6Arg a fost detectată în codonul 6, dar la o altă poziție nucleotidică, AGC> AAC, la un pacient norvegian cu MODY [19]. Nu a fost detectat la 838 subiecți norvegieni non-diabetici de control HUNT2.
Am testat gena HNF1A pentru Ser6Arg în trei grupuri. Primul grup a fost format din 564 de pacienți selectați aleatoriu, al doilea grup a cuprins 188 de pacienți cu DM tip 2 (DM2), iar al treilea grup a cuprins 126 de pacienți cu fenotipul MODY. Toate analizele au fost efectuate la Institutul de Medicină Internă și Preventivă, Novosibirsk.
Grupul general de pacienți inclus în analiză a fost selectat dintr-un sondaj al populației intervievate în cadrul proiectului HAPIEE [20], Novosibirsk, Rusia (9360 participanți, cu vârste cuprinse între 45-69 ani și 50% bărbați, 97% caucazieni) . Un total de 564 de pacienți selectați aleatoriu (vârsta medie 54,2 ± 0,4) au fost incluși în studiul nostru. Grupul DM2 a fost format din 68 de femei și 87 de bărbați [vârsta medie 59,0 ± 6,7 ani; IMC mediu 31 kg/m 2 (bărbați) și 32 kg/m 2 (femei)]. Eșantionul DM2 a fost selectat în mod arbitrar din proiectul HAPIEE [20]. Am utilizat criteriile Asociației Americane a Diabetului (http://care.diabetesjournals.org/content/40/Supplement_1) pentru diagnosticarea DM2. Un total de 126 de pacienți cu fenotipul MODY (vârsta medie 23,8 ± 2,6 ani) au fost supuși unui examen medical complet la un anumit moment specificat între 2014 și 2017, inclusiv un test de sânge biochimic; determinarea HbA1c, C-peptidei, GAD, ICA, stării tiroidei și microalbuminuriei; ultrasonografie abdominală și renală; monitorizare continuă a glucozei în timp real cu Medtronic Paradigm MMT-722 (Meditronic, Dublin, Irlanda); și teste genetice.
Ser6Arg a fost genotipat folosind testul TaqMan SNP (BioLabMix, Novosibirsk, Rusia) și sistemul StepOnePlus în timp real PCR (Thermo Fisher Scientific, SUA).
Testarea substituției Ser6Arg în gena HNF1A a dat rezultate negative în eșantionul de populație de HAPIEE, în eșantionul de 188 de subiecți cu DM2 și în rândul celor 126 de pacienți cu un model clinic de MODY.
Discuţie
Pacienții tineri cu un dezechilibru al metabolismului glucidic pot primi un diagnostic de diabet zaharat de tip 1 (DM1), DM2 sau forme monogene mai rare de DM [21]. Debutul bolii pacientului nostru a fost caracterizat de lipsa unor caracteristici ale celor mai frecvente tipuri de DM. Absența cetonuriei și a cetoacidozei este atipică; nu au fost detectați anticorpi împotriva GAD sau ICA, care sunt prezenți la mai mult de 70% dintre pacienții cu manifestări de DM1 [22]. Nivelul peptidei C a fost normal, dar acest rezultat poate fi observat în stadiile incipiente ale DM1. Pacientul nu era supraponderal și nu avea manifestări clinice de rezistență la insulină, cum ar fi acanthosis nigricans, caracteristic DM2 cu debut precoce [23]. Diagnosticul de MODY a fost susținut de diagnosticul DM în cinci generații, secreție stabilă de peptidă C și dislipidemie la o vârstă fragedă, fără supraponderalitate.
În cazul clinic prezentat, substituția a fost detectată în exonul 1, vârsta de detectare a hiperglicemiei în proband a fost de 12 ani, dar DM s-a manifestat la vârsta de 21 de ani.
Cel mai timpuriu marker clinic pentru boală poate fi glicozuria, care este legată de reabsorbția renală a glucozei renale [1]. Au fost documentate cazuri de complicații micro și macrovasculare la pacienții cu MODY-HNF1A, ceea ce evidențiază necesitatea de a controla nivelul glicemiei la acești pacienți [25]. Rudele probandului au prezentat, de asemenea, complicații macrovasculare.
Pe lângă dezvoltarea DM, mutațiile genei HNF1A sunt legate de neoplasmele hepatice, cum ar fi adenomul hepatocelular (o tumoră hepatică benignă rară, care apare în general la femeile tinere care utilizează contraceptive orale) și, în cazuri rare, cu carcinoamele hepatocelulare [ 26]. În general, manifestările clinice ale MODY-HNF1A variază de la hiperglicemia subclinică la decompensarea pronunțată a metabolismului glucidic la diferiți pacienți și chiar la rudele din aceeași familie cu mutație patogenă [10].
Preparatele SU (SUP) sunt tratamentul principal. Se cunoaște că purtătorii mutației HNF1A sunt mai sensibili la efectele hipoglicemice ale SUP decât pacienții cu DM2 [1]. În cazul studiat, mama probandului a reușit să realizeze normoglicemie atunci când a luat SUP, de asemenea pentru perioade prelungite. Conform literaturii, aproximativ 50% dintre pacienții cu MODY-HNF1A cu boală progresivă necesită terapie cu insulină [27].
Manifestarea DM în timpul sarcinii, însoțită de o creștere substanțială a glicemiei, lipsa cetozei, dezvoltarea complicațiilor microvasculare (retinopatie și neuropatie) cu un curs clinic scurt și o combinație de hiperglicemie cu dislipidemie sunt semnele specifice DM la pacient. în studiu.
Concluzie
Acest caz relevă trăsături neobișnuite ale DM asociate cu noua substituție Ser6Arg în gena HNF1A (subtipul MODY3). Această modificare a nucleotidelor nu a fost detectată într-un eșantion general de populație și a fost capabilă să provoace MODY3 în proband și familia ei. Acest caz ilustrează importanța deosebită a unei abordări personalizate a diagnosticului și a tratamentului pentru identificarea unui curs atipic de DM la tinerii cu antecedente familiale de hiperglicemie.
Material suplimentar electronic
Mai jos este linkul către materialul suplimentar electronic.
- Abuz de metformină în caz de scădere în greutate la un pacient fără diabet - Consilier în endocrinologie
- O nouă structură genică a familiei disintegrinei O subunitate a disintegrinei dimerice are o codificare scurtă
- În spatele imaginii corpului Problemele femeilor tinere Swaddle
- Tablete de grăsime pentru burtă Cele mai bune recenzii Dentist de familie Wentzville
- O plantă de familie, blând și frunze de tei; Herbal Academy