Dudley W. Lamming
1 Whitehead Institute for Biomedical Research, Cambridge MA 02142, SUA; Departamentul de Biologie, MIT, Cambridge, MA 02139, SUA; Howard Hughes Medical Institute, MIT, Cambridge, MA 02139, SUA; Broad Institute of Harvard și MIT, Seven Cambridge Center, Cambridge, MA 02142, SUA; Institutul David H. Koch pentru cercetarea integrativă a cancerului la MIT, Cambridge, MA 02139, SUA
David M. Sabatini
1 Whitehead Institute for Biomedical Research, Cambridge MA 02142, SUA; Departamentul de Biologie, MIT, Cambridge, MA 02139, SUA; Howard Hughes Medical Institute, MIT, Cambridge, MA 02139, SUA; Broad Institute of Harvard și MIT, Seven Cambridge Center, Cambridge, MA 02142, SUA; Institutul David H. Koch pentru cercetarea integrativă a cancerului la MIT, Cambridge, MA 02139, SUA
rezumat
Calea de semnalizare mTOR reglează multe procese metabolice și fiziologice fundamentale, inclusiv metabolismul lipidelor. Explorăm descoperirile recente privind rolul mTOR în homeostazia lipidelor, cu accent pe descoperirile recente din modele in vivo cu privire la rolul mTORC2 în lipoliză, lipogeneză și adipogeneză.
O introducere în mTOR
Ținta mecanicistă a rapamicinei (mTOR) este o proteină kinază serină/treonină asemănătoare PI3K, care este conservată în toate eucariotele. mTOR se găsește în două complexe, fiecare cu componente proteice distincte, precum și substraturi. Complexul mTOR 1 (mTORC1), care este extrem de sensibil la rapamicină, reglează procese precum biogeneza ribozomală, traducerea dependentă de capac, biogeneza lizozomală și autofagia prin substraturi care includ S6K, 4E-BP1, TFEB1 și Ulk1. Activitatea mTORC1 este reglementată parțial de familia Rag a GTPazelor, care promovează localizarea mTORC1 către lizozom ca răspuns la aminoacizi și glucoză. La lizozom, mTORC1 este activat de Rheb legat de GTP, care este el însuși reglementat de complexul de scleroză tuberoasă (TSC 1/2) ca răspuns la semnalizarea AMPK, oxigen și factor de creștere. Complexul mTOR 2 (mTORC2), care este rezistent la tratamentul acut cu rapamicină, dar poate fi perturbat prin tratamentul cronic cu rapamicină în cultura țesuturilor, precum și in vivo, este sensibil la semnalizarea factorului de creștere și reglează țintele în aval de receptorul pentru insulină/IGF-1 prin intermediul substraturi care includ Akt, SGK și PKCα. Pentru un tratament mai complet al reglării semnalizării mTOR ca răspuns la substanțe nutritive, trimitem cititorul la o revizuire cuprinzătoare recentă (Laplante și Sabatini, 2012).
În ultimii ani, s-a observat o explozie de interes asupra căii de semnalizare mTOR, stimulată în mare parte de constatarea că inhibarea semnalizării mTORC1 poate crește în mod semnificativ durata de viață și poate proteja de bolile legate de vârstă la modelele de șoarece (revizuite în (Lamming și colab.)., 2013)). Modelele de șoareci modificate genetic s-au adăugat în mod semnificativ la înțelegerea noastră a rolului mTOR în fiziologia mamiferelor. Este clar că semnalizarea mTOR reglează homeostazia lipidelor, deoarece tratamentul rozătoarelor sau al oamenilor cu rapamicină duce la hiperlipidemie și hipercolesterolemie. Această minireview se va concentra pe rolul mTORC1 și mTORC2 în fiziologia lipidelor (Figura 1A).
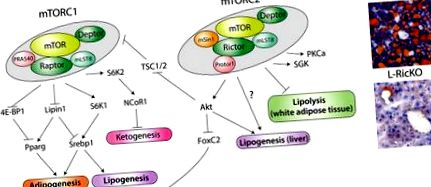
mTOR în homeostazia lipidică. A) Un model al acțiunilor mTORC1 și mTORC2 în metabolismul lipidelor, inclusiv adipogeneza, lipogeneza și lipoliza. mTORC1 controlează, de asemenea, ketogeneza, care poate avea o relație reciprocă cu lipogeneza, prin NCoR1, dar mecanismul exact prin care reglează NCoR1 este necunoscut. Mecanismul prin care mTORC2 reglează lipogeneza și lipoliza nu sunt, de asemenea, cunoscute în prezent, deși Akt poate fi implicat în reglarea lipogenezei. B) Secțiuni reprezentative de ficat colorate cu ulei-roșu-O de la șoareci de tip sălbatic sau Rictor Liver knockout (L-RicKO) pe o dietă bogată în grăsimi timp de 25 de săptămâni.
Ambele complexe mTOR joacă un rol în adipogeneză
S-a apreciat de ceva timp că mTORC1 joacă un rol în adipogeneză. Experimentele culturii țesuturilor începând din 2001 au arătat că inhibarea semnalizării mTORC1 genetic sau cu rapamicină afectează adipogeneza, în timp ce creșterea semnalizării mTORC1 de către ARNsi împotriva TSC1/2 promovează adipogeneza. Ștergerea TSC2 promovează, de asemenea, diferențierea adipocitelor (Zhang și colab., 2009). Acest efect este mediat parțial de 4E-BP1 prin reglarea traducerii PPARγ, dar experimentele in vivo au indicat, de asemenea, un rol important pentru S6K. Șoarecii knockout S6K1 prezintă rezistență la creșterea în greutate pe o dietă bogată în grăsimi datorită generării afectate de adipocite (Carnevalli și colab., 2010). Șoareci cu o ștergere specifică adipoză a Raptorului, care este necesară pentru activitatea mTORC1, fenocopie a șoarecilor knockout S6K1 (Polak și colab., 2008). Sunt mai ușoare, slabe și rezistente la creșterea în greutate pe o dietă bogată în grăsimi. Mai mult, adipocitele lor sunt atât mai mici, cât și mai puțin numeroase. Acest lucru a fost adevărat, chiar dacă expresia raptorului s-a pierdut doar în adipocitele mature. În cele din urmă, așa cum s-a discutat în secțiunea următoare, mTORC1 poate regla, de asemenea, adipogeneza parțial prin reglarea proteinelor de legare a elementelor de reglare a sterolului (SREBP).
Deși s-a presupus inițial că mTORC2 a jucat și un rol în adipogeneză, deoarece este în amonte de Akt, studiile inițiale ale șoarecilor knockout Rictor specifici adipos nu au observat defecte în adipogeneză (Cybulski și colab., 2009; Kumar și colab., 2010) . Cu toate acestea, Yao și colegii au descoperit recent un rol pentru mTORC2 în adipogeneză (Yao și colab., 2013). Au descoperit că fosforilarea Akt S473 de către mTORC2 a fost dependentă de interacțiunea Akt cu BTSA fosforilată (o proteină care conține un domeniu BSD). Mai mult, au descoperit că BSTA este un substrat direct al mTORC2, iar fosforilarea BSTA promovează interacțiunea cu Akt, ducând la fosforilarea sa ulterioară la S473. Celulele stem embrionare lipsite de BSTA au fosforilare Akt S473 defectă și nu sunt capabile să se diferențieze în adipocite. Yao și colab. a descoperit că acest lucru se datorează inducerii factorului de transcripție FoxC2, care inhibă adipogeneza albă în timp ce potențează adipogeneza maro. Combinația acestor studii sugerează că mTORC2 poate fi esențială pentru adipogeneza precoce, dar nu afectează adipogeneza atunci când este excizată în adipocite mature.
Proteina care interacționează cu mTOR (DEPTOR) care conține domeniul DEP interacționează atât cu mTORC1, cât și cu mTORC2 (Peterson și colab., 2009). DEPTOR face parte dintr-un locus caracteristic cantitativ legat de obezitate la șoareci și s-a observat recent că supraexprimarea DEPTOR duce la acumularea de țesut adipos alb (Laplante și colab., 2012). Exprimarea crescută a DEPTOR stimulează adipogeneza in vitro, parțial prin activarea PPARγ (Laplante și colab., 2012). Expresia DEPTOR ameliorează, de asemenea, efectul negativ al mTORC1 asupra semnalizării insulinei, activând funcțiile adipogene ale Akt. Expresia DEPTOR este semnificativ crescută în țesutul adipos al oamenilor obezi, sugerând că acest mecanism poate fi conservat de la șoarece la om (Laplante și colab., 2012).
MTORC1 hepatic reglează ketogeneza și lipogeneza
Se știe de mult că, în timpul postului, corpurile cetonice sunt produse în ficat ca sursă de energie pentru țesuturile periferice, inclusiv creierul. În timp ce studiați șoareci cu o ștergere specifică ficatului de TSC1, rezultând activarea constitutivă a mTORC1, Sengupta și colab. a observat ketogeneza defectă la post. După un post de 24 de ore, acești șoareci au avut mai puțin de jumătate din nivelul cetonelor serice totale ale șoarecilor martor (Sengupta și colab., 2010). Ficatele șoarecilor în vârstă au în mod similar o activitate mTORC1 crescută și un defect al cetogenezei, care poate fi corectat prin ștergerea Raptorului hepatic (Sengupta și colab., 2010). În timp ce mecanismul a fost evaziv, au descoperit că mTORC1 reglează activitatea PPARα și expresia genelor prin promovarea localizării nucleare a NCoR1, un corepresor care interacționează cu PPARα. Kim și colab. a stabilit recent că S6K2, un efector al mTORC1 care este foarte omolog cu S6K1, reglementează localizarea nucleară a NCoR1 (Kim și colab., 2012).
În 2008, Portsmann și colegii au fost primii care au identificat un rol pentru mTORC1 în lipogeneză, constatând că rapamicina blochează expresia genelor implicate în lipogeneză și afectează acumularea nucleară a proteinelor de legare a elementelor de reglare a sterolului (SREBP) (Porstmann și colab. al., 2008). Lucrările ulterioare efectuate de Düvel și colegii săi au identificat elementul de reglare a sterolului drept cel mai puternic motiv de ADN într-un studiu de expresie genetică a genelor sensibile la rapamicină (Duvel și colab., 2010). Deși mecanismul exact prin care SREBP1 și SREBP2 sunt reglementate de mTORC1 nu este clar, se crede că este mediat de S6K1 (Duvel și colab., 2010). Folosind un inhibitor de molecule mici de S6K, Owen et. au găsit că reglarea transcripțională a SREBP1c de către insulină nu depinde de S6K, în timp ce prelucrarea post-transcripțională a SREBP1c este dependentă de S6K (Owen și colab., 2012).
mTORC1 poate regla, de asemenea, rețeaua transcripțională SREBP prin reglarea negativă a lipinei1 (Peterson și colab., 2011). Lipin1 este un substrat mTORC1 cu multiple situri de fosforilare, incluzând atât situri sensibile la rapamicină, cât și site-uri fosforilate de mTORC1 care sunt relativ insensibile la rapamicină. Fosforilarea lipinei 1 de către mTORC1 reglează localizarea subcelulară a acesteia, lipina fosforilată rezidând în citoplasmă și lipina defosforilată1 acumulându-se în nucleu. Lipina1 nucleară reprimă transcrierea genei dependente de SREBP prin reducerea nivelurilor de proteine nucleare SREBP (Peterson și colab., 2011). În ciuda acestor progrese recente în înțelegerea modului în care mTORC1 reglează lipogeneza, mecanismele moleculare prin care S6K sau lipin1 reglează SREBP rămân necunoscute. De asemenea, trebuie subliniat faptul că semnalizarea mTORC1 este esențială, dar nu suficientă pentru a activa SREBP1c și sinteza lipidelor hepatice. Șoarecii cu o ștergere specifică ficatului de TSC1 prezintă activitate mTORC1 crescută, dar au activare SREBP1c și lipogeneză defectuoasă datorită atenuării semnalizării Akt (Yecies și colab., 2011). După cum sa discutat mai jos, semnalizarea prin mTORC2 este, de asemenea, esențială pentru lipogeneză.
mTORC2, un regulator nou identificat al homeostaziei lipidelor
În comparație cu mTORC1, se știe mult mai puțin despre substraturile și funcțiile mTORC2 așa cum a fost descoperit mai recent. Cele mai bine caracterizate substraturi ale mTORC2 sunt membri ai familiei AGC de kinaze, inclusiv Akt, SGK1 și PKCα. mTORC2 mediază activitatea Akt fosforilând direct Akt S473 ca răspuns la semnalizarea factorului de creștere și, de asemenea, fosforilează T450 co-translațional. Deoarece Akt reglează mTORC1 prin fosforilarea TSC2 și PRAS40, mTORC2 reglează indirect mTORC1 ca răspuns la semnalizarea factorului de creștere. mTORC2 este, de asemenea, necesar pentru fosforilarea siturilor de pe PKCα, precum și SGK1. Substraturile suplimentare ale mTORC2 pot include, de asemenea, PKCδ și sunt încă identificate folosind tehnici fosfoproteomice.
Reglarea Akt și SGK1 de către mTORC2 sugerează că mTORC2 poate juca un rol crucial în reglarea metabolismului. Datele de la C. elegans au susținut acest concept, deoarece viermii Rictor-null au un nivel ridicat de grăsime corporală, fie pe o dietă normală, fie bogată în grăsimi (Jones și colab., 2009; Soukas și colab., 2009). În timp ce mecanismul exact care stă la baza acestor efecte nu este clar, rapoartele ambelor laboratoare Ashrafi și Ruvkun sunt de acord că aceste efecte sunt cel puțin parțial dependente de SGK1 (Jones și colab., 2009; Soukas și colab., 2009).
Dovezile mamiferelor privind rolul mTORC2 în metabolism au apărut mai mult din cauza cerinței de mTORC2 în timpul dezvoltării. Mai mult, unele dintre primele modele de șoareci cu inactivare specifică țesutului a mTORC2, realizate prin utilizarea șoarecilor care exprimă o alelă condiționată a Rictor, au prezentat fenotipuri minime. Bentzinger și colegii săi au constatat că șoarecii lipsiți de mușchiul scheletal Rictor (M-RicKO) au avut activarea normală a Akt și fosforilarea normală a Akt T308, în ciuda scăderii fosforilării Akt S473 (Bentzinger și colab., 2008). Studiile ulterioare privind rolul mTORC2 în alte țesuturi sugerează că, deși mTORC2 poate fi prescris pentru activitatea Akt în mușchi, este necesar pentru activitatea Akt în ficat și țesutul adipos (Kumar și colab., 2008; Lamming și colab., 2012; Yuan și colab., 2012). În timp ce un rol in vivo pentru mTORC2 în mușchiul scheletic nu a fost identificat, datele in vitro sugerează că mTORC2 poate juca un rol în rezistența la insulină a mușchilor scheletici mediați de rapamicină (Ye și colab., 2012).
Adipos mTORC2 reglează lipoliza
Inactivarea specifică adipoză a mTORC2 a fost cercetată independent de două grupuri, cu concluzii în mare măsură similare. Ștergerea specifică adipoză a șoarecilor Rictor (A-RicKO) tendință către a fi ușor mai grele, cu o masă slabă semnificativ crescută (Cybulski și colab., 2009). La o dietă bogată în grăsimi, aceste tendințe sunt exagerate, ficatul șoarecilor knockout mTORC2-adipos cântărind cu 75% mai mult decât ficatul șoarecilor martor după 10 săptămâni la o dietă bogată în grăsimi (Cybulski și colab., 2009). Greutatea crescută a acestor ficati s-a datorat parțial creșterii semnificative a trigliceridelor hepatice în comparație cu șoarecii martor, cu o creștere concomitentă a steatozei hepatice.
În timp ce Cybulski și colegii săi au descoperit că șoarecii A-RicKO sunt toleranți la glucoză, Kumar și colegii au constatat că șoarecii mTORC2-adipos-knockout sunt destul de sever intoleranți la glucoză (Kumar și colab., 2010). Această aparentă discrepanță în constatări este ușor explicată de diferitele vârste ale șoarecilor, deoarece Kumar a examinat șoareci relativ vechi (cu vârsta mai mare de 9 luni). La această vârstă, șoarecii A-RicKO au prezentat atât rezistență la insulină atât a mușchiului adipos, cât și a scheletului, probabil datorită depunerii semnificative de lipide în mușchiul scheletic (Kumar și colab., 2010). Kumar și colegii săi au constatat, de asemenea, depunerea crescută a lipidelor hepatice și steatoza la ficatul de șoarece A-RicKO, tânăr și bătrân. Aceste rezultate sugerează că multe dintre consecințele metabolice ale perturbării mTORC2 în țesutul adipos sunt determinate de depunerea lipidelor în alte țesuturi.
Interesant este că Kumar și colegii săi au descoperit că mTORC2 reglează suprimarea lipolizei mediată de insulină în țesutul adipos. Lipoliza, descompunerea lipidelor în acizi grași liberi, ar trebui suprimată în mod normal, cu nutrienți mari, dar acest lucru nu se întâmplă la șoarecii A-RicKO (Kumar și colab., 2010). Mai mult, șoarecii A-RicKO au niveluri ridicate de FFA, indicând faptul că absența activității mTORC2 are ca rezultat niveluri bazale mai ridicate de lipoliză. În timp ce mecanismul nu a fost complet elaborat, mTORC2 poate regla în mod normal lipoliza prin inhibarea activării PKA. În absența mTORC2, PKA este activat și fosforilează lipaza sensibilă la hormoni, activându-și activitatea lipolitică (Kumar și colab., 2010). În cele din urmă, mTORC2 poate promova, de asemenea, absorbția de glucoză în țesutul adipos, deoarece șoarecii mTORC2-adipos-knockout au scăzut absorbția de glucoză (Kumar și colab., 2010). Cu toate acestea, acest lucru va necesita studii suplimentare, deoarece șoarecii adulți la care Rictor a fost epuizat în tot corpul prezintă o absorbție crescută a glucozei în țesutul adipos epuizat de Rictor (Lamming și colab., 2012).
MTORC2 hepatic reglează lipogeneza
În ultimul an, au fost învățate câteva lecții interesante despre rolul mTORC2 în țesutul hepatic, prin utilizarea șoarecilor cu o deleție specifică a ficatului de Rictor (L-RicKO). Unul dintre cele mai proeminente fenotipuri ale acestor șoareci este rezistența la insulină hepatică care duce la creșterea gluconeogenezei (Lamming și colab., 2012). Cu toate acestea, în timp ce rezistența la insulină hepatică este adesea asociată cu ficatul gras, șoarecii L-RicKO sunt de fapt protejați împotriva ficatului gras indus de o dietă bogată în grăsimi (Hagiwara și colab., 2012; Yuan și colab., 2012). Hagiwara și colegii săi au observat că, în plus față de creșterea gluconeogenezei, hepatocitele de la șoarecii L-RicKO au scăzut absorbția glucozei, probabil ca urmare a scăderii expresiei glucokinazei. Mai mult, șoarecii L-RiKO au niveluri scăzute de trigliceride, iar Hagiwara și colegii săi, precum și Yuan și colegii săi, au teorizat că mTORC2 este necesar pentru lipogeneza hepatică.
Într-adevăr, ambele grupuri au descoperit că lipogeneza hepatică stimulată de insulină a fost afectată semnificativ la șoarecii L-RicKO. În absența mTORC2, expresia hepatică a multor gene cheie de sinteză a lipidelor, inclusiv acetil CoA-carboxilaza și acidul gras sintaza, a fost redusă cu 50% sau mai mult (Hagiwara și colab., 2012; Yuan și colab., 2012). Șoarecii L-RicKO au, de asemenea, o expresie hepatică scăzută a SREBP1c și PPARγ. Interesant este că șoarecii L-RicKO au, de asemenea, o expresie crescută a genelor legate de oxidarea acizilor grași, inclusiv PPARα și o scădere a expresiei genelor de absorbție a acidului gras. Lipsa lipidelor hepatice la ficatul cu deficit de mTORC2 este, prin urmare, probabil datorită unei combinații de sinteză lipidică scăzută, absorbție scăzută a lipidelor și consum crescut de lipide.
Concluzii
mTOR este un regulator central al metabolismului lipidic, reglând nu numai lipogeneza și lipoliza, ci și adipogeneza. Cel mai recent, mTORC2 a apărut în special ca un controlor cheie al metabolismului lipidic, reglând lipogeneza în ficat, lipoliza în țesutul adipos alb și controlând adipogeneza. Aceste constatări sunt rezumate în Figura 1A. Din perspectivă clinică, dezvoltarea inhibitorilor specifici mTORC1 poate reduce semnificativ efectele secundare asociate acum cu rapamicina. Inhibarea specifică a mTORC2 are potențialul de a obține câștiguri reale în tratamentul obezității și a bolii hepatice grase nealcoolice (NAFLD). Așa cum se arată în Figura 1B, ștergerea Rictorului hepatic, rezultând în inhibarea semnalizării mTORC2, oferă o protecție dramatică împotriva ficatului gras indus de dieta bogată în grăsimi.
Din punct de vedere clinic, inhibarea mTORC2 hepatică poate favoriza metabolismul excesului de lipide hepatice, în timp ce inhibarea mTORC2 în timpul diferențierii adipocitelor ar putea favoriza câștigul țesutului adipos brun. Ambele proprietăți ar putea fi avantajoase din punct de vedere al tratamentului obezității. Cu toate acestea, efectele secundare ale inhibiției mTORC2, inclusiv rezistența la insulină hepatică, care pot explica o incidență crescută a diabetului nou debut la pacienții tratați cu rapamicină, sugerează că inhibarea directă a mTORC2 va fi nedorită. Identificarea mecanismelor finale în aval de mTORC2 care reglează metabolismul lipidelor și generarea de noi compuși care afectează în mod direct aceste mecanisme fără a perturba homeostazia glucozei, vor fi vitale pentru a transpune în siguranță aceste descoperiri în clinică.
Mulțumiri
Dorim să mulțumim lui Liron Bar-Peled, Joseph Baur și Mathieu Laplante pentru lectura critică a manuscrisului, Tom DiCesare pentru ajutorul de proiectare grafică și tuturor membrilor laboratorului Sabatini pentru sprijinul acordat. DWL este susținut de un premiu K99/R00 de la NIH/NIA (> AG041765). DMS este investigator al Institutului Medical Howard Hughes.
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Anne Hathaway a câștigat în greutate pentru un rol, pentru o singură dată, dar adaugă, sunt prudent în lauda mea
- Variații anuale în apărarea antioxidantă hepatică și peroxidarea lipidelor la un pește temperat,
- Anne Hathaway a fost subtil spus să slăbească pentru un rol la vârsta de 16 ani - E! Pe net
- Antonia Campbell-Hughes a avertizat înfometarea pentru că rolul filmului te poate ucide - Daily Star
- 10 sfaturi pentru a evita sabotarea de vară a dietei, exercițiu West Central Tribune