De la IFR31-Institutul Louis Bugnard; Spitalul Rangueil, Institutul Național al Sfântului și al Cercetării Medicale (Inserm), Inserm U586; Unitatea de Cercetare a Obezității; BP 84 225; 31432 Toulouse cedex 4; și Universitatea Paulit Sabatier, 31052 Toulouse cedex 4, Franța.
De la IFR31-Institutul Louis Bugnard; Spitalul Rangueil, Institutul Național al Santei și al Cercetării Medicale (Inserm), Inserm U586; Unitatea de Cercetare a Obezității; BP 84 225; 31432 Toulouse cedex 4; și Universitatea Paulit Sabatier, 31052 Toulouse cedex 4, Franța.
De la IFR31-Institutul Louis Bugnard; Spitalul Rangueil, Institutul Național al Santei și al Cercetării Medicale (Inserm), Inserm U586; Unitatea de Cercetare a Obezității; BP 84 225; 31432 Toulouse cedex 4; și Universitatea Paulit Sabatier, 31052 Toulouse cedex 4, Franța.
De la IFR31-Institutul Louis Bugnard; Spitalul Rangueil, Institutul Național al Sfântului și al Cercetării Medicale (Inserm), Inserm U586; Unitatea de Cercetare a Obezității; BP 84 225; 31432 Toulouse cedex 4; și Universitatea Paulit Sabatier, 31052 Toulouse cedex 4, Franța.
De la IFR31-Institutul Louis Bugnard; Spitalul Rangueil, Institutul Național al Sfântului și al Cercetării Medicale (Inserm), Inserm U586; Unitatea de Cercetare a Obezității; BP 84 225; 31432 Toulouse cedex 4; și Universitatea Paulit Sabatier, 31052 Toulouse cedex 4, Franța.
De la IFR31-Institutul Louis Bugnard; Spitalul Rangueil, Institutul Național al Sfântului și al Cercetării Medicale (Inserm), Inserm U586; Unitatea de Cercetare a Obezității; BP 84 225; 31432 Toulouse cedex 4; și Universitatea Paulit Sabatier, 31052 Toulouse cedex 4, Franța.
Vizualizați cea mai recentă versiune a acestui articol. Versiunile anterioare:
Abstract
Peptidele natriuretice (NP) sunt factori noi care pot deschide căi promițătoare de cercetare pentru a explica controlul mobilizării lipidelor în condiții fiziologice și patologice. Impactul metabolic al producției și circulației alterate a NP rămâne de stabilit. Influența potențială a NP asupra dezvoltării tulburărilor lipidice, a evenimentelor cardiovasculare legate de obezitate și a cașexiei cardiace va fi discutată în această revizuire.
Obezitatea, NEFA și patogeneza diabetului zaharat de tip 2
Modelul de distribuție a grăsimilor este, de asemenea, o variabilă importantă pentru metabolismul NEFA al întregului corp și sensibilitatea la insulină. Persoanele cu corp superior și acumulare de grăsime viscerală prezintă un risc mai mare de a dezvolta hiperinsulinemie, rezistență la insulină, dislipidemie și diabet de tip 2. 20,21 S-a emis ipoteza că lipoliza AT viscerală eliberează NEFA în exces în vena portă, expunând ficatul la concentrații mai mari de NEFA. 22 Contribuția lipolizei țesutului adipos visceral la livrarea hepatică de NEFA crește odată cu extinderea grăsimii viscerale la om, iar acest efect este mai mare la femei decât la bărbați. 23 Cu toate acestea, reprezintă un procent foarte mic din totalul NEFA administrat mușchilor scheletici. 24 Având în vedere rolul patogen major atribuit dereglării NEFA, mecanismele care influențează eliberarea NEFA de către celulele adipoase și căile majore care controlează sistemul lipolitic vor fi revizuite pe scurt.
Căile lipolitice și reglarea mobilizării lipidelor la oameni
Catecolamine și receptorii adrenergici ai celulelor grase
Controlul adrenergic al lipolizei celulelor grase umane este complex din cauza heterogenității distribuției α2-/β1/2-AR în diferite depozite de grăsime. 21 O serie de studii in vitro au stabilit în mod clar că repertoriul și nivelul de expresie al receptorilor adrenergici adipocitari umani diferă foarte mult în funcție de locația anatomică și de amploarea depozitelor AT, de mărimea adipocitelor, de sexul și vârsta subiecților, și determinanți genetici. Mai mult, rezistența lipolitică la catecolamine a fost demonstrată la AT subcutanat uman, principalul depozit de grăsime la subiecții obezi. În schimb, celulele adipoase din depozitele viscerale prezintă cea mai mare reacție β-adrenergică. Lipoliza indusă de adrenalină a fost raportată la AT la subiecții obezi. Diferențele în răspunsul lipolitic la catecolamine la obezi comparativ cu subiecții slabi sunt asociate cu variații ale expresiei HSL și echilibrul funcțional între β- și α2-AR. Alte perturbații ale căilor de transducție a semnalului catecolaminelor ar putea explica, de asemenea, defecte lipolitice (vezi recenziile 39.40).
Insulina: un agent antilipolitic major
Insulina joacă un rol important în controlul eliberării NEFA. Insulina este un regulator major al lipolizei. Inhibă lipoliza și efluxul de NEFA și stimulează absorbția glucozei de către celulele grase și depozitarea grăsimilor (adică crește rata de resinteză a TAG de la NEFA; efectul de reesterificare). Aprovizionarea cu NEFA din AT către alte țesuturi este rapid și puternic inhibată de o creștere a concentrației plasmatice de insulină. Mecanismele celulare implicate în inhibarea lipolizei de către insulină au fost delimitate. 41.42 Inhibiția lipolizei dependentă de insulină funcționează prin stimularea nucleotidelor ciclice fosfodiesterază-3B (PDE-3B) care promovează hidroliza AMPc ducând la reducerea nivelurilor de AMPc intracelulare și inhibarea lipolizei (Figura 1).
În situația postprandială sau când insulina este perfuzată intravenos folosind tehnica de clamp hiperinsulinemic euglicemiant, lipoliza este suprimată rapid și izbitor. Reducerea nivelului de insulină plasmatică, fie în timpul postului, exercițiului fizic, fie chiar după administrarea acută de somatostatină, duce la o creștere dramatică a ratei lipolitice. S-a demonstrat că o serie de factori circulanți (cum ar fi TNF-α, IL, insulina însăși, NEFA și produse de glicație) influențează acțiunea insulinei la nivelul celulei țintă și ar putea duce la hiperglicemie și diabet de tip 2 atunci când acțiunea lor este modificată. 43
Pare rezonabil să propunem că binecunoscutele tulburări metabolice legate de obezitatea corpului superior pot fi legate de variațiile regionale în reglarea lipolizei și producția de NEFA de insulină. Este clar că modificările moderate ale nivelurilor de insulină la jeun sau ale sensibilității la insulină vor modifica lipoliza celulelor grase și concentrațiile plasmatice de NEFA în jeun. S-au constatat diferențe izbitoare legate de depozitul adipos, modulate de obezitate, în sensibilitatea celulelor adipoase la insulină. Suprimarea lipolizei indusă de insulină și activarea re-esterificării NEFA sunt tocite în omental în comparație cu celulele adipoase subcutanate. 44 Au fost identificate diferite diferențe funcționale la nivelul receptorului de insulină și la nivelul post-receptor al cascadei de semnalizare a insulinei. 45 Alți parteneri ai cascadei de semnalizare a insulinei, cum ar fi PDE-3B și protein-tirozin fosfatazele (PTPază) implicate în defosforilarea receptorului de insulină, ar putea contribui, de asemenea, la modularea acțiunii insulinei. Activitatea endogenă a PTPazei, inclusiv a PTPazei-1B, este crescută în țesutul adipos omental și poate contribui la rezistența relativă la insulină a acestui depozit de grăsimi. 46
Au fost raportate creșteri ale fluxului sistemic NEFA de bază la femeile obeze ale corpului superior. Ele au fost parțial atribuite unei sensibilități scăzute la efectul antilipolitic al insulinei, independent de mărimea celulelor grase și la rate crescute lipolitice asociate cu hipertrofia celulelor adipoase subcutanate. 47 Adipocitele abdominale subcutanate sunt mai rezistente la efectul antilipolitic al insulinei decât adipocitele gluteale, independent de mărimea celulei. 48 Rezultatele in vivo au confirmat eterogenitatea regională a eliberării in vivo a NEFA insulinoreglate. Țesutul adipos visceral este mai rezistent la efectele antilipolitice ale insulinei decât este grăsimea corporală a picioarelor și nonplanchnice. 49 Cu toate acestea, grăsimea viscerală poate fi un marker pentru, dar nu sursa, de NEFA postprandiale în exces în obezitate, deoarece eliberarea crescută de NEFA postprandială observată la femeile obeze din corpul superior și diabeticii de tip 2 provine din grăsimea nonplanchnică a corpului superior, nu din grăsimea viscerală. 50
Peptidele natriuretice contribuie la controlul lipolizei și la mobilizarea lipidelor la oameni
Peptide natriuretice
Receptoare de peptide natriuretice
NPR-A au fost identificate și în celulele adipoase de șobolan. 78,79 O creștere slabă a cGMP stimulată de ANP a fost raportată la celulele adipoase de șobolan. 80 Țesutul adipos uman exprimă ARN mesager NPR-A și NPR-C. 81 Nu au fost investigate răspunsuri biologice în celulele adipoase umane când au fost inițiate primele noastre studii. Funcția receptorului NPR-C nu a fost niciodată explorată în celulele adipoase.
Efectul lipolitic al peptidelor natriuretice
Constatarea inițială care a fost impulsul pentru studii ulterioare asupra rolului metabolic al NP-urilor a fost descoperirea acțiunii lipolitice a NP-urilor în celulele grase izolate umane. PN-urile exercită efecte lipolitice puternice similare cu cele induse de agonistul β-AR, izoproterenolul. Ordinea relativă a potenței lipolitice a peptidelor (ANP> BNP≫CNP) a sugerat prezența unui receptor NPR-A în celulele grase umane. Acest punct a fost confirmat prin studii de legare efectuate pe membranele celulelor grase umane folosind [125 I] ANP ca radioligand și diferiți concurenți peptidici. 3
Important, s-a observat că efectul lipolitic al NP-urilor este complet independent de hormonul antilipolitic major, insulina. Insulina este bine cunoscută pentru efectele sale antilipolitice asupra celulelor adipoase umane, ceea ce duce la inhibarea lipolizei induse de β-AR (adică, izoproterenol) și catecolamină. Tratamentul cu insulină al celulelor adipoase umane nu are niciun efect asupra răspunsului lipolitic indus de ANP. 3,82,87 Deoarece efectele antilipolitice ale insulinei sunt mediate de reducerea nivelurilor de AMPc intracelulare inițiate prin activarea PDE-3B, este de înțeles de ce acest hormon nu interferează cu efectele NP dependente de cGMP. Delimitarea mecanismelor implicate în reglarea descendentă a acțiunii NP merită atenție. Stimularea cronică cu NP și condițiile patologice asociate cu supraproducția NP ar putea limita capacitatea de reacție a celulelor grase prin desensibilizarea activității NPR-A. Desensibilizarea omologă a căii dependente de ANP, după expunerea prealabilă a celulelor adipoase la ANP, a fost demonstrată în celulele grase izolate in vitro. 87
Apariția lipolizei indusă de NP este specifică celulelor grase primate. PN nu stimulează lipoliza în celulele adipoase ale altor specii, inclusiv șobolani, șoareci, iepure și câini. ANP a crescut producția bazală de cGMP de 300 de ori în celulele adipoase umane, în timp ce a fost stimulată doar de 3 ori în adipocitele de șobolan. Una dintre explicațiile majore ale diferențelor izbitoare legate de speciile în ceea ce privește capacitatea de reacție a celulelor grase la NP este că adipocitele din speciile care nu răspund la NP prezintă în principal clearance-ul membranei plasmatice NPR-C și o expresie foarte scăzută a NPR-A biologic activ. Stimularea populației mici de NPR-A pe aceste celule nu este suficientă pentru a promova creșterea nivelurilor de cGMP necesare pentru a atinge punctul de setare pentru activarea HSL. 88 Faptul că numai primatele posedă această nouă cale lipolitică este demn de remarcat. Cu toate acestea, lipsa modelelor animale nu va facilita studiile viitoare cu privire la rolul și reglementarea acestui sistem.
Inducerea mobilizării lipidelor prin administrarea locală sau sistemică a ANP
Acțiunea lipolitică demonstrată in celule grase subcutanate umane izolate in vitro a fost confirmată in vivo cu administrarea de ANP într-o sondă de microdializă implantată în AT abdominal subcutanat uman (SCAAT). Microdializa in situ oferă mai multe oportunități de investigație clinică a efectelor vasculare și metabolice inițiate în AT subcutanat prin administrarea locală sau sistemică de medicamente sau exerciții fizice. 89 Infuzia de ANP în sonda de microdializă a crescut concentrația extracelulară de glicerol în AT și a vasodilatat vasele care drenează depozitul de grăsime. 3 Ambele evenimente contribuie la îmbunătățirea coordonată a mobilizării lipidelor în SCAAT.
Contribuția ANP la controlul fiziologic al mobilizării lipidelor la oameni
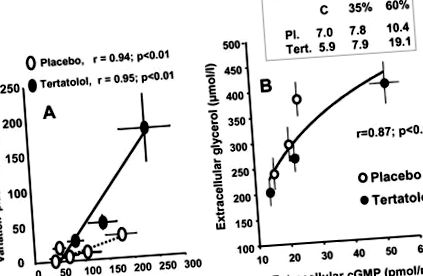
Figura 2. Comparația modificărilor medii ale concentrațiilor extracelulare de glicerol în țesutul adipos subcutanat abdominal în timpul a 2 perioade de exerciții cu succes efectuate la 35% (exercițiul 1) și 60% (exercițiul 2) din V o max și în timpul recuperării. A, Efectul blocării receptorilor β-adrenergici locali: Sonda de control pentru microdializă a fost perfuzată cu tampon Krebs-Ringer. Pentru studiul blocării receptorilor β-adrenergici locali, o sondă de microdializă a fost suplimentată cu propranolol (100 μmol/L). Propranololul a blocat parțial creșterea EGC indusă de efort. Răspunsul β-adrenergic al celulelor adipoase a fost complet blocat. 95 B, Efectul blocării receptorului β-adrenergic oral cu tertatolol: Sonda de control (placebo) de microdializă a fost perfuzată cu tampon Krebs-Ringer. Tertatolol (5 mg) a fost administrat cu 1 oră înainte de efort. Tratamentul cu tertatolol nu are niciun efect asupra creșterii EGC induse de efort. S-a verificat că reacția β-adrenergică a adipocitelor a fost complet blocată. 95
Figura 3. Comparația modificărilor medii ale nivelurilor plasmatice de ANP și cGMP, precum și ale concentrației de glicerol extracelular (EGC) și cGMP în timpul a 2 perioade de exerciții cu succes efectuate la 35% (exercițiul 1) și 60% (exercițiul 2) de V o max în placebo și tertatolol (antagonist al receptorilor β-adrenergici) pacienți tratați. 95 A, Corelația dintre concentrațiile plasmatice de ANP și creșterea concentrației de glicerol extracelular în sondele perfuzate cu propranolol la subiecții tratați cu placebo și tertalolol. Valorile ANP și EGC au fost determinate la minutele 10 și 20 ale fiecărui atac. B, corelație între EGC și concentrațiile extracelulare de cGMP. Concentrațiile plasmatice de cGMP, EGC și extracelulare de cGMP au fost determinate în repaus și în timpul fiecărui atac.
Întrebări fiziologice și tendințe viitoare
Înainte de a adăuga un nou agent lipolitic la lista hormonilor de mobilizare a lipidelor dovedite, este necesar să se determine dacă concentrația circulantă sau locală (adică la nivel de adipocite) a agentului lipolitic este capabilă să inițieze mobilizarea lipidelor in vivo în timpul unei lipide. provocare mobilizatoare. Rezultatele ANP se potrivesc cu această regulă, deși lipsa unui antagonist NPR-A adecvat limitează interpretarea. Investigațiile privind rolul ANP care utilizează microdializa au fost efectuate în SCAAT din motive practice legate de utilizarea tehnicii de microdializă. Acțiunea ANP asupra altor depozite de grăsime trebuie extinsă în viitorul apropiat pentru a verifica dacă sensibilitatea celulelor adipoase la ANP/BNP diferă în funcție de locația anatomică a depozitului de grăsime, așa cum sa raportat pentru alte căi de reglementare. 21
Figura 4. Domenii funcționale ale sistemului receptorilor dependenți de ANP în celula grasă umană. KHD indică domeniul de reglare intracelular al kinazei-omologie; GC, domeniu catalitic guanilil ciclază. Neprilysin (endopeptidază neutră 24.11, CD10, NEP) care este implicată în degradarea peptidelor natriuretice, a fost identificată în membrana celulelor grase umane (C.M., M.B., M.L., rezultate nepublicate, 2005).
Un studiu epidemiologic pe cohorta descendenților studiului Framingham Heart Study a arătat că nivelurile plasmatice de ANP și BNP sunt reduse la subiecții obezi. În plus, nivelurile reduse de BNP apar la persoanele obeze cu insuficiență cardiacă. 106 Apariția unei distribuții modificate a distribuției NPR-A/-C a celulelor grase și a unei reacții modificate a NP a fost propusă la obezi. 107.108 Aceste studii epidemiologice trebuie să fie urmate de explorări funcționale pentru a delimita mecanismele care duc la alterarea căilor NP.
Întrebări patologice și tendințe viitoare
Tratamentul antagonist β-AR
Diabetul de tip 2
Majoritatea pacienților cu diabet de tip 2 sunt supraponderali sau obezi. 113 Se confruntă cu creșteri pe tot parcursul zilei ale concentrației plasmatice de NEFA care scapă la supresia normală prin mese sau încărcarea glucozei. 114 Deoarece NEFA-urile cu circulație crescută pot provoca/agrava rezistența la insulină în mușchi și ficat 16 și pot crește riscul de moarte subită, 19 este important să știm dacă NP-urile, pe lângă rezistența la insulină, acționează ca parteneri în tulburările legate de sindromul metabolic. Există controverse cu privire la nivelurile plasmatice de ANP/BNP la pacienții diabetici. 105
Insuficiență cardiacă congestivă și cașexie cardiacă
Desensibilizarea omologă a efectelor dependente de ANP asupra lipolizei și mobilizării lipidelor are loc consecutiv la expunerea acută la ANP. 87 Ținând cont de excesul de eliberare de NP observat în insuficiența cardiacă congestivă, corpul se poate acomoda cu niveluri crescute de BNP endogen prin reglarea descendentă a căilor de semnalizare NP în țesutul adipos. Mai mult, nu poate fi exclusă o reglare ascendentă a căilor de compensare (de exemplu, expresie NPR-C de clearance mai mare sau activitate sporită a NEP).
Tratamente farmacologice
Medicamentele care interferează cu sistemul peptidergic natriuretic (de exemplu, agoniști NPR-A și inhibitori ai NEP 24.11) ar putea provoca modificări metabolice. BNP (Nesiritide) a fost acum aprobat pentru tratarea insuficienței cardiace acute, deoarece are efecte benefice asupra hemodinamicii centrale și a excreției urinare de Na +. 112,120–122 Comparativ cu ANP, BNP pare a fi mai puțin susceptibil la degradare de către NEP 24.11 și ar putea fi un agent natriuretic mai puternic decât ANP. 65 Va fi esențial să se verifice dacă perfuzia de BNP promovează, cum ar fi administrarea intravenoasă de ANP, 4,91 un efect puternic și susținut de mobilizare a lipidelor și crește nivelurile plasmatice de NEFA, care ar putea altera funcția cardiacă și pot contracara unele acțiuni benefice ale compusului la alte țesuturi. Aceasta este încă o întrebare importantă și deschisă și, prin urmare, toate medicamentele despre care se știe că activează căile dependente de NPR-A/-B ar trebui evaluate pentru efectele lor metabolice secundare.
Concluzii
- Anne Hathaway a fost descurajată să slăbească pentru rolul Les Mis CTV News
- Antonia Campbell-Hughes De ce mor de foame pentru acest rol London Evening Standard
- O revizuire a efectelor metabolice ale fenterminei topiramat cu eliberare controlată - PubMed
- Sistemul imunitar al creierului poate juca un rol în creșterea în greutate Știri științifice pentru studenți
- Cumpărați complex metabolic - 60 capsule - Botanic Choice