Abstract
fundal
La pacienții cu boală renală polichistică autosomală dominantă (ADPKD), malnutriția se poate dezvolta pe măsură ce funcția renală scade și organele abdominale se măresc. Am investigat relația masei intraabdominale cu starea nutrițională.
Metode
Acest studiu transversal a fost efectuat la un ambulatoriu de spital terțiar. Au fost colectate date antropometrice și de laborator, inclusiv creatinină serică, albumină și colesterol, iar volumele de rinichi și ficat au fost măsurate. Volumul total de rinichi și ficat a fost definit ca suma volumelor de rinichi și ficat și ajustat în funcție de înălțime (htTKLV). Starea nutrițională a fost evaluată utilizând evaluarea subiectivă globală modificată (SGA).
Rezultate
Într-un total de 288 pacienți (47,9% femei), vârsta medie a fost de 48,3 ± 12,2 ani, iar rata medie de filtrare glomerulară (eGFR) a fost de 65,3 ± 25,3 ml/min/1,73 m 2. Dintre acești pacienți, 21 (7,3%) au fost ușor până la moderat subnutriți (scor SGA de 4 și 5) și 63 (21,7%) au prezentat un risc de malnutriție (scor SGA de 6). În general, pacienții cu sau cu risc de malnutriție erau mai în vârstă, aveau un indice de masă corporală mai scăzut, niveluri mai scăzute de hemoglobină și o funcție renală mai slabă comparativ cu grupul bine hrănit. Cu toate acestea, diferențele semnificative statistic în acești parametri nu au fost observate la pacienții de sex feminin, cu excepția eGFR. În schimb, un htTKLV mai mare s-a corelat cu un scor SGA mai mic, chiar și la subiecții cu un eGFR ≥45 ml/min/1,73 m 2. Subiecții cu un htTKLV ≥2340 ml/m au prezentat un risc de 8,7 ori mai mare de malnutriție, după ajustarea în funcție de vârstă, hemoglobină și eGFR.
Concluzii
Riscul nutrițional a fost detectat la 30% dintre pacienții ambulatori ADPKD cu funcție renală relativ bună. Organomegalia intraabdominală a fost legată de starea nutrițională independent de deteriorarea funcției renale.
fundal
Malnutriția crește mortalitatea, morbiditatea și durata șederii în spital în diferite situații clinice, incluzând condițiile de internare în general, precum și la pacienții cu insuficiență hepatică și cancer [1]. În bolile renale cronice (CKD), prevalența malnutriției crește la 30-40% dintre pacienți, iar malnutriția proteică-energetică este unul dintre cei mai puternici predictori ai morbidității și mortalității [2, 3]. În studiile anterioare, markerii nutriționali precum albumina serică, creatinina, indicele de masă corporală (IMC) și evaluarea subiectivă globală (SGA) au fost predictori independenți ai decesului și eșecului tratamentului în BCR [4, 5]. Starea nutrițională înainte de transplant influențează, de asemenea, rezultatele transplanturilor de rinichi [6]. Prin urmare, s-au depus eforturi pentru a stabili linii directoare pentru evaluarea adecvată a stării nutriționale a pacienților cu BCR și pentru a interveni în vederea îmbunătățirii rezultatelor acestora [7]. Cu toate acestea, valoarea markerilor nutriționali în stadiul incipient al BCR nu a fost evaluată meticulos la pacienții cu stadii incipiente ale BCR.
Boala renală polichistică autosomală dominantă (ADPKD) este cea mai frecventă boală renală ereditară și poate evolua către boala renală în stadiul final (ESRD) pe măsură ce chisturile renale cresc. Prevalența chisturilor hepatice la pacienții cu ADPKD a fost de 58% la pacienții cu vârste cuprinse între 15 și 24 de ani și până la 94% dintre pacienții cu vârsta peste 35 de ani [8]. Multe complicații incontenabile se pot dezvolta pe măsură ce chisturile cresc și provoacă organomegalie masivă. Din studiul anterior, efectul de masă datorat organomegaliei a fost raportat că provoacă simptome legate de presiune (46,5%), durere (58,8%), simptome gastro-intestinale (32,4%) și complicații obstructive care pot duce la edem la picioare (20,4%), ascită%) și infecție (3,1%) [9]. La acești pacienți, efectele asupra presiunii provenite de la organele mărite pot duce, de asemenea, la un aport oral slab și, eventual, la malnutriție. Ocazional, organomegalia masivă necesită intervenții de reducere a volumului pentru ameliorarea simptomelor și pentru îmbunătățirea calității vieții pacientului [10].
În ADPKD, efectele de masă din volumul crescut de rinichi și ficat pot agrava malnutriția, chiar și în stadiile incipiente ale bolii renale [11]. Prin urmare, evaluarea stării nutriționale chiar și în fazele incipiente ale ADPKD cu organomegalie semnificativă este recomandată pentru a asigura intervenții în timp util care au ca rezultat îmbunătățirea ulterioară a rezultatelor clinice ca la pacienții cu boală hepatică polichistică [11, 12]. Cu toate acestea, parametrii antropometrici tradiționali, cum ar fi greutatea corporală și IMC, au o valoare limitată datorită rinichilor și ficatului plini de lichid. În acest studiu, am evaluat starea nutrițională a pacienților ambulatori ADPKD folosind SGA ca metodă standard și am identificat volumul de organ intraabdominal ca factor de risc independent pentru malnutriție.
Metode
Populația de pacienți
Pacienții cu ADPKD care au vizitat clinica de boli renale polichistice din Spitalul Universitar Național Seoul din decembrie 2013 până în martie 2014 au fost incluși în acest studiu. Au fost incluși pacienții cu vârsta de 18 ani și peste care au fost de acord să participe la studiu. Scanarea tomografiei computerizate abdominale (CT) la pacienții cu ADPKD a fost efectuată la fiecare doi ani în scop clinic ca protocol standardizat de evaluare în timpul ambulatoriului [13]. Pacienții cu cancer activ, infecție activă, stadiul CKD 5 în momentul înscrierii, ESRD tratat cu terapie de substituție renală sau antecedente de terapii de reducere a volumului ficatului (embolizare transarterială, rezecție hepatică sau transplant) din cauza bolii hepatice polichistice severe au fost exclus. Dosarele medicale electronice au fost revizuite retrospectiv și au fost identificați 31 de pacienți care îndeplineau criteriile de excludere.
Deoarece acest studiu a fost unul transversal, folosind date clinice și nu a implicat intervenții invazive suplimentare, tratament sau costuri pentru pacienți, studiul a primit o scutire de consimțământ și a fost aprobat de Consiliul de revizuire instituțională al Spitalului Național Universitar din Seul ( H-1407-083-594). Dosarul pacientului a fost dezidentificat și analizat anonim. Acest studiu a fost realizat în conformitate cu Declarația de la Helsinki.
Evaluare globală subiectivă și colectare de date clinice
Scorul SGA este o metodă de evaluare nutrițională care a fost bine validată în diverse setări și se bazează pe istoricul clinic și examenul fizic. Evaluarea nutrițională a fost validată la pacienții cu BCR ca predictor al complicațiilor și al rezultatelor [10-13]. Pe baza acestor rezultate, SGA a fost recomandată în ghidurile inițiativei de calitate a rezultatelor bolilor renale ca instrument de evaluare nutrițională, în special pentru pacienții cu BCR [7]. SGA este frecvent utilizat ca metodă de referință pentru evaluarea noilor tehnici de evaluare nutrițională.
Măsurarea volumului rinichilor și ficatului
În clinica noastră de boli renale polichistice, au fost efectuate scanări CT abdominale la fiecare doi ani. O ultimă scanare CT abdominală la momentul evaluării nutriționale a fost utilizată pentru a măsura volumul total al ficatului (TLV) și volumul total al rinichilor (TKV). Intervalul mediu de timp între scanarea CT și evaluarea nutrițională a fost de 12,5 ± 12,6 luni. TLV a fost calculat prin adăugarea produsului cu grosimea feliei și suprafața măsurată pe un set de imagini adiacente generate de CT utilizând software-ul Rapidia 2.8 CT (INFINITT Healthcare Co. Ltd, Seoul, Coreea). TKV a fost estimat utilizând metoda elipsoidului [19]. TLV ajustat pe înălțime (htTLV, mL/m) și TKV ajustat pe înălțime (htTKV, mL/m) au fost utilizate în acest studiu. Volumul total de rinichi și ficat ajustat pe înălțime (htTKLV, mL/m) a fost definit ca suma valorilor htTLV și htTKV.
Analize statistice
Pentru analiza statistică între sexe, am folosit student t-test pentru variabilele cu o distribuție normală și testul Mann-Whitney utilizat pentru variabilele cu o distribuție non-normală (înălțime, greutate, proteină, albumină, htTLV, htTKV și htTKLV). Pentru scorurile SGA, toți pacienții au fost clasificați în trei grupuri: ușor până la moderat subnutriți (un scor SGA de 4-5), cu risc (un scor SGA de 6) și bine hrăniți (un scor SGA de 7), deoarece niciunul nu a avut Scor SGA mai mic de 4 [20]. Pentru analiza statistică, am folosit testul de asociere liniară sau testul Jonckheere-Terpstra pentru a analiza p-pentru tendință în rândul a trei grupuri SGA. P-valori
Rezultate
Caracteristicile de bază
Un total de 288 de pacienți au fost incluși în analiză, dintre care 138 (47,9%) au fost femei. Vârsta medie a fost de 48,3 ± 12,2 ani, fără nicio diferență semnificativă în funcție de sex. Scorurile medii SGA au fost similare (6,7 ± 0,6 vs. 6,6 ± 0,6, p = 0,197) între sexe. Valoarea medie a eGFR a fost de 65,3 ± 25,3 mL/min/1,73 m 2 și eGFR a fost mai mare la pacienții de sex feminin (62,3 ± 24,5 mL/min/1,73 m 2 față de 68,5 ± 25,8 mL/min/1,73 m 2, p = 0,035). Nu a existat nicio diferență semnificativă în nivelul albuminei între sexe. Distribuția etapelor CKD a fost după cum urmează: 52 de pacienți (18,1%) au fost în stadiul 1 CKD, 116 (40,3%) au fost în stadiul 2, 53 (18,4%) au fost în stadiul 3A, 46 (16,0%) au fost în stadiul 3B, iar 21 (7,3%) au fost în etapa 4. Distribuția CKD nu a arătat nicio diferență între sexe. Două sute treizeci și opt de pacienți (82,6%) aveau hipertensiune și 227 pacienți (78,8%) aveau chisturi hepatice. Bărbații au avut o prevalență mai mare a hipertensiunii arteriale (bărbați; 134 pacienți, 89,3% și femei; 104 pacienți, 75,4%, p = 0,002) și o prevalență mai mică a chisturilor hepatice. (bărbați; 101 pacienți, 67,3% și femei 126 pacienți, 91,3%, p Tabelul 1 Caracteristicile inițiale ale pacienților în funcție de starea nutrițională evaluată de SGA
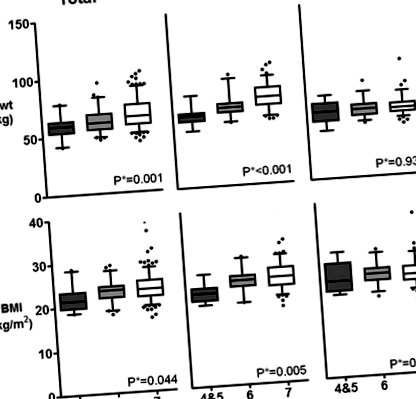
Pacienții cu malnutriție (SGA 4-5) sau cu risc de malnutriție (SGA 6) au fost mai în vârstă decât grupul bine hrănit (SGA 7) (vârsta medie, 53,4 ± 11,1 ani vs. 52,7 ± 12,6 ani vs. 46,4 ± 11,7 ani, respectiv, p pentru tendința 2 față de 23,3 ± 2,6 kg/m 2 față de 23,7 ± 2,9 kg/m 2, respectiv, p pentru tendința 0,044) tindeau să arate valori mai mici la pacienții cu scoruri SGA mai mici. Cu toate acestea, această tendință a fost observată numai la pacienții de sex masculin și niciunul dintre parametrii antropometrici nu a prezentat diferențe semnificative statistic la pacienții de sex feminin (Fig. 1).
Corelații între scorul SGA și parametrii nutriționali antropometrici. A greutatea corporală (Bwt) și b indicele de masă corporală (IMC). P*; p pentru trend, SGA; evaluare subiectivă globală, SGA 7, bine hrănită; SGA 6, la risc; SGA 5, ușor subnutrit; SGA 3-4, moderat subnutrit
În ceea ce privește parametrii de laborator, scăderea valorilor eGFR (51,3 ± 23,2 mL/min/1,73 m 2 față de 57,1 ± 24,9 mL/min/1,73 m 2 vs. 69,2 ± 24,6 mL/min/1,73 m 2, respectiv, p pentru tendință Fig. 2
Corelații între scorul SGA și următorii markeri de laborator. A rata estimată de filtrare glomerulară (eGFR), b hemoglobina (Hb), c albumina și d colesterol total (col total). P*; p pentru trend, SGA; evaluare subiectivă globală, SGA 7, bine hrănită; SGA 6, la risc; SGA 5, ușor subnutrit; SGA 3-4, moderat subnutrit
Hipertensiunea a arătat o prevalență mai mare în grupurile SGA mai mici (100, 87,3 și, respectiv, 79,4%, p pentru tendință = 0,011). Cu toate acestea, nu a existat nicio diferență statistică în prevalența chisturilor hepatice în rândul grupurilor SGA (p pentru tendință = 0,16) (Tabelul 1).
Când am comparat diferite date între scorul SGA de 4 și 5 (malnutriție) cu 6 și 7 (cu risc sau bine hrănite), s-au obținut rezultate similare (Fișier suplimentar 1: Tabel S2).
htTKLV a fost asociat cu SGA independent de eGFR
Scorurile SGA mai mici au corespuns valorilor mai mari ale htTKLV (mediană 2622 mL/m; IQR 1719-4906 mL/m vs. mediană 2147 mL/m; IQR 1535-2687 mL/m vs. mediană 1649 mL/m; IQR 1311 –2151 mL/m, respectiv, p pentru tendință Fig. 3
Corelații între scorul SGA și volumul abdominal. A volumul total de rinichi și ficat ajustat pe înălțime (htTKLV), b volumul total al rinichilor ajustat pe înălțime (htTKV) și c volumul total hepatic ajustat pe înălțime (htTLV); d corelație între scorul SGA și volumul abdominal la subiecții cu un eGFR ≥45 ml/min/1,73 m 2 . P*; p pentru trend, SGA; evaluare subiectivă globală, SGA 7, bine hrănită; SGA 6, la risc; SGA 5, ușor subnutrit; SGA 3-4, moderat subnutrit
Analiza curbei ROC a fost utilizată pentru a compara parametrii de volum pentru a identifica un prag predictiv al malnutriției (un SGA de 4-5) într-o stare de a fi bine hrăniți (un scor SGA de 7). Deoarece categoria 6 a scorului SGA poate fi ambiguă din cauza limitărilor SGA în sine, am construit curba ROC folosind datele scorului SGA 7 (normal) și 4-5 (malnutriție). Zona de sub curbă (ASC) a htTKLV a fost mai mare (0,727) decât cea a htTKV (0,687) și htTLV (0,645). Valoarea limită pentru htTKLV a fost de 2340 ml/m, cu o sensibilitate de 66,7% și o specificitate de 81,4% (Fig. 4). Prin comparație, într-o analiză a curbei ROC între o stare de risc sau subnutrită într-o stare bine hrănită (o SGA de 4-6 față de 7), s-au obținut rezultate similare, dar mai puțin semnificative (ASC ale htTKLV, htTKV și htTLV au fost 0,658, 0,646 și respectiv 0,571), iar valoarea limită pentru htTKLV a fost de 2190 ml/m, cu o sensibilitate de 53,6% și o specificitate de 76,5% (datele nu sunt prezentate).
Curba ROC a htTKLV, comparând scorurile SGA de 4 și 5 la 7. ROC; caracteristici de funcționare a receptorului, SGA; evaluare subiectivă globală, SGA 7, bine hrănită; SGA 6, la risc; SGA 5, ușor subnutrit; SGA 3-4, moderat subnutrit
Este bine cunoscut faptul că mărirea rinichilor este strâns legată de insuficiența renală la pacienții cu ADPKD [21]. Așa cum era de așteptat, eGFR a scăzut pe măsură ce scorul SGA a scăzut (Fig. 2), iar proporția pacienților cu scoruri SGA mai mici a crescut la pacienții noștri, pe măsură ce stadiile CKD au crescut de la 1 la 3 (Fig. 5). Când ne-am stratificat după stadiul de BCR, chiar și în stadiul 1 și 2 al BCR, 15,4 și 20,9% dintre pacienți erau fie subnutriți, fie cu risc de malnutriție, respectiv. Dintre pacienții în stadiul 3 și 4 cu BCR, 43,4 și 42,8% erau fie subnutriți, fie cu risc de malnutriție, respectiv. La pacienții cu BCR în stadiul 4, proporția pacienților cu un scor SGA mai scăzut a fost ușor mai mică decât în rândul pacienților cu BCR în stadiul 3B, care s-ar fi putut datora numărului relativ mic de pacienți în BCC în stadiul 4 sau pentru că am exclus pacienții cu organomegalie severă care a suferit deja o intervenție chirurgicală.
Distribuția scorului SGA în funcție de etapele CKD. P-valorile au fost obținute folosind testul exact al lui Fisher. Baruri indica procentul de pacienti din fiecare categorie. CKD; boli renale cronice, SGA; evaluare globală subiectivă
Pentru a minimiza efectul confuz al insuficienței renale, analiza subgrupului a fost efectuată la pacienții cu un eGFR ≥45 ml/min/1,73 m 2 (stadiile CKD 1-3A). La acești pacienți, numai htTKLV a prezentat o asociere semnificativă cu scorurile SGA (Fig. 3d).
Folosind 2340 mL/m ca valoare limită a htTKLV pe baza analizei curbei ROC, a fost utilizată analiza de regresie logistică pentru a estima raportul de șanse între subnutriți (scor SGA de 4-5) și grupul bine hrănit (un SGA scor de 7) folosind variabile care au arătat semnificație statistică în rândul grupurilor SGA. Pacienții cu htTKLV ≥2340 ml/m au prezentat un risc mai mare de malnutriție (un scor SGA de 4-5) (cota de raport = 8,74, interval de încredere 95% 3,30-23,13, p
Discuţie
Insuficiența renală în sine poate contribui la malnutriție și risipa de proteine-energie [27]. De asemenea, am observat proporții crescute de pacienți cu malnutriție pe măsură ce stadiul CKD a avansat. Proporția pacienților cu un scor SGA mai scăzut a fost ușor mai scăzută în stadiul 4 al BCR decât la pacienții din stadiul 3B, care s-ar putea datora numărului relativ mic de pacienți în stadiul 4 al BCR sau pentru că am exclus pacienții cu organomegalie severă care au suferit deja intervenții chirurgicale. intervenţie. În plus, când am analizat parametrii cu scoruri SGA, majoritatea parametrilor antropometrici sau de laborator care sunt folosiți pe scară largă ca markeri pentru starea nutrițională nu au reușit să arate o asociere cu scorurile SGA, cu excepția funcției renale. Această constatare că funcția renală a fost semnificativ legată de scorurile SGA sugerează că este necesară evaluarea regulată a stării nutriționale la pacienții cu ADPKD pe măsură ce boala progresează.
Asocierea parametrilor cu scorurile SGA a fost diferită între sexe. La pacienții de sex masculin, vârsta înaintată, greutatea corporală mai mică, IMC mai scăzut și nivelurile mai mici de hemoglobină au fost legate de scorurile SGA mai mici, dar aceste relații nu au fost observate la pacienții de sex feminin. Una dintre explicații ar fi masa musculară relativ redusă la femei în comparație cu bărbații, modificările greutății corporale și IMC cauzate de malnutriție ar putea fi prea mici pentru a fi detectate în populația noastră de femei din Asia. Mai mult, chisturile mărite, ascita sau edemul, care sunt complicații frecvente la pacienții cu ADPKD, pot masca reducerea masei musculare sau a proporției de grăsime din corp. Parametrii de laborator, cum ar fi hemoglobina, proteina totală, albumina sau colesterolul total, nu au fost suficient de sensibili pentru a detecta modificările stării nutriționale în primele etape ale malnutriției. Astfel, vor fi necesare studii suplimentare pentru a confirma această constatare în alte cohorte și pentru a clarifica motivul, inclusiv analiza masei musculare. De asemenea, ar trebui dezvoltați alți markeri pentru starea nutrițională pentru pacienții cu ADPKD, în special pentru pacienții cu femei ADPKD.
În acest studiu, am constatat că 23,5% dintre pacienți au avut o problemă nutrițională (scor SGA ≤6) chiar și în stadiul incipient al BCR (etapa 1-3a). În plus, creșterea htTKLV a fost un factor de risc independent după ajustarea funcției renale prin utilizarea unui model de regresie logistică multivariată. Alți biomarkeri nutriționali, cum ar fi prealbumină, factor de creștere asemănător insulinei 1 sau transferină, nu au fost evaluați în acest studiu. htTKLV ar putea oferi informații valoroase despre starea nutrițională, precum și despre progresia bolii, dar este dificil de măsurat cu metodele actuale. Prin urmare, este necesară dezvoltarea de noi instrumente pentru evaluarea nutrițională a pacienților cu ADPKD, iar astfel de instrumente ar fi utile pentru îmbunătățirea rezultatelor pe termen lung ale pacienților.
Concluzii
În concluzie, detectarea malnutriției marginale la pacienții din ambulatoriile ADPKD și inițierea unui sprijin adecvat pot juca un rol terapeutic important, în special la pacienții cu funcție renală scăzută sau cu o creștere a htTKLV.
- De ce malnutriția este o problemă pentru mai mult de jumătate dintre pacienții aflați în terapie intensivă
- De ce Tomatul este nociv pentru pacienții cu rinichi Dieta renală de nikita sharma Medium
- Cel mai bun aliment pentru câini cu conținut scăzut de proteine pentru sănătatea rinichilor și a ficatului în 2020
- Rezultatele artroplastiei totale a genunchiului la pacienții cu obezitate morbidă o revizuire sistematică a
- Talie fără greutate Cheia bolii hepatice grase nealcoolice Pacienți neobezi cu talie mare