Analiza aminoacizilor prin cromatografie lichidă și detectare optică necesită pregătirea suplimentară a probelor, deoarece majoritatea aminoacizilor nu au un cromofor și nu pot fi detectați. Astfel, după hidroliză, următorul pas într-o analiză a aminoacizilor este derivatizarea. Această secțiune descrie prepararea hidrolizatelor de proteine sau peptide pentru derivatizare utilizând Waters AccQ • Tag chimie.
Pentru a deriva corect și în mod fiabil o probă hidrolizată, trebuie luate în considerare următoarele:
- Îndepărtarea particulelor
- Determinarea masei probei pentru derivatizare
- Determinarea dacă este necesară neutralizarea eșantionului
- Utilizarea reactivului de derivatizare în exces pe baza masei probei
Următoarele discuții sunt prescurtate din necesitate. Pentru informații suplimentare și îndrumări despre AccQ • Chimie de derivatizare a etichetelor, vă rugăm să vizitați www.waters.com/AAA.
Centrifugarea poate fi necesară dacă sunt prezente cantități mari de particule sau lipide plutitoare. Centrifugarea face mai ușoară extragerea unei alicote de hidrolizat clar pentru derivatizare.
Pentru probele cu volum mare, cum ar fi hidrolizate de analiză a furajelor, filtrarea particulelor poate fi suficientă, observându-se că recuperarea probelor poate fi afectată de alegerea materialului filtrant. Acest factor trebuie luat în considerare și abordat pentru a obține rezultate imparțiale. Contactați producătorul filtrului pentru detalii privind performanța filtrului în această aplicație.
Metoda AccQ • Tag este o tehnică de derivatizare precolumnă pentru analiza aminoacizilor peptidei și proteinelor hidrolizate. Metoda AccQ • Tag realizează următoarele:
- Folosește Waters AccQ • Tag Ultra sau AccQ • Fluoride ™ Reagent pentru a deriva aminoacizii
- Separează derivații folosind HPLC sau UPLC în fază inversă pe bază de gradient
- Cuantifică cu precizie derivații utilizând standarde externe de aminoacizi și detectare optică
Reactivul 6-aminoquinolil-N-hidroxisuccinimidil carbamat (AQC) reacționează atât cu amine primare, cât și cu amine secundare. Excesul de reactiv AQC reacționează cu apă pentru a forma 6-aminoquinolină (AMQ). AMQ reacționează lent cu excesul de reactiv AQC pentru a forma o bis uree. Aceste produse secundare nu interferează cu separarea, identificarea și cuantificarea aminoacizilor conținuți în peptidele sau hidrolizatele proteice. Derivații sunt stabili timp de zile, permițând prelucrarea în serie sau analiza repetată, dacă se dorește.
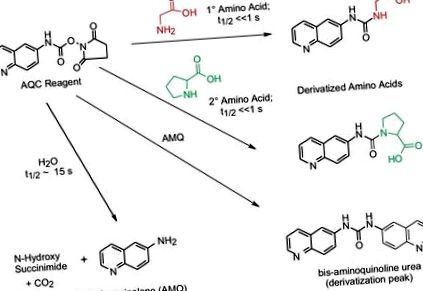
De-a lungul mai multor ani, au fost efectuate studii ample pentru a asigura acuratețea reacției de derivare AccQ • Tag. Reacția chimică în sine necesită atât un exces molar de reactiv de derivatizare, cât și un pH bazic (8-10) pentru derivatizarea completă a tuturor aminoacizilor. Au fost dezvoltate strategii pentru a aborda acești factori critici.
6.3.1 Determinarea cantității de eșantion pentru AccQ • Derivatizarea etichetei
În reacția însăși, proba este de obicei diluată de 10x și 1 uL dintr-un volum total de derivare de 100 uL este injectat pe coloană. Deoarece nu toți aminoacizii sunt prezenți în aceeași cantitate într-o derivatizare, cantitatea de probă trebuie să fie suficientă pentru ca aminoacidul cel mai puțin abundent să aibă impact asupra limitei de detectare sau cuantificare. Derivatizarea a cel puțin 1 pmol din cel mai puțin abundent aminoacid, într-un volum maxim de injecție de 1 µL, este recomandată pentru a obține o cuantificare precisă. Pentru a determina cantitatea de eșantion necesară, efectuați următorul calcul:
➢ Exemplu de calcul:
Pentru o concentrație de probă de 1,0 mg/ml proteină:
Estimează cantitatea de probă necesară pentru cel mai puțin abundent aminoacid. În acest exemplu, presupunem că este necesară 0,03 mg/ml pentru a furniza 1 pmol pe o coloană a acestui aminoacid.
Pasul 1: Determinați concentrația molară aproximativă a aminoacidului cel mai puțin abundent.
Conversia mg în moli (greutatea moleculară medie a unui reziduu de aminoacizi într-o proteină este de 110).
Aceasta este concentrația estimată a aminoacidului cel mai puțin abundent din această probă.
Pasul 2: Determinați diluția necesară pentru a da 1 pmol din acest aminoacid cel mai puțin abundent pe coloană.
Aceasta oferă o diluție de 27 de ori (10 ÷ 0,37 = 27).
Hidrolizatul necesită o diluție de 27 de ori înainte de derivatizare. De exemplu: 5 pl din proba de hidrolizat poate fi diluată prin 135 µL de 0,1 N HCI pentru a produce această valoare țintă.
În cele din urmă, o alicotă de 10 pl din diluția de mai sus poate fi transferată în flaconul de derivatizare.
6.3.2 Neutralizare pentru AccQ • Derivatizarea etichetei
Pentru a asigura o derivare completă a reactivului AccQ • Tag al aminoacizilor conținuți în hidrolizat, proba trebuie tamponată într-un interval de pH aproximativ de 8,2 până la 10,1. Dacă acidul hidrolizat nu este neutralizat corespunzător și dacă pH-ul scade sub 8,2, derivatizarea va fi incompletă. Efectul pH-ului variază pentru fiecare aminoacid. Rețineți că nu toți aminoacizii sunt afectați în mod egal. Aminoacizii acizi, cum ar fi acidul glutamic și alanina, sunt afectați mai mult decât serina sau fenilalanina. pH-ul este un factor critic în obținerea cuantificării exacte a tuturor aminoacizilor din proba originală.
- Dacă soluția de aminoacizi este dizolvată în 0.1N HCI, 10-20 µL de probă pot fi transferați direct la cocktailul de derivatizare fără ajustarea pH-ului. Noși:Este încă necesară o tensiune care să fie posibilă o federalizare a excesului de reactivare, așa cum este descris mai jos.
- Dacă soluția de aminoacizi se află într-o concentrație mai mare de acid (> 0,1 N HCI), aceasta trebuie neutralizată cu un volum egal de hidroxid de sodiu la aceeași concentrație. Acest lucru poate fi realizat fie ca adaos de volum masiv, fie integrat în etapa de derivatizare.
- Se înlocuiește cantitatea necesară de tampon de borat cu NaOH pentru a neutraliza HCI din probă.
- În amestecul flaconului de reacție de derivatizare, așezați 10 pl de NaOH xM și 60 pl de borat. Se adaugă 10 uL din proba AA (în xN HCI). Derivați cu 20 µL de reactiv AccQ • Fluor.
- Dacă există o întrebare despre neutralizarea corectă, puteți pregăti probe de probă și puteți verifica pH-ul final cu benzi de pH de unică folosință.
WARNING: Dacă proba devine galben strălucitor la adăugarea reactivului de derivatizare, pH-ul probei este prea scăzut. Se neutralizează cu NaOH.
➢ Exemplu de calcul:
Pentru a determina cantitatea de NaOH necesară neutralizării, efectuați următorul calcul.
Pentru eșantionul de proteine de mai sus la 1,0 mg/ml în HCI 6 N, care trebuie diluat 27x pentru a se asigura că există suficient reactiv de derivatizare în exces în eșantion, se aplică următoarele calcule.
Pasul 1: Calculați concentrația acidă finală a probei după diluare.
Transformați concentrația acidă a probei de la molar la µmoli:
Determinați concentrația finală de acid din proba diluată:
Memento: 5 µL din proba de hidrolizat pot fi diluate cu 135 µL de 0,1 N HCI pentru a produce această valoare țintă.
Pasul 2: Determinați cantitatea de bază (NaOH) de adăugat în tampon pentru derivatizare.
Cantitatea totală de NaOH necesară pentru fiecare derivatizare este de 0,31 M.
Deoarece tamponul total de borat adăugat la derivatizare este de 70 µL, există două metode de neutralizare:
Adăugați 10 pl de NaOH 0,31 M și 60 pl de tampon pentru fiecare derivatizare.
Într-un flacon separat, amestecați 600 pl de tampon borat și 100 pl de NaOH 0,31 M. Amesteca. Adăugați 70 µL din acest amestec + 10 µL probă + 20 µL AccQ • Reactiv de derivatizare a etichetei pentru fiecare probă.
6.3.3 Confirmarea excesului reactivului de derivatizare pentru AccQ • Deratizarea etichetei
Pentru derivatizarea completă a tuturor aminoacizilor, în reacție este necesar un exces molar de 4–6x din reactivul de derivatizare AccQ • Tag. Dacă nu există suficient reactiv, unii aminoacizi relativ sensibili nu vor fi derivați complet. Ratele de derivatizare pentru fiecare aminoacid variază în funcție de proprietățile chimice ale aminoacizilor; de exemplu, recuperarea alaninei poate fi afectată semnificativ de un exces molar insuficient de AccQ • Tag, în timp ce fenilalanina este mai imună la aceste efecte.
Pentru a determina cantitatea de probă de adăugat flaconului cu reactiv, trebuie să cunoaștem cantitatea de reactiv din fiecare flacon. Flaconul standard cu reactiv AccQ • Tag conține 3-4 mg de reactiv, adică aproximativ 10-14 µmoli de reactiv. Deoarece reactivul este dizolvat în 1 ml de acetonitril și se utilizează 20 µL pentru fiecare reacție de derivatizare de 100 µL, fiecare vas de reacție conține 210–280 nmoles a reactivului de derivatizare.
Deoarece fiecare fiolă de reacție conține 210-280 nmol de reactiv și avem nevoie de 4-6x exces molar pentru fiecare probă, ar trebui să existe nu mai puțin de 40-140 nmoli de amine totale în fiecare reacție.
➢ Exemplu de calcul:
Pentru o probă de proteine, utilizați greutatea probei și greutatea medie a unui aminoacid pentru a estima excesul necesar.
Pasul 1: convertiți concentrația mg/ml a stocului în concentrația molară de aminoacizi.
De exemplu, cu o concentrație de proteină de 1 mg/ml și o greutate moleculară medie de 110, cantitatea de proteină din probă este determinată după cum urmează:
unde MW este convertit în unități de la g/mol la µg/µmol și
1 mmol = 103 umol = 106 nmol
Pasul 2: Determinați cantitatea molară de aminoacizi în fiecare reacție.
Odată determinată concentrația molară, se calculează cantitatea de aminoacizi din probă.
Folosind proteina de 1 mg/mL la Pasul 1, care a necesitat o diluție de 27x (stoc de hidrolizat de 5 µL + 135 µL tampon) din secțiunea 6.3.1, nmolul din 10 µL din proba diluată se calculează după cum urmează:
3,3 nmol este cu mult sub limita de 140 nmol, deci proba este acceptabilă.
Metoda HPLC AccQ • Tag, comercializată de Waters Corporation în 1992, utilizează aceeași etapă de derivatizare precolumnă ca și Metoda AccQ • Tag Ultra care a fost introdusă în 2006. Reactivul AccQ • Fluor, 6-aminoquinolil-N-hidroxisuccinimidil carbamat ( AQC), derivatizează aminele primare și secundare într-o reacție simplă, într-o singură etapă, pentru a produce aducti fluorescenți foarte stabili. Oferim metoda AccQ • Tag ca un pachet de sistem care include reactivi preambalați și documentație extinsă. Pachetul de chimie AccQ • Tag conține elementele necesare pentru până la 250 de analize ale aminoacizilor hidrolizați ai proteinelor și peptidelor.
Setul de derivare AccQ • Tag conține cinci seturi de reactivi de derivatizare. Fiecare set de reactivi include câte un flacon, fiecare dintre următoarele:
- AccQ • Fluor Borate Buffer - adăugat la probe pentru a asigura un pH optim pentru derivatizare.
- AccQ • Pulbere reactivă a fluorului - 6-aminoquinolil-N-hidroxisuccinimidil carbamat. (AQC) reactiv de derivatizare (livrat uscat pentru stabilitate maximă).
- AccQ • Diluantul reactivului fluor - acetonitril, este utilizat pentru reconstituirea reactivului pentru derivatizare.
Figura 11. Cromatograme reprezentative ale analizei aminoacizilor pe bază de HPLC folosind Waters AccQ • Metoda Tag.
Soluția de analiză a aminoacizilor Waters UPLC este concepută holistic pentru analize de aminoacizi la cheie. Aminoacizii derivatizați înainte de coloană sunt rezolvați pe un sistem Waters ACQUITY ™ UPLC folosind AccQ • Tag Ultra inclus, coloană UPLC cu fază inversă, eluenți și metode. Chimia dură a derivatizării, liniile de bază cromatografice stabile și rezoluția superioară a aminoacizilor ajută la asigurarea rezultatelor cantitative precise, precise și consistente.
Soluția de analiză a aminoacizilor UPLC include:
- Waters AccQ • Produse chimice Tag Ultra, inclusiv coloană, reactivi și eluenți - toate testate QC cu aplicația de analiză a aminoacizilor
- Empower 2 Software, proiecte preconfigurate, metode și formate de raport
- Documentație completă de asistență la nivel de sistem și aplicație
Sistemul Waters ACQUITY UPLC acceptă trei detectoare optice diferite: UV reglabil, PDA și detector de fluorescență.
Figura 12. Soluția de analiză a aminoacizilor UPLC UPS.
6.5.1 Analiza exactă a aminoacizilor din diverse matrice de probă
Soluția de analiză a aminoacizilor UPLC include două metode complete care utilizează același instrument și chimie. Primul este potrivit pentru aminoacizii derivați din hidrolizați de proteine. Al doilea este potrivit pentru numărul mai mare de aminoacizi liberi găsiți în probe de proces precum cultura celulară sau bulionele de fermentație. Metodele diferă prin diluarea AccQ • Tag Ultra Eluent A și temperatura coloanei de separare. Nu există ajustări ale pH-ului de către utilizatori sau modificări ale compoziției pentru Eluent A sau Eluent B.
Figura 13. Cromatograme reprezentative ale UPLC AccQ • Tag Solutions. (A) Separarea aminoacizilor standard utilizând metoda hidrolizat a soluției de analiză a aminoacizilor UPLC. (B) Separarea setului mai mare de aminoacizi standard folosind metoda de cultură celulară a soluției de analiză a aminoacizilor UPLC. Nu sunt necesare modificări ale fazei mobile sau ale compoziției.
6.5.2 Analiza aminoacizilor proteinelor hidrolizate
Analiza aminoacizilor a proteinelor este utilizată atât ca parte a determinării structurale, cât și ca măsură a cantității totale de proteine dintr-o probă. Proba este hidrolizată înainte de analiză. Pentru analize structurale, raporturile molare observate ale aminoacizilor sunt comparate cu valorile așteptate din secvență.
Pentru cantitățile de proteine, se însumează greutățile aminoacizilor. Această măsură a concentrației de proteine este utilizată pentru a calcula coeficienții de extincție în cazul în care compoziția probei se interacționează cu testele comune de proteine. Atât procentul în greutate din fiecare aminoacid, cât și masa proteică totală sunt utilizate pentru a evalua conținutul nutrițional al alimentelor și furajelor. Soluția de analiză a aminoacizilor Waters UPLC oferă analize robuste și de rutină în toate aceste aplicații.
Figura 14. Analiza aminoacizilor unei hidrolize proteice pure.
Figura 15. Analiza aminoacizilor din dieta de pasăre hidrolizată.
- Cerințe de aminoacizi pentru întreținerea cocoșului pentru adulți Journal of Nutrition Oxford
- Modificări ale acizilor biliari și ale microbiotei intestinale în obezitate indusă de dieta bogată în grăsimi în modelul șobolanilor
- Un detergent pentru floră curăță apele murdare ale Rusiei - Business Line
- 3 ape aromate de casă cu conținut scăzut de calorii - Veg Girl RD
- Beverly International Mass Maker Ultra Chocolate - 3 Lb Dimensiune nouă
