Eliot C. Heher
* Divizia de Nefrologie și Centrul de Transplant, Spitalul General din Massachusetts, Boston, Massachusetts;
Helmut G. Rennke
† Departamentul de patologie, Brigham and Women’s Hospital, Boston, Massachusetts; și
Jacob P. Laubach
‡ Centrul de mielom multiplu Jerome Lipper, Divizia de malignitate hematologică, Departamentul de oncologie medicală, Institutul cancerului Dana Farber, Boston, Massachusetts
Paul G. Richardson
‡ Centrul de mielom multiplu Jerome Lipper, Divizia de malignitate hematologică, Departamentul de oncologie medicală, Institutul de cancer Dana Farber, Boston, Massachusetts
rezumat
Leziunea renală este o complicație obișnuită a mielomului multiplu și a altor discrazii cu celule plasmatice și este asociată cu creșterea mortalității. Mecanismele patogene multiple pot contribui la leziunile renale la pacientul cu mielom, dintre care unele sunt rezultatul Ig monoclonal nefrotoxic și unele dintre ele sunt independente de depunerea de paraproteine. Mecanismele patogene care stau la baza bolii renale legate de paraproteine sunt din ce în ce mai bine înțelese. O nouă analiză care permite cuantificarea lanțurilor ușoare libere din ser a ajutat la diagnosticarea unei noi boli de debut și a permis detectarea mai timpurie a recăderii. Agenții noi de mielom au arătat o promisiune considerabilă în inversarea insuficienței renale la unii pacienți și îmbunătățirea rezultatelor. Transplantul de celule stem rămâne un pilon al managementului pentru pacienții mai tineri cu mielom care sunt candidați potriviți pentru terapie intensivă, în timp ce rolul noilor medicamente, schimbul de plasmă și transplantul de rinichi continuă să evolueze.
Introducere
În mod tradițional, printre cele mai refractare și temute afecțiuni maligne, mielomul multiplu și alte tulburări asociate celulelor plasmatice primesc o atenție bine meritată, ca urmare a progresului semnificativ în înțelegerea biologiei de bază a celulelor plasmatice maligne și a disponibilității unor terapii noi mai eficiente și mai puțin toxice. În același timp, efectele renale ale tulburărilor celulelor plasmatice primesc în mod similar o atenție sporită, deoarece spectrul larg patologic și clinic al acestor boli este mai bine apreciat și opțiunile terapeutice s-au extins. Definită prin eliminarea anormală a creatininei, insuficiența renală este prezentă la aproape jumătate din pacienții cu mielom la prezentare și asociată cu creșterea mortalității. Prezența unei boli renale coexistente limitează opțiunile terapeutice și eligibilitatea transplantului de celule stem (1,2). În unele serii, supraviețuirea este redusă la mai puțin de 1 an la pacienții cu AKI asociată mielomului care nu recuperează funcția renală și, de fapt, reversibilitatea leziunii renale asociate mielomului este mai predictivă a supraviețuirii pacientului decât răspunsul la chimioterapie sistemică. . (3.4).
Tulburările monoclonale ale celulelor plasmatice includ gammopatia monoclonală premalignă cu semnificație nedeterminată (MGUS), plasmocitomul solitar, amiloidoză cu lanț ușor (AL) și mielom multiplu atât în formele sale asimptomatice, cât și în cele simptomatice (5). Tulburările sunt frecvente, MGUS afectând până la 3,2% din totalul persoanelor peste 50 de ani și mielomul multiplu reprezintă 13% din toate cazurile de cancer hematologic (6-8) La momentul diagnosticului, 37% dintre pacienții cu mielom au mai puțin de 65 de ani ani, iar alți 37% dintre pacienți au> 75 de ani; restul de 26% au vârste cuprinse între 65-74 de ani (8). Având în vedere cât de frecvente sunt tulburările celulelor plasmatice, este clar că nefrologii vor întâmpina aceste condiții cu regularitate.
Mecanisme de mielom și leziuni renale asociate cu celule plasmatice
tabelul 1.
Mecanisme de insuficiență renală în discrazii plasmatice: Ig-dependent și -independent
| Mecanisme dependente de Ig | |
| Nefropatie turnată (cunoscută în mod tradițional sub numele de rinichi cu mielom) | Factorii de risc includ mielom cu lanț ușor cu excreție monoclonală de Ig> 10 g/zi, depleție de volum, sepsis, medicamente (vezi mai jos); Depunerea de Ig este în primul rând în tubuli |
| Boala de depunere de Ig monoclonală | Sindromul sistemic poate fi prezent; Depunerea Ig poate fi în tubuli sau glomeruli, dar în general nu în ambele |
| Amiloidoză cu lanț ușor (AL) | Adesea asociat cu albuminurie cu rază nefrotică și lanțuri ușoare λ; sindromul sistemic poate fi prezent, iar depunerea amiloidă este în primul rând în glomeruli |
| GN | Membranoproliferativ, proliferativ difuz, crescent, crioglobulinemic, toate recunoscute |
| Nefrita tubulointerstițială | Poate rezulta și din mecanisme non-Ig |
| Boala schimbării minime | Albuminuria este de obicei prezentă pe lângă proteinuria cu lanț ușor |
| Glomerulopatie membranară | |
| Henoch - Scholein purpura/nefropatie IgA | Asociat cu mielom IgA |
| Glomerulopatie imunotactoidă (și posibil GN fibrilară) | Condiții rare; asocierea dintre boala fibrilară și paraproteine este incertă |
| Depozite monoclonale intracapilare de trombi IgM | Asociat cu macroglobulinemia Waldenstrom |
| Microangiopatie trombotică (TMA) | Paraproteina provoacă leziuni endoteliale cu rezultatul TMA |
| Sindromul de hiperviscozitate | Mai frecvent în cazurile de mielom IgA, IgG3 sau IgM |
| Mecanisme independente de Ig | |
| Epuizarea volumului | Poate provoca azotemie prerenală și necroză tubulară acută și/sau poate contribui la nefropatie |
| Septicemie | |
| Hipercalcemie | Poate provoca AKI direct sau poate contribui la nefropatie |
| Sindromul de liză tumorală | Nefropatie cu acid uric sau fosfat |
| Toxicitatea medicamentelor | Zoledronat: o cauză rară de insuficiență renală acută |
| Pamidronat: o cauză rară de prăbușire focală și glomeruloscleroză segmentară | |
| Medicamentele antiinflamatoare nesteroidiene, inhibitorul enzimei de conversie a angiotensinei, blocantul receptorilor angiotensinei, diuretice de ansă sau contrastul iodat pot precipita nefropatia turnată | |
| Invazie parenchimatoasă directă de către celulele plasmatice | Cauza rară; asociat cu mielom avansat sau agresiv |
| Pielonefrita | Cauza rară; multifactorială din imunodeficiență și Ig deficitară și chimioterapie din mielom |
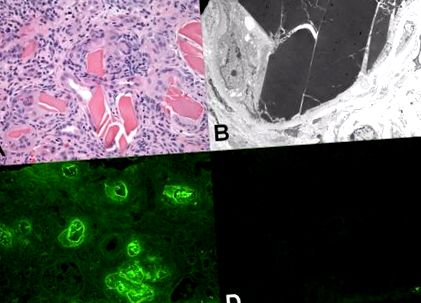
Nefropatie turnată cu lanț ușor (cunoscută și sub denumirea de rinichi mielom). (A) Tubulii conțin turnuri proteice eozinofile care au un aspect cristalin și rupt. Observați reacția inflamatorie proeminentă cu celule gigantice multinucleate de tip străin în imediata apropiere a materialului turnat (secțiune colorată cu hematoxilină și eozină). (B) Microscopia electronică arată materialul caracteristic turnat dens cu electroni în interiorul unui tubul. Condițiile din tubul au facilitat organizarea lanțului ușor într-o structură asemănătoare cristalului supramolecular. (C) Microscopia cu imunofluorescență cu anticorpi anti - λ fluorescenți prezintă o colorare puternică a piesei pentru acest lanț ușor. Observați colorarea ridicată a fundalului țesutului pentru lanțul ușor λ, o reflectare a plasmei superioare și, prin urmare, a concentrației țesutului acestei proteine. (D) Colorarea pieselor turnate pentru lanțurile ușoare light este negativă. De asemenea, colorarea fundalului pentru acest lanț ușor este semnificativ mai slabă decât pentru lanțurile ușoare λ.
Boala sistemică de depunere a lanțului ușor κ. (A) Glomerulul dezvăluie un aspect nodular distinct, cauzat de expansiunea matricei mezangiale ca răspuns la depunerea paraproteinei (acid periodic - secțiune colorată Schiff). Observați îngroșarea membranelor bazale tubulare și fibroza interstițială proeminentă. (B) Microscopia electronică prezintă depozite dense caracteristice confluente și fine de tip Randall, granulare, de-a lungul aspectului interior al membranelor subsolului glomerular ridat. Endoteliul a fost deteriorat de acest proces și lipsește din acest segment al buclei capilare. (C) Prin microscopie de imunofluorescență cu anticorpi anti-ores fluorescenți, toate membranele bazale și nodulii mezangiali prezintă o colorare puternică pentru acest lanț ușor. (D) Colorarea membranelor bazale și a nodulilor mezangiali pentru lanțurile ușoare λ este semnificativ mai slabă și aproape de fundal. Colorarea pentru toate lanțurile grele este la fel negativă (nu este prezentată).
Amiloid cu lanț ușor (AL) cu specificitatea lanțului λ-ușor, cu implicarea glomerulilor (Glom) și a arterelor (Arta). (A) Pata roșie din Congo dezvăluie depozite roșii portocalii extinzând mezangiul și infiltrându-se în pereții capilari periferici ai Glom și Art. (B) Depozitele amiloide prezintă birefringență caracteristică verde-mar atunci când sunt văzute sub lumină polarizată. Doar acele agregate amiloide cu fibrile într-un anumit unghi de orientare prezintă birefringență verde la orice poziție dată a filtrelor polarizante. Pe măsură ce se rotește diapozitivul pe stadiul microscopului, se va dezvălui birefringența verde a depozitelor de amiloid cu fibrile la diferitele unghiuri de orientare din țesut. (C) Microscopia cu imunofluorescență cu anticorpi anti-λ fluorescenți prezintă o colorare puternică a depozitelor de amiloid grosiere și confluente din Glom și peretele art. (D) Reactivitatea amiloidului este negativă pentru lanțurile κ-ușoare, așa cum s-a evidențiat cu reactivul fluorescenat anti-κ-lanț ușor.
Mieloamele care produc numai lanțuri ușoare reprezintă 40% -60% din leziunile renale severe asociate mielomului, reflectând nefrotoxicitatea lanțului ușor filtrat (5). De fapt, proprietățile neobișnuite de solubilitate ale lanțurilor ușoare asociate mielomului au condus la identificarea lor originală în urmă cu mai bine de 150 de ani, ca Bence - Jones Proteins, la un pacient cu proteinurie cu lanț ușor. Mielomul nesecretor este rar asociat cu leziuni renale. Echilibrul cazurilor rezultă din cel mai frecvent tip de mielom, în care se secretă Ig monoclonal intact împreună cu o cantitate mică de lanț ușor monoclonal însoțitor. Un anumit grad de insuficiență renală este observat la un moment dat în istoria naturală a aproape tuturor cazurilor de mielom; 70% dintre pacienții care secretă mai mult de 10 g/zi lanț ușor vor dezvolta insuficiență renală, în timp ce acei pacienți cu forma rară IgD de mielom par să dezvolte insuficiență renală 100% din timp în unele serii (2). Nefrologii care evaluează pacienții cu BCR ar trebui să țină cont de faptul că, ocazional, pacienții vor dezvolta MIDD ca rezultat al unei mici clone de celule plasmatice, care produce (23) Ig monoclonal cu nefrotoxicitate care îi depășește cu mult conținutul în plasmă (24).
După cum este detaliat în Tabelul 1, insuficiența renală asociată mielomului poate rezulta și din mecanisme independente de Ig. Aceste mecanisme includ hipercalcemia, nefropatia acidului uric, epuizarea volumului, sepsis, rabdomioliză, antiinflamatoare nesteroidiene și inhibitori ai sistemului renină-angiotensină (25,26). Rareori, pielonefrita sau invazia parenchimatoasă renală directă de către celulele plasmatice pot fi prezente. Amino-bifosfonatul zoledronat a fost rar asociat cu AKI la pacienții cu mielom, iar vărul său farmacologic pamidronat a fost asociat cu FSGS prăbușit (27,28). Având în vedere că bifosfonații joacă un rol foarte important în controlul bolilor osoase în mielom și în gestionarea hipercalcemiei, utilizarea lor precaută ar trebui să continue în pofida acestor rapoarte, acidul pamidronic fiind adesea preferat în situația disfuncției renale și a acidului zoledonic redus în doză. fiind de ajutor. Incertitudinile cu privire la bifosfonați care ar trebui abordate prin viitoarele studii clinice includ doza și durata utilizării, în special la pacienții cu BCC avansată sau dependență de dializă care pot prezenta un risc mai mare de boală osoasă adinamică și alte complicații ca urmare a clearance-ului renal redus al droguri.
S-au făcut multe progrese în elucidarea evenimentelor moleculare care duc la leziuni renale monoclonali mediate de Ig, care au făcut obiectul unei recenzii recente (29). Lanțurile ușoare sunt filtrate la nivelul glomerulului și suferă endocitoză dependentă de clatrin de către sistemul receptorilor megalin/cubilină. Unele dintre aceste lanțuri ușoare sunt rezistente la degradarea chimică și se acumulează ca precipitate care interferează cu funcția proximală a tubului (30,31). Lanțurile ușoare care sunt degradate induc citokine proinflamatorii, cum ar fi proteina chimiotratantă monocitară-1 și IL-6 și -8 (32,33). Aceste lanțuri ușoare par să catalizeze, de asemenea, producția de specii reactive de oxigen, care, la rândul lor, duc la infiltrarea celulelor inflamatorii, la depunerea matricei și la fibroză și poate contribui la transformarea epitelio-mezenchimală a celulelor epiteliale tubulare renale (34). Atât căile kinazei activate de mitogen, cât și căile NF-κB mediază cascada proinflamatorie (32,33).
Detectarea Ig monoclonal
Transplant de rinichi
Ocazional, pacienții cu insuficiență renală asociată mielomului realizează o remisie susținută a mielomului, dar rămân dependenți de dializă și, prin urmare, se are în vedere transplantul de rinichi. Riscurile transplantului de rinichi la această populație includ mielom recurent (posibil mai probabil ca urmare a efectelor imunosupresiei), disfuncție grefă mediată de Ig monoclonală și infecție. S-a raportat o disfuncție gravă a alogrefei grave ca urmare a GN necrotizant monoclonal, iar forme mai subacute de deteriorare a grefei sunt frecvente la pacienții a căror boală renală nativă era MIDD (96,97). Dacă leziunea inițială a fost nefropatia aruncată, riscul de recurență a grefei renale pare scăzut dacă mielomul rămâne în remisie (98). Recent, Naina și colab. (99) au studiat rezultatele beneficiarilor de transplant renal și MGUS; 2 din 23 de pacienți cu transplant MGUS au dezvoltat mielom mocnit și 2 pacienți au dezvoltat o altă boală limfoproliferativă post-transplant pe o perioadă medie de urmărire de 8,5 ani. Niciunul dintre pacienții care au dezvoltat MGUS post-transplant nu a dezvoltat mielom, dar 2 pacienți au dezvoltat boală limfoproliferativă post-transplant decenii după transplant (99).
Pentru ca un pacient cu mielom să fie considerat un transplant de rinichi, majoritatea centrelor necesită ca pacienții să fie în remisiune fără tratament timp de cel puțin 3-5 ani. Ocazional, pacienții cu MIDD sau amiloid pot fi candidați la transplant de rinichi după obținerea unui răspuns hematologic complet, indiferent dacă SCT a fost efectuat (100). Există puține informații publicate despre mielomul mocnit, deși majoritatea centrelor sunt reticente în a continua. Transplantul poate continua pentru majoritatea pacienților cu MGUS dacă cauza insuficienței renale nu are legătură cu MGUS și nivelul Ig monoclonal este stabil și scăzut. Consilierea în cazul plantelor ar trebui să abordeze riscul, care pare scăzut, ca imunosupresia să accelereze starea premalignă (98). Tratamentul bolii paraproteice post-transplant este dincolo de scopul acestui articol, dar atât bortezomibul, cât și lenalidomida au fost utilizate cu succes.
Concluzie
Ig monoclonal nefrotoxic poate provoca leziuni renale printr-un set remarcabil de diversificat de mecanisme și, prin urmare, nefrologii și alți medici ar trebui să aibă un prag scăzut pentru a testa pacienții corespunzători pentru paraproteine. Utilizarea pe scară mai largă a biopsiei renale pentru a identifica boala renală mediată de Ig monoclonală poate fi indicată, deoarece opțiunile terapeutice pentru bolile mediate de paraproteine s-au îmbunătățit. Testul FLC seric este un biomarker sensibil, util ca instrument de diagnostic adjuvant pentru monitorizarea răspunsului la terapia multor boli paraproteice. Bortezomib, lenalidomida și talidomida vizează mai eficient celulele plasmatice și micromediul lor și reprezintă progrese terapeutice interesante în domeniu. SCT autolog este asociat cu un risc crescut la pacienții cu insuficiență renală avansată și, prin urmare, utilizarea sa este limitată. Deși entuziasmul a scăzut pentru utilizarea schimbului de plasmă pentru tratarea AKI asociate paraproteinelor, noile dializatoare de compensare a lanțului ușor prezintă promisiuni în acest sens combinate cu chimioterapie eficientă. Transplantul de rinichi la pacienții cu malignitate a celulelor plasmatice este de obicei contraindicat, deși pacientul rar care a beneficiat de remisie prelungită și are niveluri stabile de lanț ușor se poate.
Dezvăluiri
E.C.H., H.R. și J.L. nu au dezvăluiri. P.G.R. face parte din comitetele consultative pentru Millennium, Celgene și Johnson & Johnson și primește finanțare pentru cercetare de la Millennium și Celgene.
Mulțumiri
Autorii recunosc cu recunoștință sprijinul administrativ al Michelle Maglio în pregătirea acestui manuscris.
Această lucrare a fost, în parte, susținută de Fondul Rick Corman pentru cercetarea mielomului multiplu.
- Suplimentele de sănătate pentru câinii cu boli de rinichi
- Nefropatia IgA (boala Berger) Cauze, simptome și tratamente - American Kidney Fund (AKF)
- Medicamente pentru arsuri la stomac legate de riscul bolilor renale 5 alimente care pot neutraliza în mod natural acidul stomacal
- În cazul bolilor renale în stadiu târziu, medicamentul care scade uratul nu oferă ajutor MedPage astăzi
- Orez cu conținut scăzut de proteine Orez medical pentru boli renale cronice - ScienceDirect