Rachael M. Taylor
2 Facultatea de Sănătate și Medicină, Școala de Medicină și Sănătate Publică, Universitatea din Newcastle, Callaghan, NSW 2308, Australia; [email protected] (E.-C.C.); [email protected] (J.R.A.); [email protected] (A.J.H.)
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
Roger Smith
2 Facultatea de Sănătate și Medicină, Școala de Medicină și Sănătate Publică, Universitatea din Newcastle, Callaghan, NSW 2308, Australia; [email protected] (E.-C.C.); [email protected] (J.R.A.); [email protected] (A.J.H.)
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
Clare E. Collins
2 Facultatea de Sănătate și Medicină, Școala de Medicină și Sănătate Publică, Universitatea din Newcastle, Callaghan, NSW 2308, Australia; [email protected] (E.-C.C.); [email protected] (J.R.A.); [email protected] (A.J.H.)
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
4 Facultatea de Sănătate și Medicină, Școala de Științe ale Sănătății, Universitatea din Newcastle, Callaghan, NSW 2308, Australia
5 Centru de cercetare prioritară în activitate fizică și nutriție, Universitatea din Newcastle, Callaghan, NSW 2308, Australia
David Mossman
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
6 Departamentul de Medicină Moleculară, NSW Health Pathology, John Hunter Hospital, New Lambton Heights, NSW 2305, Australia
Michelle W. Wong-Brown
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
7 Facultatea de Sănătate, Școala de Științe Biomedice și Farmacie, Universitatea din Newcastle, Callaghan, NSW 2308, Australia
Eng-Cheng Chan
2 Facultatea de Sănătate și Medicină, Școala de Medicină și Sănătate Publică, Universitatea din Newcastle, Callaghan, NSW 2308, Australia; [email protected] (E.-C.C.); [email protected] (J.R.A.); [email protected] (A.J.H.)
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
Tiffany-Jane Evans
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
8 unități de proiectare a cercetării clinice IT și suport statistic (CReDITSS), Hunter Medical Research Institute, 1 circuit Kookaburra, New Lambton Heights, NSW 2305, Australia
John R. Attia
2 Facultatea de Sănătate și Medicină, Școala de Medicină și Sănătate Publică, Universitatea din Newcastle, Callaghan, NSW 2308, Australia; [email protected] (E.-C.C.); [email protected] (J.R.A.); [email protected] (A.J.H.)
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
8 unități de proiectare a cercetării clinice IT și suport statistic (CReDITSS), Hunter Medical Research Institute, 1 circuit Kookaburra, New Lambton Heights, NSW 2305, Australia
Tenele Smith
2 Facultatea de Sănătate și Medicină, Școala de Medicină și Sănătate Publică, Universitatea din Newcastle, Callaghan, NSW 2308, Australia; [email protected] (E.-C.C.); [email protected] (J.R.A.); [email protected] (A.J.H.)
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
Trent Butler
2 Facultatea de Sănătate și Medicină, Școala de Medicină și Sănătate Publică, Universitatea din Newcastle, Callaghan, NSW 2308, Australia; [email protected] (E.-C.C.); [email protected] (J.R.A.); [email protected] (A.J.H.)
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
Alexis J. Hure
2 Facultatea de Sănătate și Medicină, Școala de Medicină și Sănătate Publică, Universitatea din Newcastle, Callaghan, NSW 2308, Australia; [email protected] (E.-C.C.); [email protected] (J.R.A.); [email protected] (A.J.H.)
3 Hunter Medical Research Institute, 1 Kookaburra Circuit, New Lambton Heights, NSW 2305, Australia; [email protected] (D.M.); [email protected] (M.W.W.-B.); [email protected] (T.-J.E.)
9 Priority Research Center for Generational, Health and Aging, Universitatea din Newcastle, Callaghan, NSW 2308, Australia
Date asociate
Abstract
1. Introducere
Metilarea ADN-ului este un mecanism epigenetic care implică transferul unei grupări metil (-CH3) într-o dinucleotidă ADN citozină-fosfat-guanină (CpG). Stabilirea și menținerea modelelor de metilare a ADN-ului este esențială pentru dezvoltarea mamiferelor și funcția fiziologică a organismului adult [1]. După fertilizare, majoritatea modelelor de metilare a ADN-ului sunt șterse și restabilite după implantare [2,3,4]. În timpul embriogenezei și al vieții postnatale timpurii, metilarea ADN-ului crește, ducând la diferențierea celulelor și la organogeneza [5,6,7]. Metilazele de novo DNMT3a și DNMT3b [8] sunt responsabile pentru stabilirea modelelor de metilare a ADN-ului și DNMT1 [9] este responsabilă pentru menținerea acestor tipare în timpul diviziunilor celulare. Modificările metilării ADN-ului apar pe tot parcursul dezvoltării ca răspuns la semnalele interne și externe declanșate de mediu. Programarea greșită a modelelor de metilare în timpul ferestrelor critice ale dezvoltării poate modifica funcționarea celulelor și a țesuturilor, crescând astfel susceptibilitatea la boli umane mai târziu în viață [10,11,12,13].
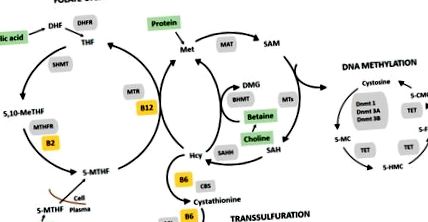
Metilarea ADN-ului are loc pe calea metabolismului cu un singur carbon (Figura 1), care implică transferul grupărilor metil de la un sit la altul printr-o cascadă de reacții biochimice. Nutriția în timpul sarcinii și a vieții postnatale poate afecta în mod semnificativ metilarea ADN-ului, deoarece grupurile metilice și cofactorii metabolismului cu un singur carbon provin din nutrienți furnizați în dietă, inclusiv metionină (aminoacid), folat (vitamina B9), colină, betaină, vitamina riboflavină B2), piridoxină (vitamina B6) și cobalamină (vitamina B12) [14]. Sursele alimentare bogate în acești nutrienți sunt prezentate în Tabelul 1 .
tabelul 1
Surse alimentare bogate în nutrienți și cofactori donatori de metil.
| Colină | Conopidă, ouă, semințe de in, linte, ficat, arahide, soia și germeni de grâu. |
| Folat și acid folic | Sparanghel, brânză, ouă, pâine și cereale fortificate, leguminoase, ficat, arahide, portocale și spanac. |
| Metionină | Produse lactate, ouă, pește, carne, carne de pasăre și orez. |
| Vitamina B2 (Riboflavină) | Brânză, ouă, carne și lapte. |
| Vitamina B6 (Piridoxină) | Banane, pește, cereale, leguminoase, ficat, carne, cartofi și păsări de curte. |
| Vitamina B12 (Cobalamină) | Ouă, pește, carne, păsări de curte, produse lactate |
Nutrienții cu un singur carbon consumați în dietă sunt absorbiți în intestinul subțire prin mecanisme de transport active sau pasive și apoi sunt eliberați în circulația portalului. La nivel celular, metabolismul folatului are loc în mitocondrii, în timp ce căile rămase de metabolism cu un singur carbon apar în citosol. Variante de nucleotide unice sau polimorfisme în gene specifice pot modifica eficiența căilor biochimice într-un singur metabolism al carbonului. De exemplu, polimorfismul C677T locus (citozina (C) este înlocuit cu timina (T) _ la poziția de bază 677) din gena metilenetetrahidrofolat reductazei (MTHFR) afectează metabolismul folatului și homocisteina și capacitatea de metilare a ADN, precum și modificarea riscului de boală [ 15]. Prin urmare, necesarul de nutrienți pentru metabolismul cu un singur carbon poate varia în funcție de genotipuri specifice.
Elementele nutritive cu un singur carbon sunt necesare pentru producerea de S-adenosil-metionină (SAM), donatorul universal de metil, necesar pentru metilarea ADN-ului [16,17]. Adăugarea unei grupări metil la un ADN dinucleotid reglează expresia genelor prin prevenirea legării factorilor de transcripție sau prin recrutarea proteinelor care se leagă de ADN metilat și modifică configurația cromatinei [18,19]. Prin urmare, un deficit sau un exces nutrițional poate induce modele aberante de metilare a ADN-ului (hipo- sau hipermetilare) care afectează în mod negativ activarea genelor și susceptibilitatea bolii [20,21,22].
Acest studiu a investigat asocierea: (1) Aportului cumulativ de nutrienți (metionină, folat, vitamina B2, B6, B12 și colină) în perioada copilăriei și copilăriei timpurii (trei luni până la trei ani) privind metilarea globală a ADN-ului în celulele bucale la patru ani de vârstă; (2) Aportul de nutrienți (metionină, folat, vitamina B2, B6, B12 și colină) la vârsta de trei ani cu privire la metilarea globală a ADN-ului în celulele bucale la vârsta de patru ani.
2. Materiale și metode
2.1. Populația de studiu
Acest studiu a analizat datele pentru copii și mame înscriși într-o cohortă prospectivă, longitudinală, numită studiul WATCH [31]. Pe scurt, femeile însărcinate au fost recrutate de la clinica prenatală de la spitalul John Hunter (JHH), New South Wales (NSW), Australia, din iulie 2006 până în decembrie 2008. Toate femeile însărcinate cu mai puțin de 18 săptămâni, locuiau în zonele învecinate și au putut participa la JHH au fost eligibili să participe. Femeile au fost recrutate de moașe și prin acoperirea mass-media locală sau prin gură din gură. O rată de consimțământ de 61% a fost atinsă pentru femeile gravide care au fost abordate pentru a participa la studiu și 181 de femei au fost înscrise în studiu. Femeile însărcinate au participat la vizite de studiu la aproximativ 19, 24, 30 și 36 de săptămâni de gestație. Mamele și descendenții lor au continuat să participe la vizite de studiu la intervale trimestriale în primele 12 luni după naștere și apoi anual până la vârsta de patru ani. Prezența la vizita de studiu și retragerea participanților sunt raportate în Figura 2. Studiul WATCH a primit aprobarea de etică de la Comitetul de etică al cercetării Hunter New England (06/05/24/5.06) și toți participanții au dat consimțământul scris în scris.
- Cum sunt tratate diferit arsurile de gradul I, II și III
- Vindecarea bolii tiroidiene a durat doi ani de schimbare a dietei și a stilului meu de viață
- SĂNĂTATE După ani în care am fost supraponderal și mi-am urât; gras; Eu; Îmi iau rămas bun de la vechiul meu eu; Sârmă
- Dieta umană paleolitică superioară târzie, prima dovadă a izotopului stabil de la Riparo Tagliente (Verona,
- Comportamentul matern și creșterea în greutate a sugarului în primul an