Abstract
fundal
Inhibitorii 3-hidroxi-3-metil-glutaril CoA (HMG-CoA) reductază sau statinele sunt inhibitori competitivi ai enzimei care limitează rata în biosinteza colesterolului. În prezent, statinele sunt utilizate ca terapie de primă linie în tratamentul dislipidemiei diabetice. Cu toate acestea, efectele statinelor asupra funcției celulelor β rămân neclare. Acest studiu își propune să examineze efectele tratamentului cu atorvastatină asupra funcției celulelor β pancreatice la șoarecii obezi C57BL/6 J și posibilele mecanisme.
Metode
Șoarecii C57BL/6 J obezitate indusă de dietă (DIO) au fost tratați cu atorvastatină (30 mg/kg/zi) timp de 58 de zile. Funcția celulelor β a fost evaluată prin clemă hiperglicemiantă și zona celulelor β insulino-pozitive a fost examinată prin imunofluorescență. Expresia genică a fost evaluată prin RT-PCR, iar proteinele legate de stres ale reticulului endoplasmatic (ER) au fost examinate prin Western blot. În plus, viabilitatea celulară și apoptoza celulelor NIT-1 încărcate cu colesterol au fost investigate după tratamentul cu atorvastatină.
Rezultate
Studiul clampului hiperglicemic a relevat că rata de perfuzie a glucozei (GIR) și raportul de stimulare a insulinei la șoarecii DIO tratați cu atorvastatină au fost semnificativ mai mari decât șoarecii martor (P
fundal
Statinele sunt inhibitori puternici ai biosintezei colesterolului. Această clasă de agenți a fost utilizată ca agenți de modificare a lipidelor și prezintă efecte benefice asupra reducerii riscurilor cardiovasculare [1-3]. Între timp, deoarece riscurile bolilor cardiovasculare sunt crescute în diabetul zaharat de tip 2 [4], terapia cu statine este indicată la sindromul metabolic și la pacienții diabetici cu risc cardiovascular [5, 6].
Astfel, dacă terapia cu statine afectează dezvoltarea diabetului și ce aspect al diabetului îl va afecta este fascinant. Factorii patologici, cum ar fi rezistența la insulină și eșecul celulelor β, trebuie luați în considerare. Pe de o parte, studii recente au arătat că efectele benefice ale atorvastatinei asupra rezistenței la insulină s-au datorat scăderii inflamației [7]. Pe de altă parte, masa funcțională a celulelor β a fost extinsă cu atorvastatină la rozătoarele neonatale [8]. Cu toate acestea, dacă funcția celulei β va fi afectată este o preocupare. Un studiu clinic al studiului DIATOR a arătat că atorvastatina a fost eficientă în încetinirea declinului funcției celulelor beta [9]. În plus, riscul de diabet a fost redus cu 30% în studiul WOSCOPS [10]. Prin urmare, am emis ipoteza că statina ar afecta pozitiv funcția celulelor β.
Mulți factori contribuie la disfuncția celulelor β, cum ar fi stresul ER și disfuncția mitocondrială. Se raportează că stresul ER joacă un rol esențial atât în rezistența la insulină, cât și în eșecul celulelor β. Markerii stresului ER sunt crescuți în ficat și țesutul adipos în formele de obezitate induse de dietă și acțiunea insulinei este interferată [11]. Întrucât ER servește ca fabrică de proteine pentru insulină [12], cererea mai mare de biosinteză și secreție de insulină cauzată de supra-nutriția pe termen lung va provoca probabil stres ER și va duce treptat la eșecul celulelor β [13]. Dovezile corelației dintre stresul ER și diabetul provin, de asemenea, din observațiile că oamenii și șoarecii care au mutații în markerii de stres ER ai protein kinazei ARN-dublu catenar (PERK) și eIF2α sunt sever diabetici [14, 15]. Insulele șoarecilor diabetici db/db prezintă o fosforilare eIF2α crescută și o reglare crescută a ATF4 și CHOP, indicând prezența stresului ER [16]. Deoarece atorvastatina a arătat efecte benefice asupra îmbunătățirii sensibilității la insulină, am emis ipoteza că sarcina ER pentru insulina secretă a fost redusă și stresul ER ar putea fi atenuat.
În studiul nostru, am folosit șoarecii obezi C57BL/6 J rezistenți la insulină pentru a evalua efectele atorvastatinei asupra funcției celulelor β, apoptozei celulelor β și stresului ER. Se arată că șoarecii tratați cu atorvastatină au profiluri lipidice îmbunătățite, sensibilitatea celulelor β la glucoză, proliferarea celulelor β și starea de stres ER ameliorată comparativ cu șoarecii martor. Atorvastatina a protejat, de asemenea, linia celulară NIT-1 β de apoptoza indusă de colesterol și de creșterea proteinei anti-apoptoză a Bcl-2. Luat împreună, tratamentul cu atorvastatină beneficiază de funcția celulelor β pancreatice prin proliferare îmbunătățită și stres ER atenuat.
Rezultate
Atorvastatina îmbunătățește sensibilitatea celulelor β la profilurile de glucoză și lipide ale șoarecilor obezi C57BL/6 J
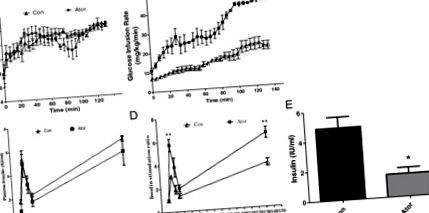
Folosind clema hiperglicemiantă, am examinat funcția celulei β. Concentrații relativ similare de glucoză din sânge de
14 mmol/l de stări de echilibru au fost realizate cu 135 de minute de perfuzie de glucoză în ambele grupuri (Figura 1A). În grupul tratat cu atorvastatină, GIR care simbolizează metabolismul glucozei a fost crescut de aproximativ 2 ori (46,0 ± 1,8 mg/kg/min) comparativ cu grupul martor (20,8 ± 2,2 mg/kg/min, P Figura 1
Am examinat în continuare profilurile lipidice ale șoarecilor tratați cu atorvastatină. În ziua 58, TG plasmatic și pancreas TG au fost diminuate în mod evident (P Tabelul 1 Nivelurile de lipide din plasmă și pancreas la șoareci C57 la sfârșitul tratamentului cu atorvastatină în ziua 58
Atorvastatina crește greutatea pancreasului și indicele de greutate și ajută la îmbunătățirea zonei celulelor β cu insulină pozitivă
Am examinat în continuare greutatea pancreasului și am calculat indicele greutății pancreasului. Greutatea pancreasului a fost mult mai mare în grupul cu atorvastatină decât în grupul martor (Tabelul 2, P 2 vs. martorul 21337,9 ± 3151,8 μm 2, P Tabelul 2 Efectele atorvastatinei asupra pancreasului/indicele de greutate al șoarecilor C57 la sfârșitul experimentului
Atorvastatina reglează în sus expresia genei Pdx-1 și LXR-β și suprimă stresul ER prin reglarea descendentă a căii peIF2α-ATF4-CHOP
Pentru a determina dacă există un mecanism specificat al efectelor atorvastatinei, am examinat expresia genei pancreasului. Pdx-1, o moleculă critică pentru proliferarea celulelor pancreatice și a receptorului ficatului X β (LXR-β), care joacă un rol crucial în controlul metabolismului lipidic, a fost semnificativ reglată în sus de atorvastatină (Figura 3A, Figura 3)
Atorvastatina crește supraviețuirea celulelor NIT-1 sub apoptoză indusă de încărcarea colesterolului
Deși efectul proliferativ a fost prezentat după tratamentul cu atorvastatină, rămâne neclar dacă expansiunea celulelor β s-a datorat și scăderii apoptozei. Astfel, am investigat dacă atorvastatina modulează răspunsul apoptotic în linia celulară β pancreatică NIT-1. În primul rând, am examinat dacă atorvastatina afectează viabilitatea celulară a celulelor NIT-1. Rezultatele au arătat că nu s-au exercitat efecte adverse asupra viabilității celulelor NIT-1, iar atorvastatina 10 -7 M-10 -5 M a crescut semnificativ viabilitatea celulelor NIT-1 (Figura 4A). Acest efect proliferativ la concentrație ridicată corespunde cu creșterea suprafeței de celule β observată la șoareci C57. Tratamentul cu 0,125 mM colesterol timp de 12 ore a redus viabilitatea celulelor NIT-1 cu 67% (Figura 4B, P -9 -10 -5 M) a îmbunătățit viabilitatea celulelor NIT-1 tratate cu 0,125 mM colesterol într-o manieră dependentă de doză ( P -9 -10 -7 M, P -6 -10 -5 M, Figura 4B). Viabilitățile celulelor NIT-1 tratate cu 10 -9 M și 10 -5 M atorvastatină au fost cu 163% și 219% mai mari decât celulele NIT-1 tratate numai cu colesterol. Analiza de citometrie în flux a arătat în continuare că celulele NIT-1 tratate cu colesterol au avut o rată apoptotică de 33 ± 2,1%, care a fost redusă la 24 ± 3,8% cu tratamentul cu atorvastatină 10 -8 M (P Figura 4
Discuţie
În acest studiu, au fost investigate efectele tratamentului cu atorvastatină asupra funcției celulelor β pancreatice la șoarecii obezi C57BL/6 J și posibilul său mecanism. După 58 de zile de tratament, GIR și raportul de stimulare a insulinei la șoarecii tratați cu atorvastatină au fost îmbunătățiți comparativ cu șoarecii martor. Mai mult, acești șoareci au avut o suprafață mai mare a celulelor β cu insulină pozitivă. În plus, markerii de stres ai pancreasului au fost reglementați în jos. Rezultatele in vitro sugerează un rol protector al atorvastatinei împotriva apoptozei induse de colesterol a celulelor NIT-1. Toate rezultatele indică efectele benefice ale atorvastatinei asupra funcției celulelor β.
Clampul hiperglicemic sa dovedit a fi o tehnică fiabilă de evaluare a sensibilității celulelor β la glucoză [17]. Deoarece nivelul de glucoză este menținut constant, rata de perfuzie a glucozei este un indice al metabolismului glucozei. Defectul fazei inițiale a secreției de insulină este cea mai timpurie anomalie detectabilă în diabetul zaharat. Raporturile de stimulare a insulinei din prima și a doua fază au fost ameliorate după tratamentul cu atorvastatină, indicând o funcție a celulelor β conservate.
Până în prezent, mulți cercetători au arătat că efectele benefice ale atorvastatinei asupra rezistenței la insulină se datorează ameliorării inflamației [7, 18, 19]. În testul cu clamp hiperglicemic, insulina la 0 min în grupul cu atorvastatină a fost semnificativ mai mică (șoarecii p +/- au arătat toleranța la glucoză și secreția de insulină înrăutățită, iar insulele au fost mai susceptibile la apoptoză [21].
Un alt motiv posibil pentru funcția de celule β conservate ar putea fi îmbunătățirea funcției endoteliale. Endoteliul insulelor joacă un rol important în furnizarea de oxigen și substanțe nutritive celulelor endocrine, trecerea trans-endotelială rapidă a insulinei secretate în circulație și reglarea și reglarea glicemiei [22, 23]. Disfuncția endotelială a fost demonstrată la pacienții cu diabet zaharat de tip 1 și tip 2. Controlul metabolic îmbunătățit la pacienții cu diabet zaharat este asociat cu restabilirea aproape a funcției endoteliale [24]. Deoarece statinele s-au dovedit a crește expresia eNOS și iNOS [25, 26] și pot crește producția de NO care duce la relaxare vasculară. Prin urmare, funcția endoteliului poate fi îmbunătățită. S-a raportat că atorvastatina îmbunătățește regenerarea masei celulare β datorită creșterii celulelor endoteliale intro-insulă [8].
Ca asociere puternică între stresul ER și diabetul [27, 28], am investigat în mod specific dacă atorvastatina și-a exercitat efectul asupra celulelor β pancreatice prin modularea stresului ER. Odată ce stresul ER este prezent, EPU va fi declanșat pentru a face față condițiilor de stres. Există trei proteine sensibile, care necesită inozitol 1α (IRE1α), PERK și factorul de transcripție activant 6 (ATF6) [29]. În ceea ce privește calea PERK, PERK fosforilează eIF2α, iar acest lucru va determina o traducere mai eficientă a ATF4. Chop este proteina din aval a căii PERK - eIF2α - ATF4 și induce în principal apoptoza cauzată de stresul ER în EPU [30]. Mai mult, șoarecii Chop -/- au îmbunătățit controlul glicemic și au extins masa celulelor beta [31]. În acest studiu, am constatat că calea eIF2α - ATF4-Chop a fost refuzată după tratamentul cu atorvastatină. Cu toate acestea, dacă sunt implicate căile ATF6 și IRE1α, trebuie studiat în continuare.
Modelul de apoptoză indusă de colesterol al celulelor NIT-1 ne oferă un instrument de investigare a efectelor atorvastatinei. Recent, colesterolul a fost implementat pentru a induce stresul ER și apoptoza la macrofage [32]. Deoarece diabetul de tip 2 este însoțit de inflamație, am mimat starea de stres ER încărcând colesterolul pe celulele NIT-1. Am constatat că colesterolul a suprimat viabilitatea celulelor NIT-1, care a fost atenuată de atorvastatină într-o manieră dependentă de doză. Testul de citometrie în flux a demonstrat în continuare că atorvastatina ameliorează apoptoza indusă de colesterol a celulelor NIT-1. Sa demonstrat că CHOP reglează în jos proteina anti-apoptotică a Bcl-2 [33], expresia conservată a Bcl-2 în celulele NIT-1 este în concordanță cu depresia expresiei CHOP în pancreas. În plus, atorvastatina singură nu a afectat negativ viabilitatea celulei NIT-1 și a crescut viabilitatea la concentrații mari. Acest rezultat ar putea interpreta aria crescută a celulelor β pozitive pentru insulină observată la șoarecii C57.
Cu toate acestea, unele studii clinice au relevat deteriorarea metabolismului glucozei statinelor [6]. Și FDA a extins sfaturile cu privire la riscurile statinice ale posibilității de a dezvolta diabet de tip 2. Posibilitatea ca pacienții care suferă de boli cardiovasculare să aibă deja un risc crescut de a dezvolta diabet nu poate fi expulzată. O altă explicație este că terapia agresivă pe termen lung cu statine ar putea induce efecte adverse.
În acest studiu, a fost utilizată o doză agresivă de atorvastatină. Doza de 30 mg/kg/zi de atorvastatină la șoareci este echivalentă cu 170 mg/zi la un om de 70 kg, calculată pe baza suprafeței corpului (ASB) [34, 35]. Aceasta este mai mult decât cea mai mare doză de 80 mg/zi recomandată. Pentru adulții cu diabet, Asociația Americană pentru Diabet recomandă utilizarea agresivă a statinei în tratamentul dislipidemiei diabetice [36]. În studiul REVERSAL, scăderea agresivă a lipidelor cu atorvastatină (80 mg/zi) a arătat efecte benefice asupra opririi progresiei aterosclerozei (-0,4%) comparativ cu valoarea inițială, iar efectul a fost superior simvastatinei 40 mg [37]. Între timp, beneficiile antioxidante și antiinflamatorii ale atorvastatinei 80 mg au fost observate și în traseele MIRACL și ASAP [38, 39]. În plus, terapia cu scăderea lipidelor agresivă (80 mg/zi) și moderată (10 mg/zi) cu atorvastatină a fost comparată pe traseul DALI [40]. În consecință, TG de post a fost redus cu 35% cu terapia agresivă și cu 25% cu terapia moderată. Astfel, atorvastatina 80 mg/zi are efecte mai bune asupra modificărilor dosarului lipidic comparativ cu 10 mg/zi.
Concluzie
În concluzie, tratamentul șoarecilor obezi C57BL/6 J rezistenți la insulină cu atorvastatină prezintă un efect protector asupra funcției celulelor β pancreatice și acest lucru este legat de creșterea proliferării pancreasului și de scăderea stresului ER. Descoperirea noastră este de așteptat să ofere dovezi pentru o utilizare clinică mai bună și adecvată a atorvastatinei.
Metode
Celulele
Linia celulară β pancreatică NIT-1 a fost achiziționată de la ATCC (Manassas, VA) și cultivată în DMEM/F12 conținând 10% (v/v) ser fetal bovin (FBS) și 1% (v/v) antibiotice (100 U/ml penicilină și 0,1 mg/ml streptomicină) la 37 ° C într-o atmosferă umidificată conținând 5% CO2 [41].
Studii cu animale și cu cleme hiperglicemice
Toate animalele au fost manipulate în conformitate cu Standardele pentru animalele de laborator (GB14925-2001) și Ghidul privind tratamentul uman al animalelor de laborator (MOST 2006a) stabilite de Republica Populară Chineză. Cele două orientări au fost realizate în conformitate cu reglementările Comitetului instituțional de îngrijire și utilizare a animalelor (IACUC) și toate protocoalele animalelor au fost aprobate de IACUC.
Studii histologice
Probele de țesut pancreatic au fost fixate în formalină 10% peste noapte și apoi încorporate în parafină și secționate la o grosime de 7 μm. Secțiunile de țesut au fost deparafinizate și rehidratate secvențial în xilen, xilen/etanol și gradient etanol și apoi plasate în apă distilată timp de 10 min. Secțiunile de țesut pancreatic au fost apoi colorate cu hematoxilină și eozină (H&E) folosind protocoale standard.
Imunofluorescența
Secțiunile de țesut pancreatic încorporate în parafină au fost depilate cu xilen, rehidratate prin alcool gradient [43]. Secțiunile au fost spălate și incubate cu anticorp anti-insulină de șoarece (Santa Cruz Biotechnology, Santa Cruz, CA) și apoi IgG anti-șoarece de capră conjugat cu FITC (Zhongshan Jinqiao Co., Beijing, China). Imaginile au fost obținute folosind un microscop confocal cu scanare laser Leica TCS SP2 (Nikon) și analizate folosind software-ul Image pro plus 5.1 pentru analiza imaginilor (Media Cybernetics, Silver Spring, MD, SUA). În fiecare grup au fost incluse trei animale. Au fost analizate cel puțin trei secțiuni din fiecare animal. Pentru fiecare secțiune, a fost determinată aria celulei β-insulină pozitive din fiecare insulă și a fost calculată aria medie.
PCR cantitativ în timp real
ARN celular total a fost extras din țesutul pancreatic al șoarecilor C57BL/6 J folosind reactiv Trizol (Invitrogen, Carlsbad, CA). Reacțiile de transcriere inversă pentru prepararea ADNc-ului primului fir au fost efectuate folosind setul de sinteză ADN-ul VigoScript First Strand (Vigorous Biotechnology Beijing Co., Ltd.). RNase-Free DNase (Promega, Madison, WI) a fost utilizată pentru degradarea ADN-ului înainte de detectarea qPCR. PCR cantitativă în timp real (qPCR) a fost efectuată pe un sistem de PCR în timp real ABI 7000 (Applied Biosystems, Foster City, CA) utilizând kitul SYBR Premix Ex Taq (TakaRa, Japonia). Toate probele au fost analizate în triplicat și normalizate cu β-actină utilizată ca control intern. Secvențele de exemplu au fost după cum urmează: β-actină, 5'-AGAAGATCTGGCACCACACC 3 '(sens) și 5'-TACGACCAGAGGCATACAGG-3' (antisens); Pdx-1, 5'-CCCGAATGGAACCGAGCCT-3 '(sens) și 5'-CCCGAGGTCACCGCACAAT-3' (antisens); LXR-β, 5′-AAGGACTTCACCTACAGCAAGGA-3 ′ (sens) și 5 ′ - GAACTCGAAGATGGGATTGATGA-3 ′ (antisens).
Western blot
Omogenatele de țesut pancreatic au fost preparate în tampon de liză (50 mM Tris - HCI, 2% SDS și 10% glicerol) suplimentat cu un cocktail inhibitor de protează (Applygen Inc. Beijing, China) așa cum s-a descris anterior [44]. În plus, lizații celulari ai celulelor NIT-1 au fost preparați așa cum s-a descris anterior [45]. Proteinele au fost rezolvate prin SDS-PAGE și s-au efectuat teste de imunoblotare așa cum s-a menționat anterior [21]. Au fost utilizați următorii anticorpi (diluție 1: 1000, cu excepția cazului în care se indică altfel): eIF2α total (sc-11386, 1: 500), ATF4 (sc-200), PDX-1 (sc-25403) și CHOP (sc-575), Bcl-2 (sc-7382) (toate de la Santa Cruz Biotechnology), phospho-EIF2α (Ser51, 9721) (Cell Signaling Technology, Danvers, MA) și β-actină (Abmart, 1: 2000). Benzile de proteine au fost vizualizate prin chemiluminiscență (ChemiScope2850, CLiNX Science Instruments) și densitatea a fost analizată folosind software-ul Gel-Pro-Analyzer 3.1.
Analiza biochimică
Trigliceridele plasmatice (TG), pancreasul TG, colesterolul plasmatic (CHO) și pancreasul CHO au fost determinate prin metode colorimetrice enzimatice folosind truse comerciale (BioSino Inc., China). Insulina plasmatică a fost măsurată de ELISA (Alpco. Inc., SUA).
Testele de viabilitate celulară și apoptoză
Celulele NIT-1 au fost însămânțate într-o placă cu 96 de godeuri la 2,3 × 104 celule/godeu și cultivate în mediu DMEM/F12 suplimentat cu 10% FBS. Când celulele au atins confluența de 80%, au fost incubate cu colesterol solubil în apă 0,125 mM (Sigma-Aldrich, St. Louis, MO) timp de 12 ore în absența sau prezența atorvastatinei la o concentrație de la 10 la 9 până la 10 -5 M Ulterior, celulele NIT-1 au fost testate pentru viabilitate utilizând kitul CCK-8 (Laboratoarele Dojindo, Kumamoto, Japonia). Studiul a fost realizat de 3 ori cu 5 godeuri în fiecare grup. Pentru testele de apoptoză, celulele NIT-1 au fost însămânțate într-o placă cu 6 godeuri la o densitate de 4 × 105 celule/godeu. Când celulele au fost 80% confluente, au fost incubate cu 0,125 mM colesterol solubil în apă timp de 18 ore cu sau fără 10-8 M atorvastatină [46]. Apoi, celulele au fost digerate și fixate cu etanol 70% și incubate cu 50 μg/ml iodură de propidiu și 1 μg/ml RNază fără DNază. Celulele colorate au fost analizate pe un citometru de flux (Beckman-coulter, Brea, CA), iar numărul de celule apoptotice în stadiu târziu a fost analizat prin software-ul System II.
analize statistice
Datele au fost exprimate ca medie ± eroare standard a mediei (SEM). Datele obținute în prezentul studiu au fost analizate folosind un ANOVA. O valoare p
- Efect anti-obezitate la șoareci obezi C57BL6 induși în diete cu conținut ridicat de grăsimi Studiul unui nou extract din
- Efect anti-obezitate al cătinei (Hippohae rhamnoides L) asupra șoarecilor obezi C57BL6N induși de dietă
- Efectul antiobezității Codonopsis lanceolata la șobolani obezi induși cu diete bogate în calorii și grăsimi - PubMed
- Analiza compoziției corpului și modificările funcției căilor respiratorii la adulții obezi după dieta hipocalorică -
- Celulele Variabilitatea de exprimare a textului unic cu celulă gratuit implică funcția celulei HTML