Fernanda Antunes
I Departamento de Farmacologia, Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP, BR
Adolfo Garcia Erustes
I Departamento de Farmacologia, Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP, BR
Angelica Jardim Costa
I Departamento de Farmacologia, Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP, BR
Ana Carolina Nascimento
I Departamento de Farmacologia, Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP, BR
Claudia Bincoletto
I Departamento de Farmacologia, Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP, BR
Rodrigo Portes Ureshino
II Departamentul de Științe Biologice, Universitatea Federală din Sao Paulo, Diadema, SP, BR
Gustavo José Silva Pereira
I Departamento de Farmacologia, Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP, BR
Soraya Soubhi Smaili
I Departamento de Farmacologia, Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP, BR
Abstract
Autofagie: definiție și mecanisme
În ultimul deceniu, autofagia a atras o atenție considerabilă ca potențială țintă a agenților farmacologici sau a intervențiilor dietetice care inhibă sau activează acest proces pentru mai multe tulburări umane, inclusiv infecții și boli inflamatorii 22, neurodegenerare 23, boli metabolice și cardiovasculare 24, obezitate 25 și cancer 26, 27 .
Autofagie și cancer
Terapii cu autofagie și cancer
Deoarece autofagia poate inhiba dezvoltarea tumorii sau favoriza creșterea tumorii, progresia, invazia și rezistența la tratament, cercetătorii au propus că modularea autofagiei ar putea fi o nouă strategie terapeutică în tratamentul unor tumori maligne 28, 49, 50 .
Cum modulează restricția dietetică autofagia și terapia cancerului?
În studiile preclinice, s-a demonstrat că restricția dietetică (DR) prelungește durata de viață și reduce dezvoltarea bolilor legate de vârstă, cum ar fi diabetul, cancerul și bolile neurodegenerative și cardiovasculare 63. DR promovează modificările metabolice și celulare ale organismelor de la procariote la oameni, care permit adaptarea la perioade de disponibilitate limitată de nutrienți 64. Principalele modificări includ scăderea nivelului de glucoză din sânge și a semnalizării factorilor de creștere și activarea căilor de rezistență la stres care afectează creșterea celulară, metabolismul energetic și protecția împotriva stresului oxidativ, inflamației și morții celulare 64, 65. Înfometarea nutrienților activează, de asemenea, autofagia în cele mai multe celule și organe cultivate, cum ar fi ficatul și mușchiul, ca mecanism de adaptare la condițiile stresante 11, 66 .
Studiile demonstrează că intervențiile dietetice pot reduce incidența tumorii și pot potența eficacitatea chimioterapiei și radioterapiei în diferite modele tumorale, evidențiind manipularea dietetică ca un posibil adjuvant la terapiile standard pentru cancer 63, 65. Printre numeroasele regimuri de dietă care au fost evaluate, restricția calorică (CR) și postul sunt metodele care fac obiectul unei investigații intense în oncologie 63, 65, 67. CR este definit ca o reducere cronică a aportului caloric zilnic cu 20-40% fără apariția malnutriției și cu menținerea frecvenței mesei 68. În schimb, postul se caracterizează prin lipsa completă de alimente, dar nu și de apă, cu perioade intermediare de consum normal de alimente. Pe baza duratei, postul poate fi clasificat ca (i) postul intermitent (IF - de exemplu, postul alternativ de zi (≥16 ore) sau 48 ore de post/săptămână) sau (ii) postul periodic (PF - de exemplu, un minim de 3 zile de post la fiecare 2 sau mai multe săptămâni) 65. În acest articol, nu trecem în revistă studiile CR care au fost revizuite în altă parte 63, 68, 69; în schimb, ne concentrăm pe studii care utilizează protocoale IF ca adjuvant la tratamentul cancerului la animale și oameni.
Deși rezultatele combinării IF cu medicamente anticanceroase sunt încurajatoare, mecanismele moleculare nu sunt complet clare. Lee și colab. 81 a demonstrat că IF (post de 48 de ore) a redus nivelurile de glucoză și IGF-1 cu 60% și, respectiv, 70%, la un model animal cu cancer mamar. Într-un model de cancer de colon, IF a inhibat creșterea tumorii fără a provoca pierderea permanentă în greutate și a scăzut polarizarea M2 a macrofagelor asociate tumorii la șoareci. Datele in vitro au arătat inducerea autofagiei și reglarea descendentă a CD73, urmată de o scădere a adenozinei extracelulare și inhibarea polarizării M2 datorită inactivării JAK1/STAT3 82 .
Combinația de inhibitori ai IF și tirozin kinazei, cum ar fi erlotinib, gefitinib, lapatinib, crizotinib și regorafenib, a promovat inhibarea susținută a căii MAPK, ducând la efecte antiproliferative în modelele de celule de cancer mamar, colorectal și pulmonar, precum și la inhibarea tumorii creșterea într-un model in vivo de cancer pulmonar 77. Combinația dintre IF și inhibitorul multi-tirozin kinazei sorafenib a prezentat un efect aditiv în inhibarea proliferării celulelor hepatocarcinomului și a absorbției glucozei, precum și în reglarea descendentă a căii MAPK și a expresiei genice a BIRC5, DKK1, TRIB3 și VEGF, care sunt frecvent modificate în hepatocarcinom celule 72. În cancerul pancreatic, postul a crescut absorbția gemcitabinei datorită nivelurilor sporite ale transportorului său (hENT1), potențând astfel moartea celulară. Într-un model de cancer pancreatic cu xenogrefă, ciclurile de post și tratamentul cu gemcitabină au indus o reducere a creșterii tumorii cu peste 40% 74 .
tabelul 1
| Cancer de sân, cancer de prostată rezistent la hormoni, cancer de prostată recurent | Chimioterapie + dietă hipocalorică | În prezent recrutează participanți | > NCT01802346 |
| Cancer avansat de prostată metastatic | Chimioterapie + post și terapie nutrițională | În prezent recrutează participanți | > NCT02710721 |
| Cancerul de sân negativ HER2 | Chimioterapie + dieta care mimează postul | În prezent recrutează participanți | > NCT02126449 |
| Cancer mamar | Chimioterapie + post pe termen scurt (IF) | Dacă asocierea cu chimioterapie a fost bine tolerată, toxicitatea hematologică redusă la pacienții cu BC HER2-negativi și a indus, de asemenea, o recuperare mai rapidă a deteriorării ADN-ului în PBMC (celule mononucleare din sângele periferic) | > NCT01304251 (96) |
| Boala cancerului ginecologic (cancer ovarian și mamar) | Chimioterapie + post pe termen scurt | Finalizat, nu s-au raportat rezultate | > NCT01954836 |
| Cancer mamar | Chimioterapie + post pe termen scurt | Finalizat, nu s-au raportat rezultate | > NCT02379585 |
| Neoplasm malign | Postul pe termen scurt înainte de chimioterapia sistemică | Activ | > NCT01175837 |
| Neoplasm malign | Chimioterapie + post | Finalizat, nu s-au raportat rezultate | > NCT00757094 |
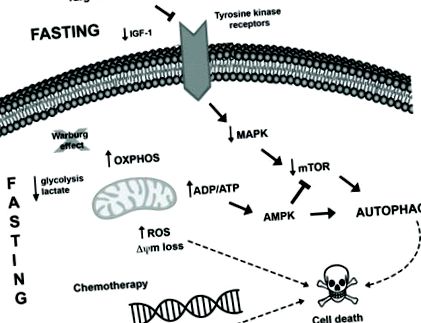
O altă strategie terapeutică farmacologică nouă care este investigată în prezent pentru tratarea cancerului este combinația de mimetice de restricție calorică (CRM) cu agenți citotoxici. CRM sunt compuși care au structuri chimice diferite și imită efectele biochimice și funcționale ale CR, cum ar fi activarea AMPK și inhibarea mTOR care conduc la inducerea autofagiei, epuizarea acetil-CoA și ATP și utilizarea redusă a glucozei, fără provocând disconfortul CR 88. Mai multe studii au demonstrat efectele de supresie tumorală ale agenților CRM, de exemplu, 2-deoxi-glucoză 89, metformină 90, 91, inhibitori mTOR 92, resveratrol 73, 93, hidroxicitrat 73, spermidină 73, 94 și compuși naturali precum curcumina 95, în combinație cu tratamente antitumorale în diferite modele de cancer. Conexiunile posibile între potențierea postului și a terapiei anticanceroase în celulele tumorale sunt rezumate în Figura 1 .
Mecanisme moleculare presupuse induse de post și tratament anticancer pentru a promova modificările intracelulare și inducerea autofagiei în celulele tumorale. I) Postul se poate opune efectului Warburg (descompunerea glucozei prin glicoliză chiar și în prezența oxigenului), favorizând fosforilarea oxidativă în celulele tumorale și rezultând o producție crescută de ROS și niveluri reduse de lactat și, eventual, de ATP. Creșterea raportului ADP/ATP poate activa calea AMPK, ducând la inducerea autofagiei. Mai mult, mediul stresant susținut poate duce la inducerea morții celulare. II) Mai multe tumori adăpostesc mutații care favorizează hiperactivarea căii MAPK, care permite creșterea, supraviețuirea și proliferarea celulelor tumorale. Terapiile care vizează această cale, precum și postul, pot duce la reglarea descendentă a acestei căi, alături de o reducere a activării AKT și mTOR, rezultând inducerea autofagiei și moartea celulară. III) În plus, postul potențează efectele dăunătoare ale chimioterapiei, cum ar fi deteriorarea ADN-ului, activând astfel aparatul de moarte celulară, dereglând proteinele pro- și antiapoptotice și inducând modificări mitocondriale și activarea caspazei, care la rândul său culminează cu apoptoza.
În această revizuire, am evidențiat conceptele de autofagie, în special în legătură cu tumorigeneză, precum și potențialul autofagiei ca țintă terapeutică în tratamentul diferitelor malignități. De asemenea, am subliniat posibilitatea utilizării manipulării dietetice ca modulator de autofagie, precum și o intervenție rentabilă pentru a crește răspunsul terapeutic în arena oncologică provocatoare. Mai mult, postul poate proteja celulele normale de toxicitatea agenților anticanceroși, reducând efectele secundare la pacienți și crescând efectele nocive ale chimioterapiei, radioterapiei și terapiei țintite asupra celulelor tumorale. Cu toate acestea, sunt necesare studii suplimentare pentru a înțelege mai bine mecanismele moleculare evocate prin post, cu scopul de a identifica contextul în care postul poate fi benefic ca adjuvant la tratamentul cancerului. Mai mult decât atât, cunoștințele suplimentare pot duce, de asemenea, la dezvoltarea de noi protocoale farmacologice care să reproducă efecte similare cu cele ale postului și sunt mai potrivite pentru diferiți pacienți oncologici.
CONTRIBUȚIILE AUTORULUI
Antunes F a contribuit la proiectarea studiului, a scris cea mai mare parte a studiului și a editat manuscrisul. Erustes AG, Costa AJ, Nascimento AC și Trindade CB au scris manuscrisul. Ureshino RP, Pereira GJ și Smaili SS au scris, proiectat și coordonat studiul și au editat și revizuit versiunea finală a manuscrisului. Toți autorii au examinat și aprobat versiunea finală a manuscrisului.
MULȚUMIRI
Autorii sunt recunoscători pentru sprijinul financiar acordat de Fundația Amparo à Pesquisa do Estado de São Paulo (FAPESP) (08/11515-3 și 13/20073-2 de către Smaili SS), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq ) și Ensino Superior Personality Training (CAPES).
Note de subsol
Nu a fost raportat niciun potențial conflict de interese.
- 10 Beneficii de sănătate bazate pe dovezi ale postului intermitent
- Cele mai eficiente metode de post intermitente - DefatX
- Abordarea limfocitozei - Consilier pentru tratamentul cancerului
- Potrivit unui nou studiu, postul dvs. intermitent nu este; t Făcând orice
- Cetuximab combinat cu Irinotecan în terapia de primă linie pentru cancerul colorectal metastatic (CRYSTAL