Obezitatea accelerează îmbătrânirea țesutului adipos, un proces care abia acum începe să iasă la lumină la nivel molecular. Experimentele la șoareci sugerează că obezitatea crește formarea speciilor reactive de oxigen în celulele grase, scurtează telomerii - și, în cele din urmă, are ca rezultat activarea supresorului tumorii p53, inflamația și promovarea rezistenței la insulină (paginile 1082–1087).
Deoarece tehnologia a îmbunătățit igiena, aprovizionarea cu alimente și nivelul de trai în general, a existat o creștere a bolilor legate de vârstă, cum ar fi bolile cardiovasculare, cancerul, bolile degenerative ale creierului și ale altor organe și tulburările metabolice, cum ar fi diabetul. Tulburările legate de vârstă au devenit răspândite în întreaga lume, înlocuind bolile infecțioase ca fiind principala cauză de deces în țările dezvoltate. Pe măsură ce îmbătrânim, mulți oameni dezvoltă sindromul metabolic, caracterizat prin obezitate centrală (viscerală), rezistență la insulină, toleranță afectată la glucoză sau diabet manifest, hipertensiune arterială, dislipidemie și complicații cardiovasculare.
Diabetul este, de asemenea, o cauză recunoscută a îmbătrânirii accelerate, dar mecanismele care leagă diabetul și îmbătrânirea nu sunt bine înțelese. Lucrare de la Minamino și colab. 1 în acest număr de Medicina naturii oferă informații despre modul în care obezitatea afectează îmbătrânirea țesutului adipos, influențând inflamația și homeostazia glucozei.
Obezitatea este o cauză majoră a rezistenței la insulină, care progresează către diabetul de tip 2 atunci când pancreasul nu este în măsură să producă cantități suficiente de insulină. În ultimii ani, au apărut dovezi că inflamația are un rol crucial în dezvoltarea rezistenței la insulină, diabet și boli cardiovasculare asociate cu obezitatea 2,3. Macrofagele se infiltrează în țesutul adipos în stările obeze, iar nivelurile de citokine sunt crescute și provoacă rezistență la insulină și diabet 2.3 .
Deteriorarea structurii și funcției organelor în timpul îmbătrânirii este asociată cu stresul oxidativ, instabilitatea genetică și perturbarea căilor homeostatice 4. O mulțime de cercetări privind îmbătrânirea au studiat telomerii, care sunt compuși din repetări în tandem ale secvenței TTAGGG și proteine asociate și sunt situate la capetele cromozomilor 5. Celulele stem și celulele canceroase sunt capabile să continue divizarea, deoarece telomerii sunt menținuți de o enzimă numită telomerază. În schimb, în celulele somatice normale, repetările telomerice se pierd cu fiecare ciclu celular până când se atinge o „lungime critică”. Scurtarea telomerilor duce la activarea supresoarelor tumorale, în special p53, care induce oprirea ciclului celular și îmbătrânirea.
Daunele genomice se pot acumula în timp și din speciile reactive de oxigen (ROS). Diabetul, printre alte boli legate de vârstă, este asociat cu incapacitatea de a detoxifica ROS 6. În mod similar, scurtarea telomerilor a fost legată de obezitate, rezistență la insulină, diabet și boala coronariană 7 .
Deoarece există similitudini în disregularea metabolică la îmbătrânire și obezitate, este probabil ca aceste condiții să aibă căi celulare similare. Pentru a testa această ipoteză, Minamino și colab. Am analizat țesutul adipos al șoarecilor obezi pentru a evidenția stresul oxidativ, îmbătrânirea și inflamația. Țesutul adipos de la șoarecii agouti, care sunt obezi genetic, au avut niveluri mai ridicate de ROS și daune ADN decât șoarecii slabi atunci când ambele grupuri erau la o dietă normală timp de 20 de săptămâni 1. Țesutul adipos de la șoarecii agouti au prezentat caracteristici ale îmbătrânirii premature, cum ar fi o expresie mai mare a β-galactozidazei asociate senescenței, a p53 și a inhibitorului de kinază dependentă de ciclină 1A (Cdkn1a).
Cercetătorii au stabilit apoi dacă modificările legate de vârstă ale țesutului adipos au fost responsabile de rezistența la insulină 1. Țesutul adipos de la șoarecii agouti au exprimat, de asemenea, citokine proinflamatorii care atrag macrofagele către țesutul adipos, factorul de necroză tumorală și proteina chimiotratantă monocită-1, care sunt asociate cu rezistența la insulină. Adiponectina, care îmbunătățește acțiunea insulinei, a fost suprimată în țesutul adipos de la șoarecii agouti.
Minamino și colab. 1 am propus că legătura dintre obezitate și îmbătrânire și metabolismul anormal a fost p53. Ei au descoperit că deficitul de p53 a scăzut inflamația și a îmbunătățit sensibilitatea la insulină la șoarecii obuti aguti pe o dietă obișnuită sau șoarecii obezi de tip sălbatic pe o dietă bogată în zahăr - bogată în grăsimi, comparativ cu șoarecii slabi de tip sălbatic 1. Toleranța la glucoză s-a îmbunătățit atunci când șoarecii fără p53 în țesutul adipos au primit un transplant de măduvă osoasă de la șoareci normali, indicând un rol cheie pentru macrofage în metabolismul glucozei. Mai mult, supraexpresia transgenică a p53 și Cdkn1a în țesutul adipos induse de inflamație și rezistență la insulină. Aceste rezultate sugerează că p53 este derivat din adipocite și macrofage și contribuie la îmbătrânirea țesutului adipos la animalele obeze.
Deoarece p53 este activat ca răspuns la telomerii scurtați în celulele în vârstă, Minamino și colab. 1 a investigat dacă lungimea telomerilor a afectat inflamația indusă de obezitate și rezistența la insulină. Șoarecii cărora le lipsește telomeraza (Tert) dezvoltă telomeri mai scurți cu generații de succes și în cele din urmă devin infertili până la a patra până la a șasea generație (G4 - G6). După cum era de așteptat, Minamino și colab. Am constatat că G4 Tert-șoarecii deficienți au avut leziuni crescute ale ADN-ului și o expresie ridicată a markerilor de seneză (de exemplu, β-galactozidaza asociată senescenței, p53 și Cdkn1a) în țesutul adipos. Autorii au detectat, de asemenea, cantități mari de senescență și markeri inflamatori în biopsiile de țesut adipos de la persoanele cu diabet în comparație cu persoanele fără diabet, sugerând că țesutul adipos este asociat cu un fenotip de îmbătrânire.
G4 Tert-șoarecii deficienți au prezentat semne de metabolism anormal: au fost mai predispuși la apariția intoleranței la glucoză și a rezistenței la insulină pe o dietă bogată în grăsimi - bogată în zahăr, comparativ cu șoarecii de tip sălbatic egali cu vârsta, care au o dietă similară 1. Macrofagele s-au infiltrat în țesutul adipos al G4 Tert-șoareci deficienți și au dezvoltat rezistență la insulină în ficat și, într-o măsură mai mică, în mușchi. Aceste efecte au fost independente de greutatea corporală.
Îndepărtarea chirurgicală a țesutului adipos a condus la îmbunătățirea metabolismului glucozei în G4 Tert-șoareci deficienți, în timp ce transplantul de G4 Tert-țesutul adipos deficitar în șoareci normali a indus rezistența la insulină, indicând faptul că îmbătrânirea țesutului adipos are o influență profundă asupra acțiunii insulinei în țesutul adipos și alte organe. Acest răspuns a fost atenuat când transplantul de țesut adipos atât în telomerază cât și în p53 a fost transplantat la șoareci normali, stabilind astfel o conexiune funcțională între disfuncția telomerilor și activarea p53.
Minamino și colab. 1 am căutat apoi o legătură între stresul oxidativ și îmbătrânirea și inflamația în țesutul adipos uman. Adipocitele umane primare tratate cu peroxid de hidrogen (H2O2), o sursă de ROS, au exprimat niveluri ridicate de p53 și citokinele proinflamatorii factor de necroză tumorală și proteina chimiotratantă monocitară-1, descoperind un mecanism molecular pentru deteriorarea metabolică din stresul oxidativ.
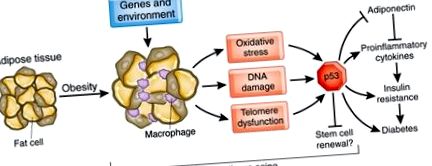
Aceste date oferă noi perspective asupra modului în care obezitatea promovează îmbătrânirea țesutului adipos și rezistența la insulină (Fig. 1). Obezitatea rezultată din factori genetici și de mediu, de exemplu, supranutriția, stimulează generarea ROS. Aceste molecule copleșesc probabil protecția antioxidantă din țesutul adipos, accelerând astfel deteriorarea ADN-ului și îmbătrânirea. Îmbătrânirea mediată de obezitate a țesutului adipos este, de asemenea, asociată cu scurtarea telomerilor, ceea ce duce la activarea p53. Aceste modificări declanșează răspunsuri inflamatorii în țesutul adipos și stimulează producția de citokine, care apoi conduc la rezistența la insulină local și sistemic (Fig. 1).
În stările obeze, țesutul adipos este supus stresului oxidativ, rezultând îmbătrânirea, acumularea de macrofage, producerea de citokine proinflamatorii și suprimarea adiponectinei. Activarea supresorului tumoral p53 este esențială în procesul de îmbătrânire, stimulează inflamația și, eventual, atenuează capacitatea de reînnoire a celulelor stem. Îmbătrânirea țesutului adipos induce rezistența la insulină în țesutul adipos, ficat și mușchi și mediază progresia către diabet.
Minamino și colab. 1 propun un model în care îmbătrânirea și inflamația sunt inițiate în țesutul adipos și ulterior induc rezistența la insulină în țesutul adipos, ficat și mușchi (Fig. 1). Cu toate acestea, ei nu au elucidat momentul acestor modificări ale obezității. Țesutul adipos comunică prin intermediul acizilor grași și o mulțime de factori circulanți cu creierul și alte organe 8, totuși studiul s-a concentrat exclusiv pe citokine proinflamatorii și adiponectină. Spre deosebire de accentul pus pe țesutul adipos, un scenariu mai probabil este că îmbătrânirea are loc la rate diferite în diferite organe și are efecte locale și îndepărtate asupra inflamației și sensibilității la insulină. Rezistența la insulină a ficatului este importantă în diabetul de tip 2 și crește producția de glucoză 9. Mușchiul scheletic este principalul organ responsabil de absorbția de glucoză mediată de insulină și acest lucru este tocit în timpul îmbătrânirii și obezității ca urmare a unei scăderi relative a masei musculare 9. Îmbătrânirea și obezitatea pot perturba producția de insulină de către pancreas 10. Mai mult, îmbătrânirea este asociată cu leziuni oxidative ale creierului și ar putea afecta secreția și sensibilitatea insulinei 11 .
O altă întrebare deschisă este dacă îmbătrânirea mediată de obezitate a țesutului adipos este reversibilă prin dietă și alte tratamente. Restricția calorică reduce îmbătrânirea și îmbunătățește homeostazia glucozei 12. Poate că tratamentul cu adiponectină ar putea reduce leziunile oxidative și inflamația țesutului adipos, așa cum s-a arătat în ficat și în vasele de sânge 8. Scăderea activității p53 este o strategie logică pentru încetinirea îmbătrânirii și inflamației și îmbunătățirea acțiunii insulinei, dar țesutul adipos și alte organe pot fi vizate în mod specific? Pot antioxidanții ameliora îmbătrânirea celulară, reducând astfel inflamația și sporind sensibilitatea la insulină? În cele din urmă, ar fi interesant să se studieze dacă supresorul tumorii p53 mediază anomaliile lipidelor și morbiditatea cardiovasculară asociate cu obezitatea. Opera lui Minamino și colab. 1 este un pas major către răspunsul la aceste întrebări.
Referințe
Minamino, T. și colab. Nat Med. 15, 1082–1087 (2009).
Hotamisligil, G.S. Natură 444, 860–867 (2006).
Xu, H. și colab. J. Clin. Investi. 112, 1821–1830 (2003).
Russell, S.J. & Kahn, C.R. Nat. Rev. Mol. Celulă. Biol. 8, 681–691 (2007)
Deng, Y. și colab. Nat. Rev. Cancer 8, 450–458 (2008).
Valko, M. și colab. Int. J. Biochem. Cell Biol. 39, 44–84 (2007).
- Grelină, obezitate și diabet Nature Reviews Endocrinology
- Fgr kinaza este necesară pentru activarea macrofagelor proinflamatorii în timpul obezității induse de dietă Nature
- Intervenția diabetului, plus vizitele la domiciliu crește pierderea în greutate la mamele cu supraponderalitate, obezitate
- Eficacitatea programelor de prevenire a diabetului și obezității la nivelul întregii populații O privire de ansamblu asupra sistematică
- Diabetul prin medicină naturală