Publicat: 12 aprilie 2020 (vezi istoricul)
DOI: 10.7759/cureus.7653
Citați acest articol ca: Malyshev Y, Syed A, Castillo R și colab. (12 aprilie 2020) Anevrismul gigantului stâng al arteriului coronarian principal prezentat ca șocuri multiple de defibrilator cardioverter implantabil. Cureus 12 (4): e7653. doi: 10.7759/cureus.7653
Abstract
Anevrismele uriașe ale arterei coronare principale stângi sunt una dintre cele mai rare descoperiri în cardiologie, întâlnite la mai puțin de 0,02% dintre pacienți. Prezentarea este de obicei aceeași cu boala coronariană, deoarece majoritatea anevrismelor coronare din lumea occidentală sunt asociate cu ateroscleroza. Aici raportăm primul caz de anevrism gigant al arterei coronare principale stângi care se prezintă ca tahicardie ventriculară cu șocuri multiple ale defibrilatorului la un bărbat de 57 de ani cu insuficiență cardiacă. De asemenea, examinăm etiologia, patologia și managementul anevrismelor coronariene.
Introducere
Anevrismele arterei coronare (CAA) sunt entități clinice foarte rare; printre acestea, anevrismele gigantice ale arterei coronare stângi (LMCAA) sunt extrem de rare, întâlnite la mai puțin de 0,02% dintre pacienți [1]. Etiologia CAA variază în funcție de vârstă, comorbidități și chiar zona geografică. Etiologia determină de obicei prezentarea și gestionarea. Aici raportăm un caz unic de LMCAA gigant la un bărbat în vârstă de 57 de ani cu insuficiență cardiacă cu fracție de ejecție redusă (HFrEF), care a prezentat departamentului nostru de urgență dureri toracice după ce defibrilatorul său cardioverter implantabil (ICD) a fost tras de 12 ori. Cateterizarea urgentă a diagnosticului a arătat LMCAA gigant fără semne de boală coronariană (CAD). Pacientul a fost inițiat cu terapie antiagregantă dublă. A rămas asimptomatic mai mult de un an. Revizuim, de asemenea, literatura actuală privind diferite modalități de diagnostic și diferite abordări de management ale CAA.
Prezentarea cazului
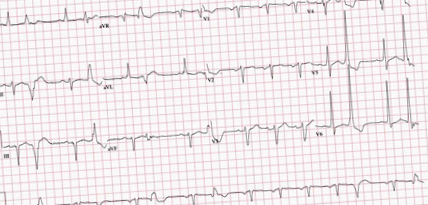
Un bărbat în vârstă de 57 de ani cu hipertensiune, diabet, obezitate și HFrEF a prezentat cu o zi înainte dureri toracice, palpitații și sincopă. ICD-ul său a tras de 12 ori. Vitaliile sale au fost remarcabile. Examenul fizic a fost semnificativ pentru pulsul neregulat. ECG a prezentat ritm sinusal normal cu complexe ventriculare premature frecvente și bloc fascicular anterior stâng (Figura 1).
Figura 1: ECG care prezintă ritm sinusal cu contracții ventriculare premature și bloc fascicular anterior stâng
Radiografia toracică era clară. Analiza sângelui a arătat creșterea enzimelor cardiace și a anomaliilor electrolitice, iar ecranul medicamentului a fost pozitiv pentru canabinoizi (Tabelul 1).
| Test | Rezultat |
| Troponină (ng/ml) | 2.14 |
| CPC (U/L) | 537 |
| pBNP (pg/mL) | 1860 |
| Potasiu (mEq/L) | 2.8 |
| ANA | Negativ |
| Anticorp anti-dsDNA (UI/ml) | 1 |
| pANCA (AU/mL) | Tabelul 1: Rezultate semnificative de laborator |
CPK, creatin fosfokinază; pBNP, peptidă natriuretică pro-creier; ANA, anticorp antinuclear; anti-dsDNA, anticorp ADN anti-dublu catenar; pANCA, anticorpi citoplasmatici antineutrofili perinucleari
Interogatoriul ICD a arătat că s-au administrat două șocuri pentru tahicardie ventriculară și 10 șocuri au fost inadecvate din cauza interferenței electromagnetice pe plumb. Ecocardiograma a relevat o fracțiune de ejecție de 10% -15% cu hipokinezie difuză (Video 1).
Video 1: Ecocardiograma care prezintă o funcție sistolică ventriculară stângă sever redusă, o fracțiune de ejecție de 10% -15% și hipokinezie difuză
Cateterizarea cardiacă de urgență nu a arătat nicio dovadă de CAD ocluziv. Cu toate acestea, a existat un LMCAA sacular mare care implică ostiul arterelor descendente anterioare stângi (LAD), circumflexul stâng (LCX) și ramus intermedius. Mărimea anevrismului a fost măsurată la 37,4 mm x 20 mm (Figura 2, Video 2). Prelucrarea autoimună a fost negativă (Tabelul 1).
Figura 2: Anevrism gigant al anevrismului coronarian principal stâng
A: vedere craniană oblică anterioară dreaptă; B: vedere caudală oblică anterioară dreaptă
Video 2: Angiogramă care prezintă anevrism gigant al arterei coronare principale stângi
Pacientul a început un tratament antiplachetar dublu cu aspirină și clopidogrel. Chirurgia CT a evaluat pacientul, dar nu a recomandat intervenția. Pacientul a avut implantarea cu succes a unui defibrilator cardioverter în timpul aceleiași internări. A fost văzut în DE un an mai târziu cu suspiciune de embolie pulmonară. Angiograma toracică CT a arătat că LMCAA are un diametru de 1,5 cm (Figura 3).
Figura 3: CT piept care prezintă anevrismul arterei coronare principale stânga (săgeată albă)
A: plan transversal; B: plan coronal
La două luni după vizita ED, a fost văzut în clinică fără simptome și ICD funcționa bine.
Discuţie
CAA este un segment al arterei cu lățimea mai mare decât lungimea și diametrul mai mare decât diametrul unui segment adiacent normal sau de 1,5 ori mai mare decât cel mai mare vas coronarian (Figura 4) [2,3].
Figura 4: Reprezentarea schematică a unui anevrism coronarian adevărat
CAA-urile sunt clasificate după cum urmează. Compoziția pereților: anevrismele adevărate au toate cele trei straturi ale pereților vaselor; pseudoaneurismele pierd unul sau două. Forma: CAA sacular diametrul transversal este mai mare decât diametrul longitudinal. Sunt adesea văzuți distal de stenoză și sunt mai predispuși la tromboză sau ruptură. Anevrismele fusiforme implică întreaga circumferință a vasului, au o măsurare longitudinală mai mare și nu au nicio relație cu stenoza. Dimensiune: mică (diametru 8 mm) [3].
Incidența variază de la 0,3% la 5,3% (medie de 1,65%). Bărbații au mai multe CAA decât femeile: 2,2% vs. 0,5%. Cele mai frecvente localizări sunt arterele coronare drepte (40% -70%), LCX (23,4%) și LAD (32,3%). Artera coronară principală stângă este afectată semnificativ mai puțin (0,1% -3,5%) (Figura 5) [4,5]. Prevalența CAA gigant într-o populație generală este de doar 0,02% [1].
Figura 5: Distribuția și frecvența anevrismelor arterei coronare
LM, artera coronară principală stângă; LAD, artera descendentă anterioară stângă; LCX, artera circumflexă stângă; RCA, artera coronară dreaptă
Etiologia CAA variază în funcție de vârstă și zonă geografică. Ateroscleroza este responsabilă pentru jumătate din CAA din Occident, urmată de anevrisme congenitale (17%) și infecțioase (10%). Boala Kawasaki este cauza dominantă a CAA în Japonia [3]. Tulburările inflamatorii și bolile țesutului conjunctiv sunt de obicei asociate cu ectazii și sunt mai frecvente la pacienții mai tineri [3]. Cauzele iatrogenice includ traumatisme din presiunea de umflare a balonului, intervenția în infarctul miocardic acut, utilizarea de antiinflamatoare nesteroidiene, steroizi și colchicină, care pot provoca vindecarea necorespunzătoare. Cocaina provoacă hipertensiune arterială severă și vasoconstricție, afectând astfel endoteliul și favorizând formarea CAA [6].
CAA-urile din CAD sunt considerate a fi cauzate de fluxul de sânge turbulent care dăunează peretelui [3]. Cu toate acestea, trebuie să existe și alți factori, deoarece majoritatea pacienților cu CAD nu dezvoltă CAA.
De obicei, pacienții sunt asimptomatici și majoritatea CAA se găsesc întâmplător. Prezentarea depinde de etiologie și/sau complicații. Complicațiile CAA includ embolizarea, ruperea, formarea fistulei, tamponarea, hemopericardul, disecția, vasospasmul și compresia vaselor [2,3].
Angiografia coronariană rămâne cea mai bună metodă de identificare a AAC [2]. Oferă informații despre locația, dimensiunea și forma CAA, dar vede doar lumenul vasului. Astfel, dimensiunea reală a CAA ar putea fi subestimată sau CAA poate fi ratată dacă trombul o închide [4]. Ecografia intravasculară corectează aceste limitări, oferind imagini transmurale și informații despre structura peretelui și compoziția luminală [4,7]. Angiografia coronariană CT oferă informații rapide despre locația CAA, forma, dimensiunea și compoziția pereților, dar nu există nicio opțiune de tratament. Angiografia CT este utilă la următorii pacienți cu CAA cunoscuți [4].
Gestionarea CAA depinde de prezentare, etiologie, dimensiune, localizare, infecție asociată și amploarea aterosclerozei [4]. La adulții cu CAD, trebuie începută reducerea medicală a factorilor de risc cardiovascular. Antiplachetele pe termen lung și potențialul anticoagulant ar trebui să înceapă deoarece tromboza și/sau embolia sunt preocupante [8]. Intervenția percutanată cu plasarea stentului se poate face în anevrism cu diametrul de până la 10 mm [9]. Chirurgia este indicată la pacienții care nu sunt candidați la intervenție percutanată, CAD obstructivă și anevrisme saculare mari cu risc de ruptură [4,10].
Concluzii
Primul caz de CAA a fost publicat în 1812. A fost găsit post-mortem după moarte subită. De atunci, înțelegerea noastră despre patologia, etiologia și progresia CAA s-a îmbunătățit. Astăzi putem găsi aceste anevrisme potențial mortale în timpul angiografiei de rutină, nu post-mortem. Cu toate acestea, managementul lor este încă dificil și trebuie adaptat în mod specific fiecărui pacient. Sunt necesare mai multe cercetări pentru a identifica pacienții care sunt expuși riscului de a diagnostica CAA mai devreme, de a o gestiona mai bine și de a preveni complicațiile.
- Model de diagnostic bazat pe microbiomi intestinali pentru a prezice jurnalul de boli ale arterelor coronare
- Analiza genetică a clinicii Cleveland leagă obezitatea de diabet, boala arterială coronariană; Cleveland
- Cafeaua, maté, açaí și fasolea sunt principalii factori care contribuie la capacitatea antioxidantă a brazilianului; s
- Calculii biliari și o dietă cu conținut scăzut de grăsimi Societatea de scleroză multiplă
- Celulele stem embrionare oferă o promisiune de tratament pentru scleroza multiplă - UConn astăzi