Date asociate
Disponibilitatea datelor și a materialelor
Seturile de date utilizate și/sau analizate în timpul studiului actual sunt disponibile de la autorul corespunzător, la o cerere rezonabilă.
Abstract
Introducere
Deteriorarea ADN-ului este un factor etiologic important în cancerul pulmonar (1) și există diferite tipuri de leziuni ale ADN-ului, inclusiv modificări ale nucleotidelor (deleții, inserții și substituții ale nucleotidelor), pauze cu un singur fir și pauze cu două fire (2). Când apare deteriorarea ADN-ului, se activează un set de căi de reparare a ADN-ului (3-5). Dintre aceste căi, calea de reparare a exciziei de bază (BER) este responsabilă pentru repararea majorității daunelor ADN cauzate de alchilare și stres oxidativ (4,6).
Endonucleaza 1 apurinică/apirimidinică (AP) 1 (APE1), cunoscută și sub numele de APE, APEX și Ref-1, este o proteină multifuncțională omniprezentă, care este asociată cu activitățile BER și redox. APE1 este o enzimă care limitează viteza în calea BER (7-9). Când apare deteriorarea bazei, glicozilazele din celulă excizează baza deteriorată pentru a genera un site AP sau abasic. Spre deosebire de alte glicozilaze, APE1 este singura enzimă care poate procesa situl abasic al BER; APE1 hidrolizează coloana vertebrală a fosfodiesterului 5 'către locul AP, creând un capăt normal de 3' hidroxil și un capăt de fosfat de dezoxiriboză 5 '. În timpul acestui proces, APE1 recrutează, de asemenea, diverse polimeraze și ligase pentru a participa la reparații. APE1 de mamifere afectează, de asemenea, numeroși factori de transcripție a ADN-ului, inclusiv factorul inductibil al hipoxiei (HIF) -1α, proteina activatoare (AP) -1, factorul nuclear (NF) -κB și p53 (10) și, prin aceasta, contribuie indirect la repararea ADN-ului.
APE1 este singura proteină de reparare a ADN cunoscută ca având activitate de reglare redox (8,10) și este responsabilă pentru 95% din activitatea endonucleazei celulare (7,8). APE1 este capabil să regleze starea reducătoare a reziduurilor de aminoacizi la siturile cheie ale factorilor de transcripție și, prin urmare, participă la diferite evenimente celulare de bază, inclusiv proliferarea, diferențierea, apoptoza și transformarea. Nivelurile de expresie, localizarea subcelulară aberantă și modelele de modificare post-translațională a APE1 au fost implicate în chimioterapie și radiorezistență (11,12) și sunt asociate cu prognostic slab în numeroase tipuri de cancer, inclusiv cancerul pulmonar cu celule mici. (NSCLC) (13-22). Autoanticorpul seric APE1 a fost propus ca un potențial marker tumoral și predictor al răspunsurilor la chimioterapie la pacienții cu NSCLC (23).
Citometrie de flux și analiză a ciclului celular
Celulele au fost resuspendate în RPMI-1640 la o densitate de 3 × 105 celule/godeu în plăci cu 6 godeuri (Costar; Corning Incorporated). Expunerea la medicament a fost efectuată după cultivare timp de 24 de ore și la 1% FBS. Celulele H1975 au fost tratate cu BFD (0-30 mg/ml) sau MBFD (0-15 mg/ml) timp de 24 de ore; Celulele H292 au fost tratate cu BFD (0-30 mg/ml) sau MBFD (0-20 mg/ml) timp de 24 de ore la 37 ° C într-o atmosferă conținând 5% CO2. Celulele au fost apoi colectate, fixate cu etanol rece 75% și depozitate la -20 ° C timp de ≥24 ore. Ulterior, după spălarea de două ori cu PBS rece, celulele au fost incubate cu tampon de colorare cu iodură de propidiu (PI)/RNază (BD Biosciences, San Diego, CA, SUA) timp de 15 minute la temperatura camerei. Conținutul ADN a fost analizat prin citometrie în flux folosind BD Accuri C6 (versiunea 1.0.264.15; BD Biosciences). Procentul de celule din diferitele faze ale ciclului celular a fost determinat folosind software-ul ModFit LT 4.1 (BD Biosciences).
Testul de colorare a anexinei V/PI
Colorarea anexinei V/PI a fost efectuată folosind un kit de detectare a apoptozei (Dojindo Molecular Technologies, Inc., Kumamoto, Japonia). După tratament, celulele au fost colectate și dizolvate în 100 μl tampon de legare a anexinei V (5 × 105 celule/ml). La 100 ofl din fiecare probă, s-au adăugat 5 Annexin Annexin V și 5 pl PI, iar probele au fost incubate timp de 15 min la temperatura camerei. Analiza apoptozei a fost efectuată folosind BD Accuri C6. Celulele anexin V-negative/PI-negative au fost identificate ca celule viabile, anexina V-pozitive/PI-negative au fost recunoscute ca celule apoptotice timpurii, iar anexina V-pozitive/PI-pozitive au fost identificate ca celule apoptotice tardive/moarte.
Testul cometei
Celulele au fost suspendate în PBS 1X răcit cu gheață (Ca 2+ - și Mg 2+ -free) la o concentrație de 2 × 105 celule/ml. Rupturile de catenă de ADN au fost evaluate utilizând kitul Trevigen CometAssay ® (Trevigen, Gaithersburg, MD, SUA). Celulele (2 × 105 celule/ml) au fost amestecate cu LMAgaroză topită la un raport de volum de 1:10 și amestecul a fost răspândit imediat uniform pe lamele de cometă, care au fost incubate la 4 ° C în întuneric timp de 10 min. Diapozitivele au fost apoi transferate într-o soluție de liză preîncălzită timp de 60 de minute la 4 ° C.
Pentru testul de cometă alcalină, lamele au fost incubate în 300 mM NaOH conținând 1 mM EDTA (pH> 13) timp de 20 min la temperatura camerei în întuneric și au fost electroforizate la 1 V/cm și 300 mA timp de 40 min. După clătire extinsă, lamelele au fost incubate în etanol 70% timp de 5 minute și uscate. În cele din urmă, ADN-ul a fost colorat cu colorant SYBR-Green I (1: 10.000 în tampon Tris-EDTA, pH 7,5; Trevigen) timp de 20 minute la 4 ° C. Imaginile au fost capturate cu ajutorul unui microscop cu fluorescență (TCS SP5; Leica Microsystems GmbH, Wetzlar, Germania).
Pentru testul cometei neutre, probele au fost scufundate în 50 ml tampon de electroforeză neutră 1X timp de 30 min la 4 ° C, separate prin electroforeză la 1 V/cm timp de 40 min și transferate în soluția de precipitare ADN timp de 30 min la temperatura camerei. După uscare, ADN-ul a fost colorat cu colorant SYBR-Green I (1: 10.000 în tampon Tris-EDTA, pH 7,5; Trevigen) timp de 20 minute la 4 ° C. Imaginile au fost capturate cu ajutorul unui microscop cu fluorescență (TCS SP5; Leica Microsystems GmbH).
Analiza cometei
Procentul de ADN din coadă (procentul de ADN celular total găsit în coadă) și momentul cozii (cantitatea de ADN din coadă combinată cu distanța de migrare) sunt descriptori obișnuiți ai deteriorării ADN determinate de cometa alcalină și cometa neutră teste, respectiv. Cel puțin 50 de celule selectate aleatoriu au fost analizate pentru fiecare diapozitiv folosind software-ul de analiză a imaginii TriTek CometScore ™ Freeware v1.5 (TriTek Corporation, Sumerduck, VA, SUA).
ARN interferent (si) mic și transfecție plasmidică
Izolarea ARN-ului, reacția în lanț a polimerazei (PCR) și analiza PCR (RT-qPCR) cantitativă cu transcripție inversă
Analiza Western blot
Probele (15 μg proteine) au fost separate cu 12% SDS-PAGE și au fost transferate în membrane difluorură de poliviniliden (EMD Millipore). Membranele au fost apoi blocate cu lapte degresat 5% timp de 1 oră la temperatura camerei și au fost incubate cu anticorp APE1 (ab92744; diluare, 1: 20.000; Abcam, Cambridge, MA, SUA) peste noapte la 4 ° C. Membranele au fost spălate cu soluție salină tamponată cu Tris conținând 0,05% Tween și au fost apoi incubate cu anticorp secundar conjugat cu peroxidază de hrean (nr. Cat. 129736; diluare, 1: 10.000; ZSGB-BIO Co., Ltd, Beijing, China) pentru 1 h la temperatura camerei. În cele din urmă, petele au fost vizualizate folosind chemiluminiscență (EMD Millipore). β-actina (# 4790; diluare, 1: 10.000; Cell Signaling Technology, Inc.) a fost utilizată ca control al încărcării. Analiza semicantitativă a petei a fost efectuată utilizând ImageJ2x (National Institutes of Health, Bethesda, MD, SUA). Concentrația de proteine a fost determinată utilizând metoda acidului bicinchoninic înainte de Western blot.
Model de xenogrefă de șoarece nud
Șoareci femela BALB/c nud (n = 50; vârstă, 6-8 săptămâni; greutate, 22 g; National Institutes for Food and Drug Control, Beijing, China) au fost găzduiți în dulapuri controlate de mediu (temperatură, 23 ± 2 ° C; Cicl de 12 ore de lumină/întuneric; umiditate relativă, 50%; hrană normală și apă) în condiții specifice fără patogeni timp de 7 zile înainte de experimentare. Protocoalele au fost efectuate în conformitate cu orientările SUA privind bunăstarea animalelor (40), iar prezentul studiu a fost aprobat de Comitetul instituțional de îngrijire și utilizare a animalelor din primul spital afiliat la spitalul general PLA. Celulele H1975 (densitate 3 × 106) au fost suspendate în PBS rece amestecat cu Matrigel (BD Biosciences) la un raport de volum de 1: 1 și au fost inoculate subcutanat în flancul drept al șoarecilor goi.
Greutatea șoarecilor purtători de tumori a fost măsurată și volumul tumorii a fost calculat conform următoarei formule: Volumul tumorii (mm 3) = (lungime × lățime 2)/2. Doza zilnică pentru experimentele cu șoareci goi (BFD și MBFD la 15,17 și respectiv 24,42 g/kg) s-a bazat pe utilizarea umană (1,23 și respectiv 1,98 g/kg), așa cum s-a descris anterior (41). Când volumul tumorii a atins 50-100 mm 3, șoarecii au fost împărțiți în mod aleatoriu în cinci grupuri (n = 10/grup): martor, BFD (30 g/kg), BFD (60 g/kg), MBFD (48 g/kg) și MBFD (96 g/kg). Medicamentele au fost administrate oral de două ori pe zi timp de 21 de zile consecutive. După 21 de zile, șoarecii au fost sacrificați. Probele de sânge (0,5 ml) au fost colectate din venele fos orbitale în tuburi de polietilenă heparinizate. Tumorile au fost rezecate și cântărite după sacrificarea șoarecilor. Țesuturile tumorale au fost fixate în formalină și în tampon de lizat PIPA rece ca gheața pentru detectarea proteinelor.
Test ELISA
Concentrația de proteine a APE1 a fost determinată în probe de plasmă de șoarece folosind un kit ELISA comercial (Beijing Keyingmei Technology, Beijing, China). Probele de sânge (0,5 ml) au fost colectate din venele fos orbitale în tuburi de polietilenă heparinizate. După plasare la 4 ° C timp de 2 ore și centrifugare la 2.500 rpm timp de 15 minute, supernatantul a fost colectat într-un tub nou pentru ELISA.
analize statistice
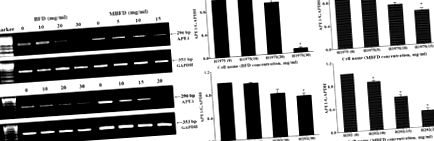
BFD și MBFD inhibă expresia mRNA APE1 în celulele H1975 și H292. (A) PCR și (B) analiza PCR cantitativă a nivelurilor de expresie mARN ale APE1. * P Fig. 5, tratamentul cu BFD sau MBFD a scăzut expresia proteinei APE1 în celulele H1975 și H292. În celulele H1975, nivelurile de expresie a proteinei APE1 au fost reduse cu 11,53, 24,65 (P Fig. 6A). Rata de inhibare a creșterii tumorii a fost de 31,97% după tratamentul cu BFD (30 g/kg), 36,60% după tratamentul cu BFD (60 g/kg), 37,57% după tratamentul cu MBFD (48 g/kg) și 52,92% după tratamentul cu MBFD (96 g/kg) (Fig. 6B). Nu au existat diferențe semnificative în greutatea corporală între grupurile de tratament la sfârșitul experimentului (Fig. 6C). Modificările greutății tumorii au fost în concordanță cu cele din volumul tumorii (Fig. 6D).
Discuţie
Potrivit TCM, BFD suplimentează Qi, elimină căldura și hrănește plămânii și se crede că tratează simptomele cauzate de insuficiența pulmonară-Qi și de leziunea pulmonară endogenă indusă de căldură. Studiile anterioare privind aplicarea BFD în cancerul pulmonar au indicat că BFD poate fi benefică în reducerea simptomelor asociate cancerului pulmonar și îmbunătățirea QOL a pacienților cu cancer pulmonar avansat (42,43). Difuzia hediotică, Duchesnea și Scutellaria barbata sunt întotdeauna adăugate în aplicația MBFD. Un studiu anterior privind Milkvetch și Codonopsis a demonstrat că Milkvetch poate induce diferențierea celulelor tumorale și moartea (44). Mai mult, conform TCM, difuza hedyotică, Duchesnea și Scutellaria barbata prezintă funcții de curățare a căldurii și detoxifiere, iar Scutellaria barbata posedă proprietăți antitumorale. Se crede, de asemenea, că Scutellaria barbata poate servi un rol de consolidare a Qi-ului vital pentru a elimina factorii patogeni; s-a sugerat că în cancerul avansat o combinație de medicamente care întăresc Qi-ul vital și medicamentele antitumorale poate fi benefică.
În special, MBFD a prezentat un efect antitumoral mai bun comparativ cu BFD in vivo și in vitro. O posibilă explicație poate fi faptul că, din moment ce MBFD conținea mai multe difuze Hedyotic, Duchesnea și Scutellaria barbata decât BFD, activitățile farmacologice ale acestor trei plante au avut un rol central în îmbunătățirea efectelor antitumorale. Din punct de vedere clinic, pacienții cu cancer care au primit medicamente chineze au fost în mare parte incapabili să primească chimioterapie sau terapie țintită din cauza stării lor de sănătate slabă. Prezentul studiu a indicat faptul că MBFD a întărit efectele antitumorale ale BFD, care oferă dovezi care sugerează că MBFD poate fi aplicat pentru a trata pacienții cu cancer.
În concluzie, prezentul studiu a demonstrat că BFD și MBFD exercită efecte inhibitoare asupra creșterii NSCLC; aceste efecte antitumorale pot fi asociate cu inhibarea APE1. Aceste rezultate au sugerat că BFD și MBFD pot fi considerate tratamente promițătoare pentru NSCLC; în special, MBFD a prezentat un efect antitumoral mai puternic fără a afecta greutatea corporală și activitățile șoarecilor. Mai mult, prezentul studiu a furnizat dovezi care sugerează că APE1 poate fi un factor țintă pentru tratamentul NSCLC cu TCM.
- Capsule polimerice multistrat biodegradabile pentru terapia cancerului pulmonar Materiale aplicate ACS &
- Boswellia Serrata (tămâie) antiinflamator; Dieta luptătorului împotriva cancerului împotriva bolii
- Cele mai bune 10 exerciții pentru creșterea capacității pulmonare
- O abordare echilibrată a cancerului de sân Annapolis BeBalanced Hormone Centri de pierdere în greutate
- 4 Supraviețuitorii cancerului de sân împărtășesc modul în care boala și-a schimbat viața