Editorii noștri vor examina ceea ce ați trimis și vor stabili dacă să revizuiți articolul.
Staniu (Sn), un element chimic aparținând familiei carbonului, grupa 14 (IVa) din tabelul periodic. Este un metal alb moale, argintiu, cu o nuanță albăstruie, cunoscut de antici în bronz, un aliaj cu cupru. Staniul este utilizat pe scară largă pentru placarea cutiilor de oțel utilizate ca recipiente pentru alimente, în metalele utilizate pentru rulmenți și în lipire.
Originile staniuului se pierd în antichitate. Bronzurile, care sunt aliaje de cupru - staniu, au fost folosite de oameni în preistorie cu mult înainte ca metalul pur de staniu să fie izolat. Bronzurile erau comune în Mesopotamia timpurie, valea Indului, Egipt, Creta, Israel și Peru. O mare parte din staniu folosit de popoarele mediteraneene timpurii provenea aparent din Insulele Scilly și Cornwall din Insulele Britanice, unde exploatarea staniului datează de cel puțin 300-200 î.Hr. Minele de tablă funcționau atât în domeniile inca, cât și în cele aztece din America de Sud și Centrală înainte de cucerirea spaniolă. Simbolul Sn pentru staniu este o abreviere a cuvântului latin pentru staniu, stannum.
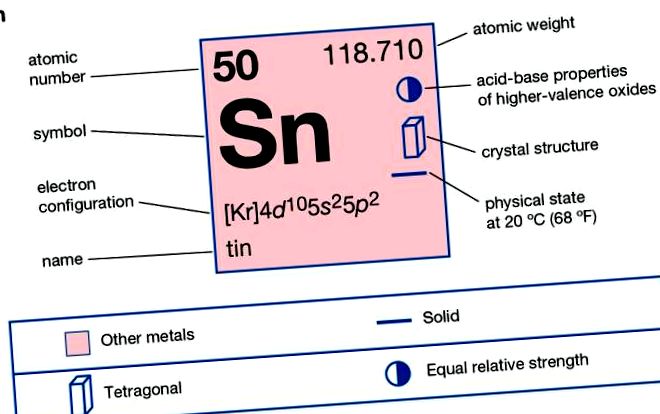
| 50 |
| 118,69 |
| 231,97 ° C (449,54 ° F) |
| 2.270 ° C (4.100 ° F) |
| 7.28 |
| 5,75 grame/cm 3 |
| +2, +4 |
| [Kr] 4d 10 5s 2 5p 2 |
Apariție și distribuție
Elementul este prezent în rocile magmatice ale scoarței Pământului în proporție de aproximativ 0,001%, ceea ce este rar, dar nu rar; abundența sa este de același ordin de mărime ca elemente utile din punct de vedere tehnic precum cobalt, nichel, cupru, ceriu și plumb și este în esență egală cu abundența de azot. În cosmos există 1,33 atomi de staniu la 1 × 106 atomi de siliciu, o abundență aproximativ egală cu cea a niobiului, ruteniului, neodimului sau platinei. Cosmic, staniul este un produs al absorbției neutronilor. Bogăția sa în izotopi stabili este de remarcat.
Staniul apare în boabele de metal nativ, dar în principal sub formă de oxid stannic, SnO2, în casiterita minerală, singurul mineral de staniu cu semnificație comercială. Metalul este obținut din casiterită prin reducere (îndepărtarea oxigenului) cu cărbune sau cocs în cuptoarele de topire. Nu se cunosc depozite de înaltă calitate. Sursele majore sunt depozitele aluvionare, în medie aproximativ 0,01% staniu. Cele mai vechi mine de tablă au fost cele din Cornwall, care au fost lucrate cel puțin încă din epoca feniciană, dar nu mai au consecințe majore, și Spania. Zăcămintele cu noduri, care conțin până la 4%, se găsesc în Bolivia și Cornwall. China a condus lumea în producția de staniu la începutul secolului 21, reprezentând aproape jumătate din toată producția; Indonezia, Peru și Bolivia au fost, de asemenea, producători de top. Au fost concepute mai multe procese pentru recuperarea metalului din fier vechi sau articole placate cu tablă. (Pentru un tratament complet al exploatării, rafinării și recuperării staniului, consultați prelucrarea staniului.)
Proprietățile elementului
Staniul este netoxic, ductil, maleabil și adaptat la toate tipurile de lucru la rece, cum ar fi laminarea, filarea și extrudarea. Culoarea staniu pur este păstrată în timpul expunerii, deoarece un film subțire, invizibil, protector de oxid stannic se formează spontan prin reacția cu oxigenul aerului. Punctul scăzut de topire al cositorului și aderența sa fermă la suprafețele curate de fier, oțel, cupru și aliaje de cupru facilitează utilizarea acestuia ca material de acoperire rezistent la oxidare. Staniul există în două forme diferite, sau alotrope: forma familiară, staniu alb (sau beta) și staniu gri (sau alfa), care este pudră și de puțin folos. Forma gri se transformă în alb peste 13,2 ° C (55,8 ° F), rapid la temperaturi peste 100 ° C (212 ° F); transformarea inversă, numită dăunător de staniu, are loc la temperaturi scăzute și împiedică serios utilizarea metalului în regiuni foarte reci. Această modificare este rapidă doar sub -50 ° C (-58 ° F), cu excepția cazului în care este catalizată de staniu gri sau staniu în starea de oxidare +4, dar este prevenită de cantități mici de antimoniu, bismut, cupru, plumb, argint sau aur prezente în mod normal în clasele comerciale de staniu.
Staniul alb are o structură cristalină tetragonală centrată pe corp, iar staniu gri are o structură cubică centrată pe față. Atunci când este îndoit, staniu face un „strigăt” ciudat și trosnet, pe măsură ce cristalele sale se sfărâmă reciproc. Staniul este atacat de acizi puternici și alcalii, dar soluțiile aproape neutre nu îl afectează semnificativ. Clorul, bromul și iodul reacționează cu staniu, dar fluorul reacționează cu acesta doar încet la temperatura camerei. Relațiile dintre modificările alotropice ale staniului pot fi reprezentate ca transformări de la un tip de cristal la altul la temperaturi specifice:
(Săgețile duble semnifică faptul că transformarea are loc în ambele direcții, pe măsură ce staniul este încălzit sau pe măsură ce este răcit.)
Staniul există în două stări de oxidare, +4 și +2. Staniul elementar este ușor oxidat la ionul dipositiv în soluție acidă, dar acest ion Sn 2+ este transformat în ion Sn 4+ de mulți agenți de oxidare ușori, inclusiv oxigenul elementar. Oxidarea în condiții alcaline dă în mod normal starea tetrapositivă (Sn 4+). Într-un mediu alcalin, staniu dipositiv (Sn 2+) se disproporționează ușor de staniu tetrapositiv și de elementul liber.
Staniul are 10 izotopi stabili, care apar în următoarele procente în staniu natural: staniu-112, 0,97; tin-114, 0,65; tin-115, 0,36; tin-116, 14,53; tin-117, 7,68; tin-118, 24,22; tin-119, 8,58; tin-120, 32,59; tin-122, 4,63; și tin-124, 5,79.
Etanșarea fierului îl protejează pe acesta din urmă de coroziune; conductele și supapele de tablă mențin puritatea în apă și băuturi; staniul topit este baza pentru producția (plutitoare) de sticlă. Deoarece staniul pur este relativ slab, nu este folosit la utilizări structurale decât dacă este aliat cu alte metale în materiale precum bronzuri, cositor, metale purtătoare, metale tip, lipituri pe bază de plumb, metal clopot, metal babbitt și aliaje de turnare la temperatură scăzută . Oxidul de staniu, în care staniul se află în starea de oxidare +4, este util pentru a face corpurile ceramice opace, ca un abraziv ușor și ca agent de cântărire pentru țesături. Fluorul de staniu și pirofosfatul de staniu, în care staniul se află în starea de oxidare +2, sunt folosite la dentifrice. Compușii organici de staniu acționează ca stabilizatori în anumite materiale plastice și ca conservanți pentru lemn. Un aliaj cristalin cu niobiu este un supraconductor la temperaturi de până la 18 K (-427 ° F) și păstrează această proprietate în câmpuri magnetice foarte puternice.
Staniul elementar este aparent netoxic, iar cantitățile de staniu de până la 300 de părți pe milion, dizolvate de alimentele ambalate în recipiente placate cu tablă și ustensile de gătit, nu sunt dăunătoare. Compușii organici de staniu utilizați în mod obișnuit ca biocide și fungicide sunt, totuși, toxici pentru ființe umane.
Compuși
Staniul formează două serii de compuși: stanos, în care staniu se află în starea de oxidare +2 și stanic, în care se află în starea +4. Unii dintre compușii stanoși mai importanți din punct de vedere comercial sunt clorura stanoasă, SnCl2, utilizată în zincarea staniu și ca agent reducător la fabricarea polimerilor și a coloranților; oxid stanos, SnO, utilizat la fabricarea sărurilor de staniu pentru reactivi chimici și pentru placare; și fluor stanos, SnF2, un ingredient activ în pastele de dinți. Compușii stanici cu semnificație includ clorura stannică, SnCl4, utilizat pe scară largă ca stabilizator pentru parfumuri și ca materie primă pentru alte săruri de staniu; și oxidul stannic, SnO2, un catalizator util în anumite procese industriale și o pulbere de lustruit pentru oțel.
Staniul poate forma o legătură cu carbonul, ca în cei peste 500 de compuși organotinici cunoscuți. Stabilizatorii de organotină sunt utilizați pentru a preveni modificările clorurii de polivinil la expunerea la lumină și căldură. O serie de compuși organotinici sunt ingrediente majore în biocide și fungicide.
Acest articol a fost revizuit și actualizat cel mai recent de Adam Augustyn, Managing Editor, Reference Content.
- Definiția greutății, efecte și fapte Britannica
- The Steel Club beneficiază și folosește Onnit AcademyOnit Academy
- Fapte ciudate Limba ta te poate face să mănânci prea multă sare
- Utilizări Tribulus, Efecte secundare, dozare, interacțiuni și beneficii pentru sănătate
- Adevărul despre cuptoarele cu microunde 5 fapte care ar putea să vă surprindă