Wei Liu
1 Centrul Shandong de resurse de germoplasmă a culturilor, Academia de Științe Agricole Shandong, Jinan, 250100 China
2 Institutul de Știință și Tehnologie Agroalimentară, Academia de Științe Agricole din Shandong, Jinan, 250100 China
3 Școala de sănătate publică și științe ale sănătății, Universitatea din Massachusetts, Amherst, 01003 SUA
Yu Zhang
1 Centrul Shandong de resurse de germoplasmă a culturilor, Academia de Științe Agricole Shandong, Jinan, 250100 China
Bin Qiu
2 Institutul de Știință și Tehnologie Agroalimentară, Academia de Științe Agricole din Shandong, Jinan, 250100 China
Fan Shoujin
4 Colegiul de Științe ale Vieții, Universitatea Normală Shandong, Jinan, 250014 China
Hanfeng Ding
1 Centrul Shandong de resurse de germoplasmă a culturilor, Academia de Științe Agricole Shandong, Jinan, 250100 China
4 Colegiul de Științe ale Vieții, Universitatea Normală Shandong, Jinan, 250014 China
Zhenhua Liu
3 Școala de sănătate publică și științe ale sănătății, Universitatea din Massachusetts, Amherst, 01003 SUA
Date asociate
Abstract
O mulțime de dovezi evidențiază faptul că disbioza microbiotei intestinale este un factor critic pentru boala inflamatorie intestinală (IBD). Atât studiile in vivo, cât și cele in vitro au demonstrat că quinoa are posibile efecte prebiotice. Prezentul studiu își propune să examineze potențialul utilizării quinoa pentru a ameliora disbioza și colita induse de sulfatul de sodiu de dextran (DSS). Un total de 40 de șoareci C57BL/6 au fost hrăniți fie cu o dietă AIN-93M, fie cu o dietă pe bază de quinoa, separat. Colita a fost indusă pentru 10 animale/grup dietetic cu o expunere de 5 zile la 2,5% DSS. Simptomele clinice au fost monitorizate la fiecare două zile, iar microbiota intestinală a fost caracterizată prin secvențierea genei ARNr 16S. Rezultatele au indicat faptul că consumul de quinoa a scăzut simptomele clinice, după cum se indică prin indicele redus de activitate a bolii și gradul de afectare histologică (P 1, 2, a atins niveluri epidemice la nivel mondial 3, 4. IBD este direct asociat cu un risc crescut de cancer colorectal, de fapt, utilizarea pe termen lung a agenților imunosupresori tradiționali pentru tratamentul IBD, de exemplu azatioprina, ar putea duce la o incidență mai mare a diferitelor tipuri de cancer 5. Prin urmare, este de o importanță crucială dezvoltarea de strategii pentru preveni apariția IBD 6, 7 .
Deși niciun studiu nu a determinat în mod convingător vreun grup sau tulpină bacteriană specifică care cauzează cu siguranță IBD, este bine acceptat faptul că disbioza microbiotei intestinale este un factor critic care contribuie la etiopatogeneza IBD 8. Pacienții cu IBD prezintă o reducere semnificativă a biodiversității și a stabilității microbiotei intestinale 4. Au, de asemenea, o abundență redusă de filme Firmicutes și Bacteriodete însoțite de o abundență considerabil crescută de Proteobacterii și Actinobacterii 9, 10. Unele grupuri bacteriene specifice, cum ar fi Enterobacteriaceae și Desulfovibrio, s-au dovedit a fi extinse la pacienții cu IBD 11, 12. Studiile folosind modele animale au furnizat dovezi mai directe: după inocularea cu microbiota de la șoareci cu colită, beneficiarul sănătos poate dezvolta inflamație intestinală 13 .
Dieta este un mediator direct pentru microbiota intestinală și, prin urmare, oferă un mijloc atractiv pentru prevenirea IBD. Chenopodium quinoa Willd (quinoa), o cultură comestibilă a cerealelor din regiunea Anzi din America de Sud, este bogată în proteine, vitamine și minerale de înaltă calitate și, în special, posedă o gamă largă de diverse polizaharide 14. Studiile in vitro au sugerat că quinoa are un efect prebiotic, inclusiv promovarea creșterii bacteriilor benefice și producerea de SCFA (acizi grași cu lanț scurt) 15. Polizaharidele din quinoa au demonstrat activitate de reglare a imunității în studiile pe animale 16. Toate dovezile sugerează că quinoa poate avea efecte benefice asupra sănătății intestinale.
În acest studiu, utilizând modelul animal de colită indusă de dextran sulfat de sodiu (DSS), am investigat în ce măsură consumul de quinoa a atenuat disbioza microbiotei intestinale și a redus simptomele colitei induse de DSS. Acest lucru a fost făcut cu luarea în considerare a dezvoltării unor strategii dietetice pentru prevenirea IBD.
Rezultate
Fiziologia corpului și indicii patologici
În acest studiu, grupurile de șoareci expuși la DSS au dezvoltat simptome clinice, inclusiv pierderea în greutate corporală, diaree și sângerări rectale. Așa cum se arată în FIG. 1a, b, greutățile corporale și scorurile DAI ale controalelor non-DSS au rămas stabile pe parcursul întregii 10 zile, în timp ce greutățile corporale ale grupurilor tratate cu DSS au scăzut semnificativ din ziua 4, iar DAI a crescut semnificativ din ziua 2. Când s-au comparat cele două În grupurile induse de DSS (MDSS vs. QDSS), s-a determinat că pierderea în greutate corporală a șoarecilor QDSS a fost mai mică decât cea a șoarecilor MDSS din ziua 6 până în ziua 10, iar diferența a fost semnificativă statistic în ziua 8. Șoarecii QDSS au prezentat scoruri DAI mai mici decât șoarecii MDSS din ziua 2 până la sfârșitul studiului, cu semnificații statistice prezentate în zilele 2, 6, 8 și 10 (P * Indică diferență semnificativă cu P ** Indică P *** Indică P 1c, d, grupurile tratate cu DSS au prezentat lungimi reduse ale colonului (Fig. 1c, P 1d, P = 0,0076). În compararea celor două grupuri tratate cu DSS, greutatea splinei șoarecilor din dieta standard AIN-93M (MDSS) a fost semnificativ mai mare decât cea a șoarecilor din dieta quinoa (QDSS) (P = 0,0288). Nicio diferență semnificativă în col lungimea onică a fost observată între grupurile MDSS și QDSS. Evaluarea histologică a arătat că tratamentul DSS a crescut semnificativ inflamația colonului (Fig. 1e), în timp ce consumul de quinoa a atenuat daunele tisulare, după cum se indică printr-un scor histologic mai scăzut pentru grupul QDSS comparativ cu grupul MDSS (Fig. 1f, P 2a, b, reducerea semnificativă a bogăției atât a speciilor microbiene (Chao1), cât și a diversității (Shannon) au fost observate la șoarecii colite tratați cu DSS, în comparație cu grupurile de control non-DSS (Chao1: P 2c (neponderat) și Fig. 2d (ponderat), atât valorile UniFrac, cât și cele ponderate, au arătat o separare distinctă a celor patru grupuri de tratament, ceea ce înseamnă că expunerea la DSS și dieta sunt ambii factori de influență cheie asupra compoziției microbiotei intestinale.
Analiza structurii taxonomice microbiene
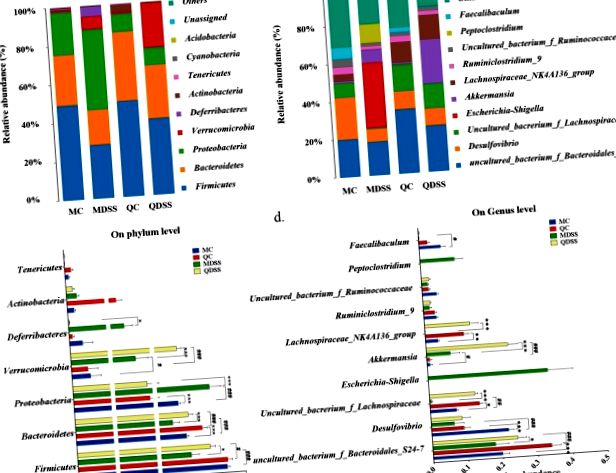
Compoziția taxonomică microbiană și detaliile comparării taxonomiei bacteriene la nivelul filului au fost demonstrate în Fig. 3a, respectiv c. Clasificarea filogenetică a OTU-urilor a arătat că Firmicutes și Bacteroidetes sunt filurile predominante în grupurile de control non-DSS (grupuri MC și QC). Abundențele relative de Firmicutes la șoareci MC și QC au fost de 49,2% și 49,7%, iar abundențele de Bacteroidete în MC și QC au fost de 26,1% și respectiv 35,8%. După tratamentul cu DSS, abundențele relative ale Firmicutes și Bacteroidetes au fost semnificativ reduse în comparație cu omologii lor non-DSS. Abundența relativă de Firmicutes a scăzut la 28,0% (MDSS) și 39,5% (QDSS), iar cea a bacteroidelor a scăzut la 18,2% (MDSS) și 27,6% (QDSS). Magnitudinea scăderii a fost mult mai mică în grupurile de dietă cu quinoa (QC vs. QDSS), comparativ cu grupurile de dietă martor AIN-93M (MC vs. MDSS), iar abundențele relative ale acestor două filuri la șoarecii QDSS au fost semnificativ mai mari decât cele de la șoarecii MDSS (Firmicutes: P 17 și s-ar putea ca urmare a anumitor bacterii din Verrucomicrobia să poată de-polimeriza DSS și astfel să poată crește într-un mediu bogat în DSS 17, 18 .
Abundența relativă a genului Escherichia/Shigella și Peptoclostridium în probele secvențiate (n = 5/grup).
În plus, la nivelul genului am observat o creștere semnificativă a Desulfovibrio și o scădere a Akkermansia indusă de tratamentul DSS, care, după cunoștințele noastre, nu a fost încă raportată în alte studii. Aceasta ar putea fi o caracteristică legată de expunerea la DSS, deoarece tendința similară a fost observată atât în grupurile dietetice bazate pe AIN-93M, cât și în cele din quinoa.
Analiza LEfSe a microbiotei cecale
Microbiota cecală din grupuri a fost analizată în continuare prin LFfSe (LDA Effect Size). Cladograma LEfSe și histograma scorurilor LDA sunt prezentate în Fig. 5. Un total de 47 de impozite diferite (de la phylum la nivelul speciilor) au fost găsite între grupul MC și MDSS, incluzând 25 de comunități dominante din grupul MC și 22 de comunități dominante din grupul MDSS (Fig. 5a, b). Microbiota cecală a șoarecilor din dieta cu quinoa a fost mult mai stabilă după tratamentul DSS și s-au găsit doar 26 de taxe diferite între grupurile QC și QDSS, 12 dintre acestea fiind îmbogățite în grupul QC și 14 îmbogățite în grupul QDSS (Fig. 5c, d).
LEfSE a fost utilizat pentru a identifica reprezentantul fiscal în diferite grupuri. Rezultatul care arată dimensiunea efectului taxonilor îmbogățiți semnificativ în fiecare grup atunci când se efectuează comparația între (A) MC și MDSS; (c) QC și QDSS. Cladogramă taxonomică obținută utilizând analiza LEfSe a secvențelor 16S din (b) MC vs. MDSS și (d) QC vs. QDSS. Taxonii diferențiali abundenți sunt prezentați cu culori desemnate utilizând metoda LEfSe, schemele urmând aceeași formatare. Taxonii de la sunt colorate în albastru și, respectiv, portocaliu. Taxonii cu modificări nesemnificative între șoarecii tratați fără DSS și DSS sunt colorate în galben. Diametrul fiecărui cerc mic reprezintă abundența taxonului.
Profilarea cu citokine multiplex a șoarecilor în plasmă
Așa cum se arată în FIG. 6, expunerea la DSS a crescut nivelurile circulante ale tuturor nivelurilor de citokine inflamatorii testate (MC + QC vs. MDSS + QDSS, P * Indică diferențe semnificative cu P ** Indică P *** Indică P 19, 20. Quinoa, un bine-cunoscut pseudocereal sănătos, are un conținut ridicat de fibre dietetice, conține acizi grași poli-nesaturați și este considerat o sursă de proteine de înaltă calitate. În plus, conține o abundență de fitochimici antiinflamatori 21 - 23 și, prin urmare, are potențiale efecte protectoare împotriva În studiul de față, am evaluat efectele chinoa asupra IBD utilizând modelul de colită murină indus de DSS. Rezultatele arată că consumul de quinoa a atenuat semnificativ simptomele clinice în modelul de colită indusă de DSS în comparație cu starea la șoareci. alimentat cu dieta de control AIN-93M, după cum se indică prin scăderea în greutate corporală, un indice mai bun de activitate a bolii, mai puține leziuni histologice ale colonului și o stare inflamatorie îmbunătățită (nivel plasmatic mai scăzut de IL-6 ).
În special, prezentul studiu și-a propus să examineze efectele quinoa asupra simptomelor colitei și ale disbiozei microbiotei intestinale induse de DSS. Deoarece quinoa conține mai multe componente prebiotice, inclusiv polizaharide și compuși fenolici 16, 23, poate avea capacitatea de a modifica microbiota intestinală. În prezentul nostru studiu, analiza PCoA a taxonilor microbieni din eșantioanele de conținut cecal a separat distinct cele patru grupuri experimentale, sugerând o proprietate reglatoare a chinoa asupra compoziției microbiene intestinale. Așa cum era de așteptat, tratamentul DSS a redus semnificativ indicii de bogăție și diversitate a speciilor (Chao1 și Shannon) ale microbiotei intestinale 24, dar bogăția și diversitatea, după cum se indică prin indicii Chao1 și Shannon, au fost semnificativ mai mari în grupul QDSS decât în grupul MDSS. Având în vedere controalele fără tratament DSS, indicii Chao1 și Shannon din grupul QC nu au fost mai mari decât cei din grupul MC; rezultatele actuale au sugerat că consumul de quinoa a compromis reducerea bogăției și diversității speciilor induse de tratamentul DSS, ceea ce indică efectul pozitiv al quinoa asupra menținerii ecosistemelor intestinale.
Rezultatele noastre indică o extindere dramatică a filamentului Proteobacteria indusă de șoarecii tratați cu DSS hrăniți cu dieta AIN-93M, în timp ce nu a existat o expansiune relativă a Proteobacteriei prin administrare DSS la șoarecii hrăniți cu dietă pe bază de quinoa. Expansiunea neobișnuită a proteinobacteriilor este adesea considerată ca o „semnătură microbiană” a disbiozei în microbiota intestinală 25. Prin urmare, efectul inhibitor asupra expansiunii Proteobacteriei filului de către quinoa ar putea fi potențial benefic pentru sănătatea intestinală.
De asemenea, a fost remarcat faptul că tratamentul DSS a indus înflorirea genurilor Escherichia/Shigella și Peptoclostridium la șoareci alimentați cu dieta AIN-93M, în timp ce niciunul dintre ei nu a fost observat la șoarecii hrăniți cu quinoa. Atât Escherichia/Shigella, cât și Peptoclostridium sunt, în general, considerate pro-inflamatorii, deoarece conțin Escherichia coli și Peptoclostridium difficile, principalii agenți patogeni asociați cu diareea infecțioasă 26. O scădere dramatică a fost observată pentru două genuri aparținând familiei Lachnospiraceae prin tratamentul DSS la șoareci alimentați cu dieta AIN-93M, în timp ce modificarea nu a fost observată la animalele hrănite cu quinoa (QC vs. QDSS). Deoarece inocularea Lachnospiraceae la șoareci fără germeni poate suprima creșterea Peptoclostridium difficile 27, scăderea Lachnospiraceae ar putea fi responsabilă pentru extinderea Peptoclostridium în grupul MDSS.
Din câte știm, acesta este primul studiu care analizează efectele unei diete pe bază de quinoa asupra unui model animal de colită. Datele noastre au demonstrat că consumul de quinoa a modificat disbioza microbiotei intestinale și a compromis simptomele clinice ale colitei induse de DSS. Rezultatele promițătoare din studiul nostru pe animale justifică studii clinice suplimentare pentru a stabili consumul de quinoa ca strategie dietetică pentru îmbunătățirea sănătății intestinale.
Materiale și metode
Prepararea făinii de Quinoa
Semințele de quinoa (quinoa albă) utilizate în acest studiu furnizate de Shandong Center of Crop Germplasm Resources (Jinan, Shandong, China), care au plantat în Xinzhou, Shanxi, China. Semințele de quinoa au fost curățate și spălate de mai multe ori până când nu a fost vizibilă spumă în apă; acest lucru a fost făcut pentru a îndepărta saponinele de pe pielea exterioară a semințelor. Semințele de quinoa spălate au fost uscate la 42 ° C timp de cel puțin 12 ore și apoi măcinate în făină de quinoa. Făina de quinoa rezultată conținea 15,0 ± 0,46% proteine, 11,3 ± 0,35% umiditate, 4,7 ± 0,41% grăsimi, 61,8 ± 1,15% carbohidrați (în care 55,6% sunt amidon) și 2,0 ± 0,10% cenușă.
Animale și diete
Evaluarea indicelui de activitate a bolii (DAI)
Greutatea corporală, consistența scaunului și sângerarea rectală au fost înregistrate la fiecare două zile. DAI a fost calculat prin combinarea scorurilor măsurate ale greutății corporale, consistenței scaunului și sângerării scaunelor în conformitate cu metodele descrise anterior 28. Detaliile fiecărui scor sunt enumerate în Materiale suplimentare (Tabelul S2).
Colecția de țesuturi
În ziua 10, șoarecii au fost anesteziați cu inhalare de izofluran și sângele a fost colectat cu un tub capilar conținând 1% soluție de heparină sodică prin puncție orbitală și apoi centrifugat la 6000 rpm timp de 10 minute pentru a obține plasmă. După terminarea prin dislocare a colului uterin, abdomenul a fost deschis, intestinul gros a fost îndepărtat și plasat pe o placă de gheață, apoi conținutul de cecal a fost colectat, congelat rapid în azot lichid și depozitat la -80 ° C până la o analiză ulterioară. S-au înregistrat lungimea colonului (măsurată de la joncțiunea colo-cecală la anus), greutatea splinei și greutatea ficatului, iar țesutul colonului a fost colectat pentru analize histopatologice.
Analiza histopatologică
După fixare timp de 48 de ore în formalină 10%, țesuturile colonului au fost prelucrate pentru încorporarea parafinei, cu secțiuni de colon de 5 μm colorate cu hematoxilină și eozină (H&E). Opt câmpuri selectate aleatoriu au fost vizualizate la microscopul cu lumină și fiecare vizualizare a dat scoruri conform descrierilor anterioare 19, 29. Pe scurt, scorurile au fost date în funcție de severitatea inflamației (0-3), extinderea inflamației (0-3) și dauna criptelor (0-4), cu scorurile histologice totale calculate apoi prin adăugarea scorurilor tuturor celor trei parametri, rezultând într-un scor potențial maxim de 10. Descrierea detaliată a standardelor de scor este listată în Materiale suplimentare (Tabelul S3).
Analiza compoziției microbiotei cecale prin secvențierea genei ARN ribozomal 16S
ADN-ul bacterian total a fost izolat din conținutul de cecal înghețat folosind un kit mini QIAamp DNA Scaun (Qiagen, Valencia, CA). Regiunea V3 - V4 a genei 16S rRNA a fost amplificată și bibliotecile de ADN au fost construite în conformitate cu cele descrise anterior 30. Secvențierea pereche cu o lungime de citire de 2 × 250 bp a fost efectuată pe platforma Illumina MiSeq (Illumina, Inc, San Diego, California). După ce s-au alăturat citirile demultiplexate cu perechi (FLASH v1.2.7) 31, calitatea filtrată 32 și himerismul eliminat 33, etichetele rezultate au fost atribuite OTU-urilor folosind UCLUST (versiunea 1.2.22) 34 cu un prag de 97% de identitate pereche . Taxonomia identificată a fost apoi aliniată la baza de date de referință Silva (Release128, http://www.arb-silva.de) 35. Analiza α-diversității a fost realizată folosind Mothur (versiunea v.1.30, http://www.mothur.org/) 36, indicele Chao1 a fost utilizat pentru a caracteriza bogăția speciilor, iar indicele diversității Shannon a fost utilizat pentru a caracteriza diversitatea speciilor. Au fost utilizate parcele de analize coordonate principale bidimensionale (PCoA), inclusiv Unifrac ponderat și neponderat, pentru a evalua variația (distanța β-diversitate) între grupurile experimentale. Datele brute citite de Illumina pentru toate eșantioanele au fost încărcate în SRA la NCBI sub numărul de acces SRP141297.
Profilarea citokinelor multiple în plasma șoarecilor
Probele de plasmă au fost centrifugate la 4 ° C la 3000 rpm timp de 10 minute, supernatantul a fost colectat și diluat de 2 ori pentru o analiză ulterioară. Concentrațiile de IL-1β, TNF-α, IL-6 și IFNγ au fost determinate folosind kitul V-PLEX ™ Proinflammatory Panel 1 (mouse) și QuickPlex SQ 120 (Mesoscale Discovery, Rockville, MD) conform protocoalelor producătorului. Citokinele au fost exprimate ca plasmă ng/ml.
- Pierderea permanentă în greutate necesită schimbări pe tot parcursul vieții în obiceiurile alimentare SCĂDEREA DIETEI -
- NOTE - Dieta de sănătate întreagă O abordare transformativă a pierderii în greutate
- Superfoods Whole Grain - Resurse pentru slăbit
- Debutul colitei ulcerative în timpul unei diete cu scădere în greutate cu conținut scăzut de carbohidrați și tratamentul cu un
- Inhibitorii selectivi ai recaptării serotoninei (ISRS) induc schimbări de greutate O doză și o durată