Javier Rivera Guzman
1 Departamentul de farmacologie, Facultatea de Medicină a Universității din Carolina de Nord, CB 7032, 103 Mason Farm Road, Chapel Hill, NC 27599, SUA
2 Center for Gastrointestinal Biology and Disease, Universitatea din Carolina de Nord Școala de Medicină, CB 7032, 103 Mason Farm Road, Chapel Hill, NC 27599, SUA
Victoria Susan Conlin
3 Departamentul de biologie, Vertex Pharmaceuticals Inc., Laval, QC, Canada H7V 4A7
Christian Jobin
1 Departamentul de farmacologie, Facultatea de Medicină a Universității din Carolina de Nord, CB 7032, 103 Mason Farm Road, Chapel Hill, NC 27599, SUA
2 Center for Gastrointestinal Biology and Disease, Universitatea din Carolina de Nord Școala de Medicină, CB 7032, 103 Mason Farm Road, Chapel Hill, NC 27599, SUA
4 Departamentul de Medicină, Universitatea din Carolina de Nord, Chapel Hill, NC 27599, SUA
5 Departamentul de Microbiologie și Imunologie, Universitatea din Carolina de Nord, Chapel Hill, NC 27599, SUA
Abstract
Epiteliul intestinal reprezintă o barieră critică care protejează gazda împotriva diferiților agenți nocivi luminali, precum și prevenirea captării necontrolate a bacteriilor care ar putea activa un răspuns imun la o gazdă susceptibilă. Monostratul epitelial care constituie această barieră este reglementat de o rețea de proteine care orchestrează funcții biologice complexe, cum ar fi permeabilitatea, rezistența electrică transepitelială și mișcarea diferitelor macromolecule. Datorită rolului său cheie în menținerea homeostaziei gazdei, factorii care reglementează funcția de barieră au atras atenția susținută din partea comunității de cercetare. Această lucrare va aborda rolul bacteriilor, metabolismul derivat din bacterii și interacțiunea factorilor dietetici în controlul funcției de barieră intestinală.
1. Introducere
Epiteliul intestinal a evoluat într-un mediu unic în care metaboliții dietetici, bacteriile și metaboliții derivați de bacterii sunt omniprezenți. Acest mediu oferă probabil o interacțiune sinergică între acest tripartit care poate influența fiecare componentă. De exemplu, epiteliul are impact asupra comunităților microbiene prin producerea diferiților produse de mucină și factori antimicrobieni care limitează colonizarea și aderența bacteriană. În plus, bacteriile furnizează, ca subproduse ale metabolismului lor, diferiți compuși (vitamine esențiale, antioxidanți, acid gras cu lanț scurt (SCFA), etc.) care afectează homeostazia gazdei [1, 2]. În cele din urmă, compoziția aportului alimentar poate avea, de asemenea, un impact semnificativ atât asupra barierei epiteliale intestinale, cât și asupra comunităților bacteriene [3-5).
În această lucrare ne concentrăm pe oferirea unei imagini de ansamblu asupra ultimelor cercetări emergente care încearcă să unifice elemente din aceste trei domenii: bariera epitelială intestinală, microbiom și aportul alimentar - în mod specific, modul în care acestea interacționează și se modulează reciproc. Vom discuta despre studiile emergente cu privire la efectele moleculare ale acizilor grași cu lanț scurt, producerea lor de către bacterii prin aportul de fibre prebiotice și amidonuri rezistente și detalii despre probiotice și mecanismele lor de acțiune.
2. Bariera intestinală
Dintre toate proteinele transmembranare (claudine, ocludină, MarvelD3, JAM-A, tricelulină și receptorul lipoproteinei stimulat de lipoliză, LSR) [11-13], claudinele determină permeabilitatea selectivă a barierei. Acest lucru se realizează prin diferite tipare de aminoacizi încărcați în buclele extracelulare ale proteinelor claudine individuale, care interacționează pentru a genera pori de dimensiuni diferite prin care are loc transferul de solut [14-17].
În timp ce stabilitatea TJ este necesară pentru menținerea integrității barierei, formarea TJ trebuie să fie dinamică pentru a se adapta la rotirea celulelor epiteliale intestinale care are loc la fiecare 4-5 zile [18]. În acest scop, proteinele TJ sunt continuu internalizate și reciclate înapoi la membrana plasmatică prin endocitoză. În condiții fiziologice normale, reînnoirea macroscopică a TJ implică ruperea continuă a catenelor și reformarea care implică endocitoza mediată de clatrin [19, 20]. În schimb, claudinele sunt reciclate printr-un mecanism similar cu cel utilizat pentru internalizarea joncțiunii decalajului, unde membranele TJ sunt endocitate împreună într-una dintre celulele alăturate [21]. În timpul internalizării, claudinele se separă de alte proteine TJ și generează vezicule îmbogățite cu claudină, care au potențialul de a regla compoziția claudinei TJ-urilor.
Rotația TJ și expresia claudinei pot fi, de asemenea, modulate de citokine ca mecanism plauzibil pentru migrarea neutrofilelor peste barierele epiteliale [22]. În special, TNF a crescut permeabilitatea paracelulară in vitro prin reglarea descendentă a claudinei [23]. Mai mult, internalizarea indusă de citokine a proteinelor TJ poate fi blocată in vitro folosind inhibitori ai endocitozei mediate de clatrin [20]. Reciclarea TJ poate fi, de asemenea, deturnată de bacterii patogene (de exemplu, E. coli enteropatogenă, H. pylori și C. difficile) [24]. Inflamația indusă de bacterii crește, de asemenea, internalizarea claudinei și crește permeabilitatea [25, 26]. Macropinocitoza este o altă cale în care proteinele TJ pot fi internalizate [27] și colocalizate cu markeri ai endozomilor precoce și de reciclare. Aceste date sugerează un mecanism plauzibil pentru redistribuirea rapidă a proteinelor înapoi la TJ, sigilând bariera epitelială după ce a scăzut o insultă inflamatorie [28].
Reglarea fiziologică a homeostaziei de barieră se bazează pe căi de transducție a semnalului bine controlate, care converg pe proteinele citoplasmatice TJ [29-36]. Proteinele citoplasmatice TJ (ZO-1, -2 și -3; cingulină și afadină) leagă proteinele transmembranare de citoscheletul de actină și acționează și ca schele pentru complexele majore de semnalizare [29, 30, 37-39]. Componentele fosforilate ale citoscheletului, și anume, lanțul ușor miozinic (MLC) prin kinaza lanțului ușor miozinic (MLCK) sau kinaza asociată Rho (ROCK), determină contractarea acestuia, care separă TJ și crește permeabilitatea paracelulară [28, 40-42] ]. În plus față de separarea fizică a TJ, ROCK compromite integritatea barierei prin creșterea endocitozei proteinelor TJ [28]. Opinia actuală sugerează că reglarea TJ este un echilibru delicat între rețelele de interacțiune care încorporează protein kinaza C (PKC), protein kinaza A (PKA), protein kinazele activate cu mitogen (MAPK) și fosfoinozitida 3-kinaza (PI3-K) [42- 45].
Este clar că modificările căilor normale de transducție a semnalului care afectează homeostazia barierei (proliferare/apoptoză/necroptoză) duc la trecerea nereglementată a bacteriilor luminale prin epiteliu și la activarea aberantă ulterioară a sistemului imunitar al mucoasei, ducând la inflamație [40, 56, 57 ]. Dovezile crescânde indică, de asemenea, că funcția de barieră și rețeaua sa complexă de reglare sunt influențate de microbiotă și de componentele dietetice, atât direct prin produse microbiene produse endogen, cât și indirect prin metaboliții din dieta gazdă.
3. Produse microbiene și bariera epitelială intestinală
O gamă largă de receptori de recunoaștere a modelelor (PRR) sunt implicați în detectarea/detectarea diferitelor structuri microbiene, cum ar fi componentele membranei, acizii nucleici și aparatele de motilitate [58].
Receptorii de tip Toll (TLR) și receptorii de tip Nod (NLR) sunt probabil cei mai studiați PRR în intestin, iar contribuția lor la funcția de barieră a fost investigată folosind diferite modele de leziuni intestinale [59-61]. De exemplu, semnalizarea TLR2 prin PKC este esențială pentru îmbunătățirea funcției de barieră asociată cu ZO-1 în celulele epiteliale intestinale după expunerea la dextran-sulfat-sodiu (DSS) [62]. În plus, s-a demonstrat că TLR4 și proteina de semnalizare MyD88 joacă un rol benefic în răspunsurile de vindecare a rănilor și restabilirea integrității barierei în leziunile acute induse de DSS [63]. În plus, ștergerea moleculelor de semnalizare în aval de TLR, cum ar fi modulatorul esențial al factorului nuclear kappa B (NF-κB) (NEMO), subunitatea transcripțională NF-κB RelA, kinaza TGF-β-activată și alte kinaze IκB din epiteliul intestinal are ca rezultat o susceptibilitate crescută la colită [64-67].
Deși aceste descoperiri evidențiază rolul important al structurilor microbiene în reglarea funcției de barieră, un alt strat de complexitate este relația dintre potențialul bioactiv al microbiotei și bariera intestinală. Într-adevăr, identificarea microorganismelor specifice care produc compuși implicați în modularea funcției de barieră intestinală a câștigat o atenție extraordinară.
Microorganismele și genomul lor asociat (
Un alt lactobacil cu potențial terapeutic este L. brevis SBC8803, care, spre deosebire de LGG, are efecte benefice atunci când este administrat ca o purificare de monoculturi lichidă, liofilizată. Într-un raport recent, L. brevis ucis de căldură a reușit să inducă proteine de șoc termic (Hsp) 25, 27 și 70 in vitro în funcție de doză, folosind linia de celule colonice, Caco-2, Hsps, fiind proteine importante induse de stres implicat în protecția epiteliului colonic împotriva leziunilor induse de bacterii [90-92]. Administrarea zilnică transanal a 0,1% cultură de L. brevis liofilizată în soluție salină a scăzut inflamația intestinală indusă de DSS, a îmbunătățit supraviețuirea și a scăzut expresia TNF-α, IL-12 și IL-1β [72], subliniind importanța identificării mecanismele de acțiune diferite ale diferiților lactobacili.
4. SCFA produsă de bacterii și bariera epiteliului intestinal
Mediul anaerob al intestinului permite anumitor microbi intestinali să valorifice substanțele nutritive prin fermentarea nutrienților care trec prin lumen, rezultând în generarea unei game largi de metaboliți. Printre metaboliții produși prin acest proces se numără vitaminele esențiale precum vitamina K și majoritatea vitaminelor B solubile în apă precum biotina, cobalamina și riboflavina [101], care sunt apoi absorbite de gazdă [102]. De asemenea, printre acești metaboliți sunt SCFA, cum ar fi propionatul, acetatul și butiratul derivat din fibre dietetice, carbohidrați fermentabili și amidonuri rezistente, care nu sunt defalcate în tractul digestiv superior [103]. Fermentarea fibrelor dietetice este importantă pentru homeostazia intestinală, deoarece acest proces induce motilitatea gastro-intestinală superioară [104] și hormonii de satietate, peptida-1 de tip glucagon (GLP-1) și peptida YY (PYY) [105-108]. În plus, aceste SCFA nu numai că prezintă potențial terapeutic în tratamentul pacienților cu IBD [109, 110], dar acești derivați bacterieni par să îmbunătățească și mai mult sănătatea colonului [111]. Interesant este faptul că pacienții cu colită ulcerativă (UC) par să fi afectat metabolismul butiratului [112]. Ca atare, mecanismele moleculare de acțiune ale acestor SCFA au devenit un subiect de investigații în creștere.
Prezența SCFA în intestin afectează direct permeabilitatea barierei. De exemplu, s-a demonstrat că butiratul protejează monostratele de celule Caco-2 de invazia și translocația Campylobacter jejuni într-o manieră dependentă de concentrație prin creșterea rezistenței electrice transepiteliale (TEER) [113]. În mod similar, butiratul, dar nu un amestec de butirat, acetat și propionat, s-a dovedit că inversează semnificativ creșterea permeabilității intestinale, a translocației bacteriene și a afectării histologice cauzate de expunerea la agentul chimioterapeutic 5-fluorouracil la șoareci [114]. Spre deosebire de primul studiu, prin utilizarea monostratelor T-84 și Caco-2, TEER s-a dovedit a fi crescut de către toate cele trei SCFA individuale sau printr-un amestec al acestora [115]. Capacitatea butiratului de a crește TEER se poate lega de capacitatea sa de a crește cingulina, proteinele ZO-1 și ZO-2 și nivelurile de ARNm, așa cum se arată în fibroblastele de șobolan-1 [116]. În același studiu, sa demonstrat că butiratul crește nivelul proteinelor de cingulină în celulele COS-7 și atât cingulina, cât și ocludina în celulele HeLa [116]. Aceste descoperiri sugerează că SCFA întărește bariera printr-o creștere atât a producției de proteine TEER, cât și a TJ.
Pe lângă investigația căilor moleculare implicate în semnalizarea SCFA, identificarea bacteriilor și a grupurilor de bacterii producătoare de SCFA, precum și a componentei dietetice care le influențează, a câștigat atenția.
Caracterizarea sistemului ecologic complex microbian prezent în intestin utilizând tehnici de secvențiere ribozomală 16S a relevat că microbiomul uman este dominat de două filuri, Firmicutes (
75%) și Bacteroidete
5. Lapte, bacterii și bariera epitelială a intestinului
Aceste studii reprezintă un punct interesant, care arată cum un produs alimentar aparent inofensiv, cum ar fi laptele, poate avea consecințe de anvergură asupra microbiotei intestinale a unui individ. În timp ce efectele directe asupra funcției de barieră nu au fost investigate în aceste studii, utilizarea modelelor de colită oferă cel puțin un punct de referință pentru potențialele efecte benefice și va ajuta la definirea mecanismelor moleculare de acțiune.
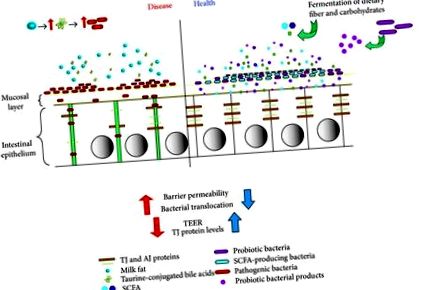
Deși peisajul barierei intestinale este un mediu foarte complex, luat împreună, acum îl putem imagina ca un mod în care aportul de dietă afectează intestinul într-unul din cele două moduri. Pe de o parte, poate afecta intestinul prin promovarea creșterii bacteriilor patogene sau oportuniste și prin aceasta deteriorând bariera prin creșteri ale permeabilității și translocației bacteriene, împreună cu scăderi ale proteinelor TJ și TEER, rezultând patologie, cum ar fi inflamația. Pe de altă parte, o dietă care include specii bacteriene probiotice sau fibre prebiotice care duc la SCFA ar consolida bariera epitelială prin creșterea proteinelor TJ și TEER, precum și scăderea permeabilității și a translocației bacteriene ajutând la evitarea sau ameliorarea patologiei (Figura 1).
Răspunsuri epiteliale intestinale la dietă și microbi. Dietele care conțin fibre fermentabile, amidon rezistent și altele asemenea duc la o fermentare crescută a intestinului și la producția de SCFA. O dietă constantă care conține aceste elemente ar schimba microbiomul intestinului gazdă pentru a crește proporția de bacterii producătoare de SCFA. La rândul său, o creștere a producției de SCFA ar crește, de asemenea, protecția epiteliului prin consolidarea barierei mediate de producția crescută de proteine TJ și TEER, precum și scăderea permeabilității și translocația bacteriană. În mod similar, o dietă care conține bacterii probiotice ar crește în timp funcția de barieră și integritatea. Dimpotrivă, o dietă care promovează creșterea populației de bacterii patogene sau oportuniste (ca și în cazul aportului de grăsimi din lapte) în peisaj ar avea efecte opuse, scăderea producției de proteine TJ și modificarea distribuției acestora, precum și scăderea TEER și astfel compromiterea integrității barierei . Acest lucru ar avea ca rezultat creșterea permeabilității barierei, rezultând o translocație bacteriană crescută și creșterea patologiei, cum ar fi creșterea inflamației intestinale.
6. Perspectivă
Impactul bacteriilor asupra funcției de barieră intestinală este clar ilustrat de acțiunea bacteriilor enterice patogene specifice care au dezvoltat mijloace remarcabile de a pătrunde și eluda acest important mecanism de apărare a gazdei. Bacteriile enterice patogene, cum ar fi speciile Salmonella, Shigella și Yersinia, au folosit proteine efectoare specifice pentru a modifica proteinele de joncțiune strânse intestinale și a slăbi funcția de barieră. Pe de altă parte, milioane de ani de evoluție au condus la achiziționarea unei microbiote intestinale complexe care a fost selectată pentru capacitatea sa de a menține o relație simbiotică cu gazda. Această biotă s-a format printr-un set complex de factori de mediu, inclusiv obiceiuri alimentare. Dovezile sugerează că această biotă nu numai că împiedică accesul bacteriilor patogene la bariera epitelială, dar promovează în mod activ starea unei bariere sănătoase prin acțiunea metabolismului lor.
Unele bacterii precum Lactobacillus plantarum par să moduleze bariera epitelială prin acțiunea proteinei secretate (LGG p40) în timp ce altele precum Clostridium influențează probabil bariera prin producția de metaboliți (SCFA). Având în vedere bogăția și diversitatea microbiotei, ar fi important să „minați” această biotă și să identificați microorganismele cu „funcție de protecție a barierei”. Datorită interacțiunii dintre dietă și compoziția microbiană, identificarea componentelor nutriționale care contribuie la funcționarea barierei ar trebui să fie, de asemenea, o prioritate de prim-plan. Integrarea tehnologiei microbiene genomice, metabolomice și transcriptomice ar fi esențială pentru a duce mai departe această misiune. Înțelegerea relației complicate dintre bariera epitelială, microb și dietă ar contribui, fără îndoială, la cunoștințe cheie care ar putea fi folosite în scop terapeutic.
Mulțumiri
Această lucrare este susținută de Institutele Naționale de Sănătate R01DK047700 și R01DK073338 către C. Jobin și de Divizia de Formare, Dezvoltare a Forței de Muncă și Diversitate a Institutului Național de Științe Medicale Generale (NIGMS) Grant K12GM000678 către J. R. Guzman.
- Consumul de dieta mediteraneană versus cea occidentală duce la un microbiom distinct al glandei mamare
- Dietă și dizaharidaze intestinale1 Cheie medicală de bază
- Dieta, Microbiomul intestinal și Epigenetica, legături emergente cu bolile și perspectivele inflamatorii intestinale
- Disbioza microbiomului intestinal și permeabilitatea intestinală crescută la copiii cu autoimunitate a insulelor
- Efectele frontierelor dietei asupra microbiomului enteric al somnului care mănâncă lemn Panaque nigrolineatus