Abstract
fundal
Scopul acestui studiu a fost de a examina caracteristicile ritmului cortizolului diurn în obezitatea infantilă și relațiile sale cu antropometria, stadiul pubertar și activitatea fizică.
Metode
Treizeci și cinci de copii cu obezitate (vârstă mediană: 11,80 [interval interquartile 10,30, 13,30] și scor mediu IMC z: 3,21 [interval interquartil 2,69, 3,71]) și 22 de copii cu greutate normală (vârstă mediană: 10,85 [interval interquartil 8,98, 12.13] și scorul z median al IMC: - s-au recrutat 0,27 [interval interquartil - 0,88, 0,35]). Probele de salivă au fost colectate la 08:00, 16:00 și 23:00 h. Concentrațiile de cortizol la 3 puncte de timp, ariile corespunzătoare sub curbă (ASC) și panta de cortizol diurnă (DCS) au fost comparate între cele două grupuri. Au fost evaluate măsurile antropometrice și stadiul pubertal, iar informațiile comportamentale au fost obținute prin chestionare.
Rezultate
Copiii cu obezitate au prezentat cortizol semnificativ mai scăzut 08: 00 [mediană [interval interquartil]: 5,79 [3,42,7,73] vs. 8,44 [5,56,9,59] nmol/L, P = 0,030) și cortizol mai mare23: 00 [mediană [interval intercuartil]: 1,10 [0,48,1,46] vs. 0,40 [0,21,0,61] nmol/L, P
fundal
Însoțită de dezvoltarea economică și de modificările stilului de viață, prevalența obezității la copii a crescut rapid la nivel mondial, ducând la boli metabolice legate de obezitate la vârsta adultă, precum boala hepatică grasă nealcoolică, diabetul de tip 2 și bolile cardiovasculare [1, 2]. Într-adevăr, stilul de viață nesănătos și cerințele academice ale copiilor interferează din ce în ce mai mult cu ritmurile biologice, care ar putea contribui la obezitatea copiilor și la rezultatele negative asupra sănătății [3, 4]. Prin urmare, este esențial să se identifice noi contribuabili la fiziologia subiacentă a obezității la copii.
Cortizolul este un produs primar al axei hipotalamo-hipofizo-suprarenale (HPA) și acționează ca efector terminal al acestei axe asupra altor sisteme [5]. Atât la modelele umane, cât și la cele animale, cortizolul a fost demonstrat cauzal că promovează acumularea de grăsimi și creșterea în greutate, precum și homeostazia glucozei și metabolismul lipidelor [6, 7]. Având în vedere că producția, secreția și abundența cortizolului sunt reglate într-un mod robust, dependent de timpul zilei [8], ritmul cortizolului diurn este un bun indicator pentru o evaluare cuprinzătoare a activității axei HPA. Ritmurile de cortizol sunt considerate a fi stabilite între 2 și 9 luni în viața timpurie [9], mediate de o combinație de influențe, cum ar fi ciclul lumină-întuneric, dezvoltarea pubertară, hrănirea, somnul și activitatea fizică [10]. În condiții fără stres, secreția și eliberarea cortizolului urmează un ritm circadian tipic: cortizolul crește rapid între 30 și 40 de minute după trezire, urmat de un declin accentuat în următoarele câteva ore și un declin treptat în restul zilei până la atingere cel mai mic nivel la miezul nopții [11, 12].
În studiul de față, am explorat caracteristicile ritmului cortizolului diurn la copii și adolescenți cu obezitate prin eșantionarea repetată a cortizolului salivar pe parcursul unei zile. Mai mult, am examinat relațiile de activitate a cortizolului cu gradul de adipozitate, stadiul pubertal și activitatea fizică. Aceste informații pot contribui la înțelegerea noastră a asociațiilor dintre cronodisruptie, obezitate și stil de viață pentru a oferi o nouă perspectivă pentru prevenirea primară a obezității la copii.
Metode
Participanți
În acest studiu transversal, un total de 57 de copii și adolescenți cu vârsta cuprinsă între 6 și 15 ani au fost recrutați de la Departamentul de endocrinologie și îngrijire a sănătății copilului din Spitalul de copii din Nanjing Medical University din iulie 2018 până în iunie 2019. Conform standardelor OMS [20] ], subiecții au fost împărțiți într-un grup de greutate normal (- 2 2). Criteriile de excludere au fost următoarele: (1) antecedente de boli cronice (cu excepția obezității), cum ar fi epilepsie, diabet, hipotiroidism, tumori, boli mintale, pubertate precoce sau statură mică; (2) utilizarea steroizilor exogeni în ultimele 3 luni; (3) antecedente de intervenții chirurgicale, traume sau alte evenimente de stres în ultimele 3 luni; (4) utilizarea unui medicament despre care se știe că afectează hormonii; sau (5) perioada menstruală feminină.
Studiul a fost aprobat de Comitetul Etic al Spitalului de Copii din Nanjing Medical University. Înainte de includerea în studiu, părinții au acordat consimțământul scris în scris.
Măsuri
Măsuri antropometrice
Toți subiecții au postit 12 ore peste noapte și au golit urina și scaunul înainte de măsurători. Compoziția corpului a fost determinată folosind metoda impedanței bioelectrice (Inbody J20, Biospace, Korea), incluzând masa de grăsime corporală, procentul de masă grasă (FM%) și masa musculară scheletică. Conform unui protocol standard, înălțimea și greutatea au fost măsurate de cercetători experimentați cu precizii de 0,1 cm și respectiv 0,1 kg. IMC a fost calculat ca greutate (în kilograme) împărțit la pătratul de înălțime (în metri). Deoarece IMC-ul copiilor variază în funcție de vârstă și sex, IMC-ul a fost transformat în scor z IMC în conformitate cu Standardele de creștere a copilului ale Organizației Mondiale a Sănătății (2006). Circumferința taliei (WC) a fost măsurată în centimetri până la cel mai apropiat 0,1 cm. Raportul talie-înălțime (WHtR) a fost calculat ca WC (în centimetri) împărțit la înălțime (în centimetri).
Stadiul pubertar
Pediatrii profesioniști au efectuat inspecție vizuală și palpare pentru a determina stadiul pubertar. Femelele au fost potrivite pentru sâni și părul pubian, iar bărbații pentru organele genitale și părul pubian [21]. Stadiul dezvoltării pubertare (perioada I-V) a fost evaluat conform criteriilor de stadializare Tanner, cu Tanner II ca semn distinctiv al inițierii pubertății. Pentru analiza diferitelor grade de dezvoltare pubertară, stadiul Tanner a fost clasificat în trei niveluri: pre-pubertar (Tanner I), pubertar timpuriu (Tanner II și III) și pubertar târziu (Tanner IV și V) [21].
Analiza cortizolului salivar
Cortizolul salivar reflectă nivelurile de cortizol biologic activ, nelegat de proteinele din ser și urmărește variația circadiană a cortizolului seric [22]. Cortizolul salivar se corelează puternic cu cortizolul plasmatic [23] și este mai puțin predispus la variabilitate datorită modificărilor proteinelor care leagă cortizolul [24]. Datorită colectării sale ușoare, neinvazive și transportului și depozitării convenabile, cortizolul salivar este utilizat pe scară largă pentru cercetarea pediatrică.
Probele salivare au fost colectate la 8:00, 16:00 și 23:00 h într-o stare liniștită după un post de 4 h. Pentru colectarea salivei s-a folosit un tub comercial Salivette® (SARSTEDT AG & Co, Germania) care conține un tampon de vată. Tamponul a fost rotit în gură timp de cel puțin 5 minute și introdus înapoi în tub. Probele de cortizol, care sunt stabile la temperatura camerei timp de câteva zile, [23] au fost centrifugate la 1500 rpm timp de 5 minute în decurs de 24 de ore pentru a obține saliva limpede cu vâscozitate scăzută și 500 μL de salivă a fost pipetată în tubul EP cu o micropipetă. Probele de salivă au fost depozitate la - 80 ° C după administrare.
Folosind un kit de reactivi Elecsys și un analizor Cobas e imunoanaliză (Roche Diagnostics GmbH, Germania), nivelurile de cortizol au fost determinate prin imunoanaliză electrochiluminiscentă (ECLIA) cu o sensibilitate ridicată de 0,054 ng/ml și coeficienți de variație intra și inter-test sub 10 %. Zonele de sub curbă în raport cu solul (ASC) reprezintă cantitatea totală de expunere la cortizol în timpul porțiunilor ciclului cortizol diurn prin metoda trapezoidală [25]. Panta cortizolului diurn (DCS) este caracterizată ca o scădere a cortizolului pe parcursul zilei și se calculează prin formula creșterea peste cursă ca panta liniei de la prima valoare a punctului de timp până la ultimul punct măsurat [26]. S-a dovedit că nu există nicio diferență între regresia liniară și formulele de creștere peste cursă [26]. Astfel, am calculat măsurile ritmului axei HPA pe baza nivelurilor de cortizol la 3 puncte de timp, AUC08: 00–16: 00, AUC16: 00–23: 00 și AUC08: 00–23: 00, precum și DCS.
Evaluarea metabolismului glucozei și lipidelor
Probele de sânge au fost prelevate la ora 8:00 după un post peste noapte de 12 ore pentru a testa glucoza de repaus alimentar (FG), insulina de repaus alimentar (FI), colesterolul total (TC), trigliceridele (TG) în grupul obezității și o parte a grupului cu greutate normal . Rezistența la insulină a fost determinată de formula modelului de evaluare a homeostaziei a rezistenței la insulină (HOMA-IR) = [[insulină de post (lU/ml) × glucoză de post (mmol/L)]/22,5.
Chestionare pentru activități fizice
Parametrii de somn ai copiilor au fost colectați prin chestionar parental. Părinții au raportat ora de culcare și de trezire a copiilor în timpul săptămânii și în weekend în luna precedentă. Durata medie a somnului a fost calculată după următoarea formulă: (durata somnului în zilele lucrătoare × 5 + durata somnului în weekend × 2)/7 [27].
Pentru a evalua activitatea fizică a copiilor, a fost folosit versiunea chineză a chestionarului studiului studiului activităților pentru petrecerea timpului liber pentru copii. Chestionarul a fost completat de copii cu ajutorul părinților lor, iar fiabilitatea și validitatea versiunii chinezești au fost verificate [28]. O listă de verificare a 31 de activități fizice și 13 comportamente sedentare a fost inclusă în chestionar. În funcție de intensitatea activității fizice, au existat 15 activități clasificate ca activități fizice cu intensitate viguroasă (VPA,> 6 MET) și 16 activități clasificate ca intensitate moderată (MPA, 3-5,9 MET) [28]. Pentru analiza datelor, timpul de ecranare a constat din 3 comportamente sedentare (SB, inclusiv vizionarea la TV sau filme, jocurile pe computer, navigarea pe internet sau jocul pe telefon); celelalte 10 au fost considerate comportamente sedentare fără ecran.
Analize statistice
A fost utilizat software-ul IBM SPSS Statistics (versiunea 24.0), iar nivelul de semnificație a fost acceptat cu P 2 coeficienți au fost aceiași în toate cele 4 modele de regresie liniară. Apoi, modelele au evaluat asocierea dintre timpul petrecut în fiecare comportament de mișcare în raport cu timpul petrecut în celelalte comportamente de mișcare și fiecare indicator de sănătate. Primul coeficient și P valoarea pentru fiecare model rotit a fost utilizată pentru a determina dacă comportamentul individual de mișcare a fost semnificativ asociat pozitiv sau negativ cu fiecare indicator de sănătate în raport cu timpul petrecut în alte comportamente de mișcare [31]. În rezumat, analiza compozițională este un model de regresie liniară multiplă în care măsurile cortizolului au fost modelate în funcție de somn, timp de ecran, timp non-ecran și MVPA.
Rezultate
Caracteristicile de bază
Un total de 57 de participanți au fost înscriși în studiu și împărțiți într-un grup de greutate normală (n = 22) și un grup de obezitaten = 35) conform IMC. Caracteristicile demografice, antropometrice și comportamentale sunt rezumate în Tabelul 1. Nu au existat diferențe între grupul de obezitate și grupul cu greutate normală în ceea ce privește vârsta, sexul, stadiul pubertal, înălțimea, durata somnului sau minutele MVPA.
Modele de cortizol diurn
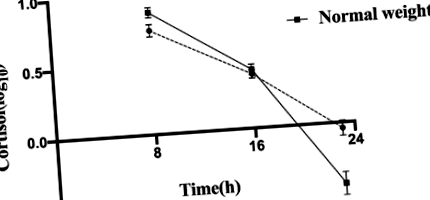
Tabelul 2 raportează statistici descriptive pentru ritmicitatea axei HPA la toți subiecții, care au arătat nivelurile maxime de cortizol dimineața și un nadir la miezul nopții. Mai mult, copiii cu obezitate au prezentat niveluri mai scăzute de cortizol la ora 08:00 (P = 0,030) și AUC08: 00–16: 00P = 0,027) și niveluri superioare la 23:00P Tabelul 2 Statistici descriptive pentru ritmicitatea axei HPA
Modele de cortizol diurn la copiii cu obezitate și greutate normală. Datele sunt exprimate ca medie ± SEM, iar barele de eroare arată eroarea standard a mediei. Variabilele de cortizol au fost transformate logaritmic
Măsuri ale axei HPA și ale stadiului pubertar
Nu au existat corelații semnificative între măsurile axei HPA și sex sau vârstă. Am testat apoi ipoteza că ASC a cortizolului poate fi influențată de pubertate, ceea ce a fost propus în alte studii [32, 33]. ASC a crescut odată cu dezvoltarea pubertară (ASC08: 00-16: 00:P = 0,008; AUC08: 00-23: 00: P = 0,005; ANOVA). După ajustări pentru IMC, relațiile de mai sus au rămas (AUC08: 00-16: 00: P = 0,002; AUC08: 00-23: 00: P = 0,002; ANCOVA), așa cum se arată în Fig. 2. Mai mult, testosteronul a fost legat pozitiv de ASC08: 00-16: 00 (r = 0,407, P = 0,023) și AUC08: 00–23: 00r = 0,443, P = 0,014) la copiii cu obezitate.
Măsuri ale axei HPA și antropometrie
Rezultatele regresiei multiple pentru asocieri între măsurile axei HPA și antropometrie la toți participanții sunt prezentate în tabelul 3. Cortizolul 08: 00 a fost asociat invers cu scorul z IMC (β = - 0,247, P = 0,036) și WHtR (β = - 0,295, P = 0,027). Cortizolul 23: 00 a fost asociat pozitiv cu scorul z IMC (β = 0,490, P Tabelul 3 Asocieri între indicele ritmului axei HPA și antropometrie
Măsurarea axei HPA și activitatea fizică 24 de ore
Pentru întregul eșantion, corelațiile fiecărui comportament de mișcare cu măsurile axei HPA în raport cu alte comportamente de mișcare sunt afișate în Tabelul 4. După ajustări pentru stadiul pubertar și scorul z IMC, asocieri inverse între cortizol08: 00 (γMVPA = - 0,107; P = 0,018), AUC08: 00-16: 00 (γMVPA = - 0,081; P = 0,038) și valorile absolute ale DCS (γMVPA = - 0,150; P = 0,007) cu timpul petrecut în MVPA în raport cu alte comportamente de mișcare au fost detectate. Mai mult decât atât, AUC16: 00-23: 00 s-a corelat pozitiv cu timpul petrecut în comportamente sedentare fără ecran (γnon-screen SB = 0,169; P = 0,009) și negativ cu timpul relativ petrecut în somn = γsleep = - 0,212; P = 0,018).
Măsuri ale axei HPA și ale metabolismului glucozei sau lipidelor
Nu au existat corelații semnificative între măsurile axei HPA și nivelurile serice de glucoză sau lipide, așa cum se arată în Tabelul 5.
Discuţie
În acest studiu transversal, raportăm influențele obezității, pubertății și activității fizice asupra ritmului cortizolului diurn la copii și adolescenți. Am găsit un ritm de cortizol circadian amortizat la copiii cu obezitate și pante mai plate și mai puțin declinate corelate cu gradele de adipozitate. Dinamica modificată a axei HPA a părut, de asemenea, să fie influențată de pubertate și distribuția mișcării de 24 de ore. Prin urmare, stabilizarea ritmurilor de cortizol circadian prin strategii de reglare circadiană poate fi o abordare importantă pentru prevenirea obezității la copii.
Studii recente la om au arătat că concentrațiile de cortizol cresc semnificativ pe parcursul pubertății și adolescenței [38, 39], ceea ce este în concordanță cu constatările noastre. ASC crescută a cortizolului salivar ar putea reflecta o activitate generală mai mare a glandei suprarenale pe tot parcursul pubertății. De fapt, sa sugerat că procesul de dezvoltare a pubertății, împreună cu modificările endocrine, influențează funcționarea axei HPA [40]. De asemenea, am constatat că testosteronul la copiii cu obezitate s-a corelat pozitiv cu ASC08: 00–16: 00 și ASC08: 00–23: 00, în concordanță cu fenomenul co-activării, unde cortizolul și testosteronul (și dehidroepiandrosteronul) sunt legate pozitiv în individual [41]. În consecință, aceste descoperiri evidențiază rolul important al hormonilor gonadali în dezvoltarea ciclului cortizolului circadian în timpul pubertății, indicând faptul că pubertatea este o variabilă foarte corelată și ar trebui inclusă ca o covariabilă în studiile care caută să exploreze relația dintre ritmurile cortizolului și obezitatea adolescentului. .
Descoperirile noastre sugerează, de asemenea, că comportamentele sedentare non-ecran crescute și durata inadecvată a somnului sunt asociate cu o producție mai mare de cortizol nocturn. Odată cu pierderea somnului, cortizolul își poate exercita efectele metabolice dăunătoare prin menținerea unor concentrații mari pe timp de noapte, care sunt asociate cu rezistența la insulină (IR), imunitatea suprimată și inflamația crescută [44]. Astfel, concluziile acestei abordări integrate indică faptul că distribuția relativă a timpului petrecut în diferite activități fizice într-o perioadă de 24 de ore este importantă pentru promovarea sănătății și menținerea ritmului cortizolului diurn în populația pediatrică.
Aici, prezentăm un studiu preliminar care a examinat relația dintre indicii cortizolului salivar și caracteristicile clinice ale copiilor și adolescenților. Cu toate acestea, ar trebui menționate unele limitări. Nu au fost incluși indicele de stare socioeconomică, datele dietetice și nivelul hormonilor de creștere, iar acești factori pot fi legați de ritmurile de cortizol. Mai mult, dimensiunea redusă a eșantionului și timpul de prelevare au limitat rezultatele suplimentare, în special în ceea ce privește verificarea corelațiilor ritmurilor cortizolului cu metabolismul lipidelor și glucozei. În cele din urmă, nivelul și intensitatea PA, SB și durata somnului au fost raportate de părinți sau de sine, iar aceste măsurători subiective ar putea confunda rezultatele.
Concluzie
Acest studiu oferă o perspectivă inițială asupra asocierilor complexe și corelate dintre ritmul cortizolului diurn și obezitatea în timpul copilăriei și adolescenței. Am demonstrat niveluri reduse de cortizol dimineața și niveluri crescute noaptea la obezitatea infantilă. Pante mai plate și mai puțin declinate corelate cu adipozitatea, indicând o modificare a ritmului circadian al cortizolului cu adipozitatea. Descoperirile noastre susțin, de asemenea, importanța unei distribuții adecvate a mișcării de 24 de ore pentru o sănătate optimă și sistemul circadian la copii și tineri. Sincronizarea intervențiilor de exerciții și nutrienți cu ceasul circadian ar putea maximiza beneficiile care promovează sănătatea intervențiilor pentru prevenirea și tratarea bolilor metabolice [50]. Astfel, abordările cronoterapeutice care vizează menținerea ritmurilor normale printr-un stil de viață sănătos pot fi eficiente în contracararea obezității și a altor boli metabolice la copii și adolescenți.
Disponibilitatea datelor și a materialelor
Datele utilizate pentru a susține concluziile acestui studiu sunt disponibile de la autorul relevant, la cerere.
- Educarea profesioniștilor din domeniul sănătății în advocacy pentru prevenirea obezității la copii
- Educarea profesioniștilor din domeniul sănătății în pledoaria pentru prevenirea obezității la copii în rândul lor
- Privarea cronică de somn legată de obezitatea infantilă - CBS News
- Gabriel Iglesias validează știrea Știrile obezității în copilărie
- Dezbaterea responsabilității părintești pentru obezitatea copilului Considerații etice și juridice bariatrice