Subiecte
Abstract
Scopul acestui studiu a fost să investigheze drenajul limfatic al țesutului adipos subcutanat (ATLD) al macromoleculelor la subiecții slabi și obezi și, în plus, să evalueze dacă ATLD se poate modifica în paralel cu fluxul sanguin al țesutului adipos. Subiecții masculi slabi și obezi au fost studiați înainte și după o sarcină orală de glucoză. Fluxul sanguin de țesut adipos a fost măsurat în țesutul adipos abdominal subcutanat anterior prin tehnica de spălare 133 Xe. ATLD a fost măsurată ca rata de dispariție a albuminei umane nanoagregate marcate cu 99m Tc, în timpul postului și după o încărcare de glucoză pe cale orală. O creștere semnificativă a ATLD a fost observată după încărcarea glucozei la subiecții slabi. La subiecții obezi, ATLD a rămas constant pe tot parcursul studiului și a fost semnificativ mai mic în comparație cu subiecții slabi. Aceste rezultate indică o capacitate redusă de a elimina macromoleculele din spațiul interstițial prin sistemul limfatic la subiecții obezi. Mai mult, sugerează că modificările postprandiale în ATLD care au loc la subiecții slabi nu sunt observate la subiecții obezi. Acest lucru poate avea un rol în dezvoltarea inflamației legate de obezitate în țesutul adipos hipertrofic.
Introducere
Obezitatea este legată de o stare ușoară și cronică de inflamație atât la nivelul întregului corp, cât și în țesutul adipos. Inflamația din țesutul adipos pare să aibă un rol important în dezvoltarea complicațiilor cardiovasculare și metabolice legate de obezitate. 1 În țesutul adipos pare să existe un ciclu vicios cu adipocite și macrofage care produc diverse macromolecule pro-inflamatorii (de exemplu, citokine și chemokine). Acestea promovează atracția și acumularea de macrofage ulterioare. 2 Unele dintre aceste macromolecule sunt eliberate în circulația sistemică în cantități considerabile. Acest lucru a fost demonstrat de tehnica de eșantionare arterio-venoasă. Cu toate acestea, în cazul unor citokine cum ar fi factorul de necroză tumorală-alfa, nu se poate măsura nicio eliberare netă prin această tehnică. 3 Dimpotrivă, o concentrație interstițială ridicată în țesutul adipos poate fi măsurată prin tehnica de microdializă. 4
Într-un studiu recent realizat de Miller și colab., 5 a fost investigat rolul drenajului limfatic în îndepărtarea macromoleculelor din țesutul adipos la subiecții slabi. Interesant, cu cât raza moleculară este mai mare, cu atât este mai mare proporția care este transportată prin sistemul limfatic. S-a descoperit că factorul de necroză tumorală-alfa, care are o rază moleculară de 3,24 nm, este transportat departe de țesutul adipos în întregime prin capilarele limfatice.
Nu s-a studiat dacă capacitatea de a elimina macromoleculele din spațiul interstițial prin sistemul limfatic din țesutul adipos este modificată la subiecții obezi. Prin urmare, scopul nostru în acest studiu a fost de a elucida dacă drenajul limfatic al țesutului adipos subcutanat abdominal (ATLD) al macromoleculelor a fost modificat la subiecții obezi comparativ cu subiecții slabi.
Este bine cunoscut faptul că fluxul sanguin al țesutului adipos subcutanat (ATBF) crește postprandial la subiecții slabi. Răspunsul este, de asemenea, clar marcat la subiecții obezi. 6 Deoarece creșterea subiecților slabi implică recrutarea capilară, este probabil ca acest lucru să ducă la o filtrare crescută a fluidului în spațiul interstițial. 7 Cel mai probabil acest lucru crește presiunea interstițială și, astfel, fluxul limfatic. Prin urmare, un alt scop a fost de a investiga dacă creșterea postprandială a ATBF subcutanat abdominal este urmată de o creștere a ATLD.
Materiale și metode
Subiecte
Au fost studiați șase bărbați slabi, sănătoși și șase bărbați obezi, dar altfel sănătoși, cu toleranță normală la glucoză (determinată de un test oral de toleranță la glucoză) (indicele de masă corporală: 22,3 ± 1,2 și 35,7 ± 4,5 kg m −2, vârstă: 22,1 ± 2,5 și respectiv 34 ± 8,1 ani). Grăsimea întregului corp a fost determinată prin absorptiometrie cu raze X cu energie duală (17,2 ± 2,4% și respectiv 34,2 ± 3,4%). Grosimea pliului abdominal periumbilical a fost măsurată cu un etrier Harpenden Skinfold (Baty International, Burgess Hill, Marea Britanie) (15,4 ± 4,4 și respectiv 36,5 ± 12,0 mm).
Studiul a fost realizat conform Declarației de la Helsinki II și a fost aprobat de Comitetele de Etică Științifică din Regiunea Capitalei, Danemarca (proiect nr. H-3-2011-019).
Protocol
După un post peste noapte, subiecții au fost studiați în decubit dorsal cu temperatura ambiantă menținută la 24 ° C. ATBF și ATLD subcutanate abdominale anterioare au fost măsurate simultan în timpul postului (timp 0) și timp de aproximativ 140 de minute după o încărcătură orală de glucoză de 75 g.
Măsurători
ATLD a macromoleculelor
Pentru a măsura ATLD am folosit 99m Tc-albumină-nanocoloid cu o rază medie de 6-8 nm (Nanocoll, GE Healthcare, Milano, Italia). Un volum de 1 MBq Nanocoll în 0,1 ml clorură de sodiu izotonică (conținând particule de 50 μg) a fost injectat intradermic în cadranul inferior stâng-abdominal. Rata de spălare a fost măsurată continuu cu un dispozitiv de numărare a scintilațiilor (Mediscint, Oakfield Instruments, Oxford, Marea Britanie). 8
Fluxul de sânge al țesutului adipos
ATBF a fost măsurat prin tehnica 133 Xe-washout. Un volum de 1 MBq gazos 133 Xe amestecat în 0,1 ml de aer (Laboratorul Hevesy, Laboratorul Național Risø, Roskilde, Danemarca) a fost injectat subcutanat în cadranul superior drept-abdominal. Rata de spălare a fost măsurată continuu cu un dispozitiv de numărare a scintilațiilor (Mediscint, Oakfield Instruments, Oxford, Marea Britanie). 9
Calcule
ATLD a macromoleculelor
Când curba de spălare a depozitului Nanocoll pare să reprezinte doar jumătatea biologică subcutanată a Nanocoll (îndepărtarea prin sistemul limfatic) și jumătatea fizică de 99 m Tc, s-a efectuat măsurarea postului. Prin corectarea decăderii radioactive 99m Tc, am obținut o curbă mono-exponențială, din care am calculat ATLD ca constantă a ratei de spălare (k) din depozit. ATLD a fost calculat în perioade de 20 de minute.
Fluxul de sânge al țesutului adipos
ATBF a fost calculat prin înmulțirea coeficientului de partiție țesut-sânge de 133 Xe (care se presupunea a fi 10 g ml -1) și a constantei ratei monoexponențiale din curba de spălare de 133 Xe. 10 ATBF au fost calculate în perioade de 20 de minute.
analize statistice
t-testul pentru datele nepereche a fost utilizat pentru compararea grupurilor. t-testul pentru date asociate a fost utilizat pentru compararea diferitelor puncte de timp din cadrul grupurilor. Semnificația statistică a fost stabilită la P
Rezultate
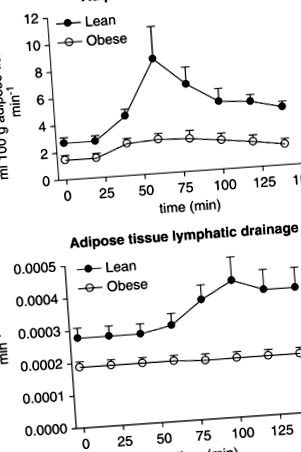
Figura 1 arată durata medie a ATBF (panoul superior) și ATLD (panoul inferior) în cele două grupuri experimentale. Cu toate acestea, datorită unei variații mari interindividuale a întârzierii între aportul de glucoză și modificarea ATBF și ATLD ulterior, valorile individuale maxime medii sunt date în Figura 2.
Evoluția în timp a modificărilor fluxului sanguin al țesutului adipos (panoul superior) și al drenajului limfatic al țesutului adipos (panoul inferior) la subiecții slabi și obezi după aportul de glucoză. Media ± s.e.m. sunt date.
Postul și fluxul sanguin maxim al țesutului adipos indus de glucoză (panoul superior) și drenajul limfatic al țesutului adipos (panoul inferior) la subiecții slabi și obezi. Media ± s.e.m. sunt date.
În starea de repaus alimentar, ATBF a fost semnificativ mai mare la subiecții slabi comparativ cu subiecții obezi (2,7 ± 1,0 și 1,5 ± 0,8 ml 100 g -1 min -1, respectiv, P= 0,03). La subiecții slabi creșterea maximă a ATBF a avut loc la aproximativ 40 de minute după aportul de glucoză (6,5 ± 5,3 ml 100 g -1 min -1, P= 0,03). La subiecții obezi creșterea ATBF a atins un moment similar, creșterea maximă fiind de 1,4 ± 0,6 ml 100 g -1 min -1 (P −1, respectiv, P= 0,03). La subiecții slabi, creșterea ATBF a fost urmată de o creștere semnificativă a ATLD la 0,00047 ± 0,00015 min -1 (P= 0,01). În ciuda creșterii ATBF, ATLD la subiecții obezi a rămas constant pe tot parcursul studiului (Figura 2, panoul inferior).
Discuţie
Aici raportăm că îndepărtarea limfatică a macromoleculelor din țesutul adipos abdominal subcutanat anterior este semnificativ mai mică în starea de post la subiecții obezi comparativ cu subiecții slabi. În plus, creșterea postprandială a fluxului sanguin al țesutului adipos este urmată de o creștere a îndepărtării limfatice a macromoleculelor din țesutul adipos abdominal subcutanat la subiecții slabi, în timp ce acest lucru nu a putut fi observat la subiecții obezi.
Albumina nanoagregată (Nanocoll) este utilizată în prezent pentru diagnosticul scintigrafic al limfoedemului la extremitățile inferioare și superioare. Este bine validat în ceea ce privește farmacocinetica, deoarece este îndepărtat numai prin drenajul limfatic atunci când este injectat intradermic sau subcutanat. 8 Calea pentru macromolecule departe de spațiul interstițial implică mișcări între structurile matricei extracelulare, mișcări în vasele limfatice inițiale și mai departe în colectoarele limfatice adecvate. 8 Mai multe situri din această cale pot da naștere la restricționarea capacității de drenaj limfatic. O restricție ar putea fi re-modelarea matricei extracelulare. O astfel de remodelare a fost demonstrată în țesutul adipos hipertrofic în care fibrele de elastină sunt adesea defalcate, iar structura colagenului este modificată în legătură cu dezvoltarea fibrozei. 11, 12 Eliminarea limfatică redusă a macromoleculelor găsite la subiecții obezi comparativ cu subiecții slabi în stare de post și lipsa modificărilor legate de masă în această îndepărtare s-ar putea datora unor astfel de restricții. Nu am investigat gradul de fibroză și posibila pierdere a elasticității în țesut în prezentul experiment.
Perspectivele prezentelor constatări sunt că atât drenajul limfatic redus practic al macromoleculelor, cât și lipsa modificărilor postprandiale în acest drenaj pot da naștere unui timp de ședere prelungit pentru macromoleculele inflamatorii și macrofagele extravazate în țesutul adipos. Acest lucru poate determina o producție locală ridicată și, astfel, eliberarea crescută a citokinelor și chemokinelor pro-inflamatorii mici în circulația sistemică prin drenajul venos al țesutului adipos.
Referințe
Ouchi N, Parker JL, Lugus JJ, Walsh K. Adipokine în inflamație și boli metabolice. Nat Rev Immunol 2011; 11: 85-97.
Dalmas E, Clément K, Guerre-Millo M. Definirea fenotipului și funcției macrofagelor în țesutul adipos. Tendințe Immunol 2011; 32: 307-314.
Mohamed-Ali V, Goodrick S, Rawesh A, Katz DR, Miles JM, Yudkin JS și colab. Țesutul adipos subcutanat eliberează interleukina-6, dar nu factorul de necroză tumorală-α, in vivo. J Clin Endocrinol Metab 1997; 82: 4196-4200.
Clausen TS, Kaastrup P, Stallknecht B. Răspunsul țesutului proinflamator și recuperarea adipokinelor pe parcursul a 4 zile de microdializă subcutanată cu pori mari. Metode J Pharmacol Toxicol 2009; 60: 281-287.
Miller NE, Michel CC, Nanjee MN, Olszewski WL, Miller IP, Hazell M și colab. Secreția adipokinelor de către țesutul adipos uman in vivo: partiționarea între transportul capilar și cel limfatic. Am J Physiol Endocrinol Metab 2011; 301: 659–667.
Summers LKM, Samra JS, Humphreys SM, Morris RJ, Frayn KN. Fluxul sanguin al țesutului adipos abdominal subcutanat: variație la subiecți și între subiecți și relația cu obezitatea. Clin Sci 1996; 91: 679-683.
Tobin L, Simonsen L, Bülow J. Determinarea în timp real a ultrasunetelor cu contrast îmbunătățită a volumului de sânge microvascular în țesutul adipos subcutanat abdominal la om. Dovezi pentru recrutarea capilară a țesutului adipos. Clin Physiol Funct Imaging 2010; 30: 447-452.
Jensen MR, Simonsen L, Karlsmark T, Bülow J. Limfoedemul extremităților inferioare - fundal, fiziopatologie și considerații diagnostice. Clin Physiol Funct Imaging 2010; 30: 389-398.
Simonsen L, Enevoldsen LH, Bülow J. Determinarea fluxului sanguin al țesutului adipos cu clearance-ul local 133Xe. Evaluarea unei noi tehnici de etichetare. Clin Physiol Funct Imaging 2003; 23: 320–323.
Bülow J, Jelnes R, Astrup A, Madsen J, Vilmann P. Coeficienții de partiție a țesutului/sângelui pentru xenon în diferite depozite de țesut adipos la om. Scand J Clin Lab Invest 1987; 47: 1–3.
Spencer M, Unal R, Zhu B, Rasouli N, McGehee RE, Peterson CA. și colab. Matricea extracelulară a țesutului adipos și anomalii vasculare în obezitate și rezistență la insulină. J Clin Endocrinol Metab 2011; 96: 1990–1998.
Divoux A, Clément K. Arhitectura și matricea extracelulară: componentele încă neapreciate ale țesutului adipos. Obes Rev. 2011; 12: 494-503.
Uzarski J, Drelles MB, Gibbs SE, Ongstad EL, Goral JC, McKeown KK și colab. Rezoluția limfedemului prin fluxul interstițial în pielea cozii șoarecelui. Am J Physiol Heart Circ Physiol 2008; 294: 1326–1334.
Tobin L, Simonsen L, Bülow J. Dinamica microcirculației în țesutul adipos subcutanat este afectată în starea postprandială în diabetul de tip 2. Clin Physiol Funct Imaging 2011; 31: 458–463.
Mulțumiri
Acest studiu a primit sprijin financiar de la Fundația Novo Nordic.
Informatia autorului
Afilieri
Departamentul de Fiziologie Clinică și Medicină Nucleară, Spitalul Bispebjerg, Universitatea din Copenhaga, Copenhaga, Danemarca
N Arngrim, L Simonsen și J Bülow
Departamentul de Științe Biomedice, Institutul Panum, Universitatea din Copenhaga, Copenhaga, Danemarca
N Arngrim, J J Holst și J Bülow
Centrul Fundației Novo Nordisk pentru Cercetări Metabolice de Bază, Institutul Panum, Universitatea din Copenhaga, Copenhaga, Danemarca
N Arngrim și J J Holst
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
- Mecanisme de reglementare pentru macrofagele țesutului adipos M1 și M2 la diabet zaharat la șoareci obezi
- Suc de prune Queen Garnet și zmeură cordială la subiecți obezi ușor hipertensivi sau supraponderali A
- Nivelurile serice ale enzimelor pancreatice la subiecții slabi și obezi SpringerLink
- Condimentează-ți viața Țesutul adipos și inflamația
- Țesutul mamar mai rigid la femeile obeze promovează tumorile Sandra și Edward Meyer Cancer Center