Anjali Amin
Secția de Medicină de Investigație, Facultatea de Medicină, Imperial College London, Etajul 6, Clădirea Commonwealth, Spitalul Hammersmith, Du Cane Road, Londra W12 0NN, Marea Britanie
Waljit S. Dhillo
Secția de Medicină de Investigație, Facultatea de Medicină, Imperial College London, Etajul 6, Clădirea Commonwealth, Spitalul Hammersmith, Du Cane Road, Londra W12 0NN, Marea Britanie
Kevin G. Murphy
Secția de Medicină de Investigație, Facultatea de Medicină, Imperial College London, Etajul 6, Clădirea Commonwealth, Spitalul Hammersmith, Du Cane Road, Londra W12 0NN, Marea Britanie
Abstract
Obezitatea este o problemă majoră de sănătate publică la nivel mondial. Tratamentele farmacologice actuale sunt în mare parte nereușite. Determinarea căilor complexe care reglează consumul de alimente poate ajuta la dezvoltarea de noi tratamente. Axa hipotalamo-hipofizo-tiroidiană (HPT) are efecte bine cunoscute asupra cheltuielilor de energie, dar rolul său în reglarea aportului alimentar este mai puțin bine caracterizat. Dovezile sugerează că axa HPT poate influența direct aportul de alimente. Disfuncția tiroidiană poate avea consecințe semnificative clinic asupra apetitului și greutății corporale. În mod clasic, aceste efecte au fost considerate a fi mediate de efectele periferice ale hormonului tiroidian. Cu toate acestea, mai recent, sa considerat că reglarea locală a hormonului tiroidian în sistemul nervos central (SNC) joacă un rol important în reglarea fiziologică a poftei de mâncare. Această lucrare se concentrează pe rolul HPT și al hormonului tiroidian în apetit și oferă dovezi pentru potențiale noi ținte pentru agenții anti-obezitate.
1. Introducere
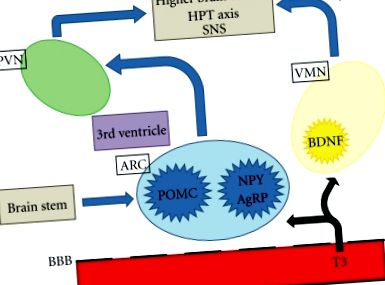
Obezitatea, complicațiile acesteia și mortalitatea asociată sunt probleme majore de sănătate publică la nivel mondial. Principalele zone ale sistemului nervos central (SNC) importante în reglarea poftei de mâncare sunt hipotalamusul și trunchiul cerebral. Hipotalamusul interpretează și integrează semnalele aferente de la periferie și trunchiul cerebral pentru a modula semnalele eferente care reglează consumul de alimente și consumul de energie. Semnalele periferice neuronale și hormonale comunică informații, inclusiv stări nutriționale acute și stocuri de energie. Hipotalamusul este împărțit într-un număr de nuclee interconectate, inclusiv nucleul paraventricular (PVN), nucleul ventromedial (VMN) și nucleul arcuat (ARC), care sunt deosebit de importante în reglarea homeostaziei energetice. ARC este situat în apropierea eminenței mediane, unde bariera hematoencefalică este incompletă și, prin urmare, este bine poziționată pentru a răspunde factorilor circulanți implicați în apetit și consumul de alimente [1]. Dovezi recente sugerează că hormonii tiroidieni pot accesa ARC și alte regiuni ale hipotalamusului pentru a regla apetitul (Figura 1).
Diagrama schematică a reglării apetitului central. T3 poate accesa hipotalamusul și trunchiul cerebral prin bariera hematoencefalică incompletă. PVN: nucleu paraventricular; ARC: nucleu arcuat; VMN: nucleu ventromedial; BBB: barieră hematoencefalică; T3: triiodotironină; POMC: Pro-opiomelanocortină; NPY: neuropeptidă Y; AgRP: proteină legată de agouti; BDNF: factor neurotrofic derivat din creier; HPT: tiroida hipotalamo-hipofizară; SNS: sistem nervos simpatic.
Este bine stabilit că axa hipotalamo-hipofizo-tiroidiană (HPT) reglează greutatea corporală. Se știe că hormonii tiroidieni afectează rata metabolică. Disfuncția tiroidiană poate avea consecințe semnificative clinic asupra apetitului și greutății corporale. Hipotiroidismul determină în mod clasic reducerea cheltuielilor de energie bazală [2] cu creșterea în greutate [3, 4]. În schimb, hipertiroidismul crește consumul de energie și reduce greutatea corporală [5-7]. În mod tradițional, sa presupus că această greutate corporală redusă este cea care determină hiperfagia care poate fi o caracteristică prezentantă în hipertiroidism. Cu toate acestea, dovezi recente sugerează că axa HPT poate juca un rol direct în reglarea hipotalamică a poftei de mâncare, independent de efectele asupra cheltuielilor de energie. Clasic, hormonul hipotalamic de eliberare a tirotropinei (TRH) stimulează eliberarea hormonului stimulator al tiroidei (TSH) din glanda pituitară anterioară, care apoi stimulează eliberarea ambilor hormoni tiroidieni, tri-iodotironină (T3) și tiroxină (T4). Rapoartele sugerează că toate aceste molecule de semnalizare pot influența direct aportul de alimente [8-11]. Înțelegerea îmbunătățită a rolului axei HPT și a hormonului tiroidian în apetit poate identifica noi ținte pentru agenții anti-obezitate.
2. Efectele hormonilor tiroidieni asupra consumului de alimente (Tabelul 1)
tabelul 1
Efectul TRH, TSH și T3 asupra consumului de alimente. Administrarea centrală a TRH și TSH la rozătoare determină o reducere a aportului de alimente [8, 12, 13]; efecte similare asupra consumului de alimente se observă după administrarea periferică de TRH [14]. Administrarea centrală și periferică a T3 crește aportul de alimente [9-11]. TRH: hormon care eliberează tirotropina; TSH: hormon stimulator al tiroidei; T3: triiodotironină.
Există efecte bine caracterizate ale postului asupra expresiei TRH hipotalamice. Acest lucru se crede în primul rând că reglează în jos axa HPT în perioade de disponibilitate limitată a alimentelor, reducând astfel consumul de alimente. Cu toate acestea, s-a raportat că TRH are efecte anorectice directe, sugerând că poate regla aportul alimentar independent de efectele asupra axei HPT. La rozătoare, administrarea centrală a TRH reduce consumul de alimente [8, 12, 13]; efecte similare asupra consumului de alimente se observă după administrarea periferică [14].
Sa demonstrat că TSH reduce consumul de alimente atunci când este injectat central la șobolani [8]. Există dovezi că TSH din pars tuberalis este implicat în răspunsul fotoperiodic la păsări și rozătoare și, prin urmare, este posibil ca TSH să fie implicat cu modificări sezoniere ale aportului alimentar și ale greutății corporale care apar la unele specii [15-17].
Hiperfagia asociată cu hipertiroidismul poate fi rezultatul hormonilor tiroidieni care acționează direct asupra circuitelor apetitului SNC. T3 stimulează direct aportul de alimente la nivelul hipotalamusului. La modelele de rozătoare, administrarea hipotalamică periferică și centrală a T3 crește aportul de alimente [9-11].
Există mai multe mecanisme postulate pentru a media efectele orexigenice ale hormonilor tiroidieni. ARC conține două populații neuronale distincte de reglare a homeostaziei energetice. O subpopulație exprimă gena pro-opiomelanocortină (POMC) care codifică hormonul anorectic neuropeptidic alfa-melanocitar care stimulează hormonul (α-MSH). Celălalt exprimă factorii orexigenici neuropeptidă Y (NPY) și proteina asociată cu agouti (AgRP). S-a raportat că administrarea periferică a T3 crește mRNA hipotalamic NPY și că administrarea intracerebroventriculară (ICV) a unui antagonist al receptorului NPY Y1 blunt hiperfagia indusă de T3, sugerând că T3 poate crește pofta de mâncare prin NPY [10]. Administrarea T3 a fost, de asemenea, pentru a reduce expresia hipotalamică a POMC [10]. Un alt studiu nu a detectat modificări ale expresiei neuropeptidelor hipotalamice ca răspuns la administrarea periferică de T3, deși acest lucru poate reflecta diferitele doze de T3 administrate [9].
Cu toate acestea, efectele hormonilor tiroidieni asupra consumului de alimente nu pot fi mediate direct de ARC. Administrarea directă de T3 în VMN, dar nu și ARC crește aportul de alimente la șobolani [9]. Deoarece circuitele de reglare a apetitului din ARC sunt cunoscute a fi modificate de modificările HPT, poate exista un efect indirect al ARC prin intermediul VMN, permițând intra-VMN T3 să crească aportul de alimente. În concordanță cu aceasta, există intrări de excitare în neuronii POMC care provin din VMN [18].
Se crede că enzima 5 ′ proteină kinază activată cu adenozină monofosfat (AMPK) acționează ca un senzor care reglează homeostazia energiei celulare. AMPK este activat prin fosforilare, iar activarea AMPK în ARC crește aportul de alimente [25]. T3 administrat periferic crește fosforilarea AMPK hipotalamică, care poate media astfel efectele orexigenice ale T3 [11].
Derivații hormonilor tiroidieni au fost implicați și în reglarea poftei de mâncare. Receptorul 1 asociat cu amina cuplat cu proteina G (TAAR1) este exprimat în hipotalamusul șobolanului și este asociat cu reglarea homeostaziei energetice. Derivatul hormonului tiroidian 3-iodotironamină (T1AM), o amină biogenă endogenă, este un puternic agonist al TAAR1. Studiile pe rozătoare arată că T1AM crește semnificativ aportul de alimente la șobolani, atunci când este administrat intraperitoneal, ICV sau direct în ARC [26]. Cu toate acestea, relevanța fiziologică a acestor efecte rămâne necunoscută.
Receptorul hormonului tiroidian (TR) sau receptorii care mediază efectele hormonilor tiroidieni asupra apetitului sunt necunoscuți. Există două tipuri principale de receptori ai hormonului tiroidian - receptorul hormonului tiroidian α (THRA) și receptorul hormonului tiroidian β (THRB), fiecare codificat de o genă distinctă. Aceste gene sunt îmbinate alternativ pentru a genera trei izoforme majore ale receptorilor nucleari foarte omologi (TRα1, TRβ1 și TRβ2) cu distribuții tisulare specifice [27]. Cele trei izoforme principale leagă T3 cu afinitate ridicată și reglează transcripția mediată de hormoni tiroidieni. TRα este principala izoformă care reglează activitatea T3 în inimă, mușchi scheletic, os și creier; TRβ este principala izoformă care reglează activitatea T3 în ficat. Țesutul adipos exprimă atât TRα, cât și TRβ. TRβ1 este exprimat în majoritatea țesuturilor, în timp ce TRβ2 este exprimat exclusiv în hipotalamus, hipofiză, cohlee și retină [28, 29]. Toate cele trei izoforme sunt exprimate în hipotalamusul uman într-un număr de nuclee, inclusiv nucleul infundibular, echivalentul uman al ARC și nucleii supraoptici și paraventriculari.
Deși hormonii tiroidieni pot crește direct aportul de alimente în hipotalamus, s-a demonstrat că vizarea selectivă a subtipurilor TR are efecte metabolice benefice. Activarea receptorului TRβ reduce greutatea corporală la șobolanii obezi [30], care poate fi rezultatul unei creșteri a ratei metabolice. Prin urmare, agoniștii TRβ au fost propuși ca tratamente pentru obezitate. Țintirea TR cu un agonist selectiv TRβ poate determina dacă acești agenți abordează efectele metabolice ale hormonului tiroidian, fără efecte asupra țesuturilor care exprimă TRα, cum ar fi inima [30]. Administrarea periferică a unui agonist selectiv TRβ la șobolani în timpul hrănirii cu o dietă bogată în grăsimi previne creșterea preconizată a masei grase, a intoleranței la glucoză și a hipertrigliceridemiei [31]. Aceste efecte pot reflecta consumul crescut de energie observat la rozătoarele tratate cu un agonist selectiv TRβ, mai degrabă decât efectele hormonilor tiroidieni asupra apetitului [32]. Sunt necesare lucrări suplimentare pentru a identifica receptorul responsabil pentru efectele orexigenice ale T3 în hipotalamus.
3. Efectele stării nutriționale asupra hormonilor tiroidieni
Reducerea TRH ca răspuns la post poate fi importantă deoarece TRH se observă că are un efect anorectic direct atunci când este injectat în hipotalamus [13]. Este posibil să existe populații neuronale TRH distincte care reglează axa HPT și reglează apetitul.
În perioadele de disponibilitate limitată a alimentelor, există o reglare descendentă centrală a axei HPT. Nivelurile serice de T4 și T3 scad în timpul postului la om [33] și la rozătoare [34, 35]. Deoarece majoritatea T3 la rozătoare provine din glanda tiroidă, se consideră că lipsa alimentelor poate duce la o scădere a eliberării de T4 și T3. Acest lucru este probabil secundar unei reduceri a expresiei TRH hipotalamice, efect care poate fi mediat de hormonul adipos leptina (Figura 2).
- RELAȚIA ÎNTRE HORMONII TIROIDI, ANTICORPII ANTITIROIDI, TRANSGLUTAMINAZA ANTIȚISUTURILOR ȘI
- Boala tiroidiană în timpul sarcinii Ce trebuie să știți - Hormonii tiroidieni sunt necesari pentru fătul normal
- Două studii evidențiază efectele dietei și microbiomului asupra inimii și a îmbătrânirii
- Care sunt efectele fast-food-ului asupra obezității în copilărie Medical News Bulletin Health News și
- Care sunt cauzele și tratamentele pierderii poftei de mâncare la bebeluși - sănătatea vieții