Abstract
pierderea în greutate post-vătămare este o consecință frecventă a oricărei proceduri chirurgicale sau a unui accident major, inclusiv a leziunii măduvei spinării (SCI). Etapele timpurii ale SCI sunt marcate imediat de cheltuieli energetice reduse, rata catabolică crescută și pierderi mari de azot care pot dura de la săptămâni la câteva luni (29, 30, 43). Pierderile de azot în urma SCI sunt agravate de dezutilizarea bruscă și completă a atrofiei musculare sub nivelul leziunii și aceste pierderi persistă în ciuda suplimentării parenterale. Calculele nutriționale parenterale în îngrijirea acută a SCI umane sunt în mare măsură inadecvate atunci când se bazează pe ecuația Harris-Benedict utilizată în mod obișnuit (29, 43). De exemplu, această inadecvare a suplimentării a dus la o stare nutrițională slabă la subiecții paraplegici și tetraplegici pe o perioadă de observație de 2 săptămâni (29).
În general, rapoartele clinice indică faptul că persoanele SCI sunt expuse riscului unei incapacități pe tot parcursul vieții de a menține un echilibru energetic neutru (de exemplu, Ref. 7, 29, 30, 47, 48). Deficiențele nutriționale care conduc la o masă corporală subponderală în SCI prezintă o serie de factori de risc pentru individ atât în fazele acute, cât și în cele cronice ale leziunii. Greutatea corporală redusă crește riscul de a dezvolta infecție și prelungește procesul de recuperare după leziuni traumatice majore (13, 14). Mai mult, o masă de grăsime subcutanată insuficientă crește riscul apariției ulcerelor de presiune (1, 45). Prezentarea ulcerelor de presiune recurente, la rândul său, este o comorbiditate care declanșează eliberarea citokinelor proinflamatorii, care poate exacerba starea cachexică a pacientului (8).
Scopul nostru a fost de a testa grăsimea și masa slabă post-vătămare și riscul rezultat de a dezvolta fie pierderea excesivă a masei grase (subponderală), fie sindromul metabolic legat de obezitate din cauza adipozității excesive, la animalele cu tranziție cronică a măduvei spinării la nivel T3. Mai exact, am analizat in vivo toată masa de grăsime corporală cu RMN, pentru comparație cu greutățile ex vivo ale tamponului de grăsime și greutățile întregului corp după o transecție spinală toracică ridicată. În plus, am analizat aportul caloric zilnic al animalelor SCI cronice, glucoza bazală, toleranța la glucoză, insulina plasmatică și leptina, precum și nivelurile post mortem ale proteinei de decuplare-1 (UCP1) ca marker pentru termogeneză în țesutul adipos brun. Această din urmă măsură a servit ca măsură indirectă a termogenezei la ambele grupuri de animale.
Toate procedurile au fost efectuate în conformitate cu liniile directoare ale Institutelor Naționale de Sănătate și au fost aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor de la Centrul de cercetare biomedicală Pennington. Șobolani femele Wistar (n = 16; Harlan) au fost menținute într-o cameră cu temperatură controlată pe un ciclu de lumină-întuneric de 12: 12-ore cu acces nerestricționat la alimente și apă. Animalele au fost adăpostite în perechi până la intervenția chirurgicală, care a avut loc la vârsta de 12 săptămâni, după care animalele au fost adăpostite individual și observate zilnic. Un grup de șobolani a fost repartizat aleatoriu pentru a primi o tranziție a măduvei spinării centrată la T2-T3 (n = 10), și șobolanii rămașin = 6) au fost selectate pentru a servi drept controale chirurgicale. Greutățile corporale înainte de operație au fost înregistrate și testate pentru a se asigura că nu există o diferență semnificativă de greutate între grupuri.
Proceduri chirurgicale și îngrijirea animalelor.
Îngrijirea cronică atât a animalelor simulate, cât și a animalelor rănite a folosit procedurile descrise anterior (6). Postoperator, animalele au fost ținute într-un mediu cald și au primit lichide suplimentare subcutanate (5-10 cc Ringer lactat), analgezice (carprofen, 5 mg/kg ip; Pfizer Animal Health, Lititz, PA) o dată pe zi timp de 3 zile și antibiotice (Baytril, 2,5 mg/kg) de două ori pe zi timp de 5 zile după operație. Greutatea corporală și greutatea rămasă a chow-ului au fost înregistrate în fiecare dimineață pentru toate animalele, iar expresia vezicii urinare și curățarea sferturilor posterioare au fost efectuate cel puțin de două ori pe zi la animalele cu tranziție SCI până la revenirea golirii spontane. Ventrumul animalelor simulate a fost inspectat zilnic fără a fi necesară comprimarea manuală a vezicii urinare. Odată ce golirea spontană a revenit la șobolani cu SCI, toate animalele au fost inspectate o singură dată pe zi după cântărire. Când a fost necesar, animalelor li s-au administrat analgezice suplimentare pentru a minimiza durerea și disconfortul și antibioticele timp de 5 zile după indicarea unei infecții a vezicii urinare. Doi șobolani care au primit o tranziție a măduvei spinării au fost eliminați din studiu după apariția dermatitei cronice.
Testarea toleranței la glucoză și recoltarea sângelui.
Un test de toleranță la glucoză intraperitoneală (IPGTT) a fost administrat animalelor cu post de 24 de ore. Fiecare animal (n = 16) a primit o doză de 2 g/kg de masă corporală de soluție de glucoză 5% intraperitoneală. Probele de sânge (0,3 ml) au fost colectate de pe coada animalelor ușor reținute și analizate cu un glucometru disponibil comercial (Therasense Freestyle, Abbott Laboratories). Probele au fost prelevate cu 10 minute înainte de injecția de glucoză (valoarea inițială a postului, FB) și la intervale de 15 minute timp de 75 minute după injectare. Aria sub curba de testare a toleranței la glucoză a fost calculată pentru IPGTT folosind metoda trapezului.
Testul insulinei.
În timpul recoltării sângelui la FB, la 15, 45 și 75 de minute după glucoză, a fost prelevată o probă suplimentară de 100 μl și depozitată pe gheață în tuburi de microcentrifugă de 600 μl. Probele coagulate au fost centrifugate la 4 ° C (5 min la 2.100 g), serul de sânge a fost colectat în tuburi de microcentrifugă proaspete, depozitat (-20 ° C) și ulterior analizat pentru concentrația de insulină serică la fiecare punct de timp folosind ELISA (kit ELISA cu insulină pentru șobolani/șoareci cu ultrasunete, Crystal Chem, Downers Grove, IL).
Analiza compoziției corpului in vivo.
Șobolani treji, dezlănțuiți, au fost plasați în tubul de reținere al unui analizor RMN de tip Bruker minispec LF90 în timp (Bruker Optics, Billerica, MA). Tubul de reținere a fost ajustat pentru a minimiza mișcarea animalului fără a afecta respirația. Tubul a fost plasat, cu animalul pe o axă orizontală, în LF90, iar masa de grăsime, masa fără grăsime și fluidul au fost analizate în triplicat. Întreaga lungime a analizei triplicate a durat 4 minute, după care șobolanul a fost scos din tubul de reținere și a revenit în cușca de acasă.
Evaluare locomotorie Basso, Beattie, Bresnahan.
Performanța locomotorie a fost evaluată prin locomoție în câmp deschis folosind scara standard de evaluare a locomotorului Basso, Beattie, Bresnahan (BBB) (5). Testele au fost administrate la 72 de ore după operație și la intervale de o dată pe săptămână pe durata experimentului.
Analiza post-mortem a țesutului și PCR în timp real.
Animalele au fost eutanasiate rapid prin decapitare. Țesutul adipos maro intercapular (IBAT) și tampoanele bilaterale de grăsime retroperitoneală și genitală au fost îndepărtate și cântărite. IBAT a fost plasat imediat într-un tub de centrifugă din polietilenă, înghețat pe gheață uscată, depozitat (-80 ° C) și ulterior analizat pentru ARNm UCP1 folosind PCR în timp real.
Analiza statistică a fost efectuată folosind SPSS pentru Windows (SPSS Inc, Chicago, IL). Datele pentru schimbarea greutății corporale între grupuri și în timp au fost analizate prin ANOVA cu două căi. Datele pentru BBB au fost analizate prin măsuri repetate unidirecționale ANOVA, urmate de testul post-hoc Tukey. Aportul caloric, glicemia bazală a jeunului, insulina, curbele de toleranță la glucoză, compoziția corpului RMN, tamponul de grăsime, țesutul adipos maro și expresia UCP1 au fost analizate prin t-Test. Semnificația a fost stabilită la P 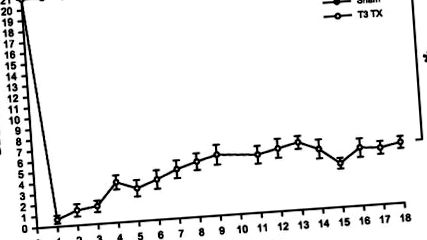
FIG. 1.Scorul mediu de evaluare a locomotorului BBB ± SE la șobolanii testați înainte de operație (notat ca săptămâna 0) până la 18 săptămâni după operație. Scorurile locomotorii au fost semnificativ mai mici în grupul de leziuni ale măduvei spinării (SCI) (*P
SCI schimbă capacitatea de a menține greutatea corporală.
Greutățile corporale zilnice de la toate animalele experimentale sunt reprezentate grafic în intervale săptămânale, ca schimbare a greutății de la greutatea preoperatorie (Fig. 2). Șobolanii de control chirurgical care primesc doar o laminectomie (n = 6) a afișat o scădere semnificativă [F(18.240) = 7.546, P 0,05] și rămânând constant după aceea (NS, P > 0,05). După operație, greutatea corporală a animalelor T3 TX a rămas semnificativ mai mică decât animalele simulate pe durata experimentului [F(1,12) = 21,026, P 0,05).
FIG. 2.Modificarea greutății corporale după SCI exprimată ca diferență de greutatea prematură. Animalele de control (Sham) nu au slăbit după intervenția chirurgicală, în timp ce șobolanii transecați cu măduva spinării (T3 TX) au prezentat o reducere semnificativă a greutății imediat după operație și nu au revenit la greutatea preoperatorie până la 5 săptămâni după operațieP
Aportul caloric este crescut la animalele SCI cronice.
Pe parcursul săptămânile 16-18, când greutățile corporale s-au stabilizat, a fost măsurată aportul caloric zilnic al chow-ului de laborator standard (Fig. 2, regiunea cu umbră gri). La sfârșitul perioadei de monitorizare de 2 săptămâni, aportul caloric cumulativ (Fig. 3A) a fost semnificativ mai mare în grupul T3 TX (t = 2.254, df = 12, P 0,05). Aportul mediu de energie (MEI) reprezintă media zilnică de kilocalorii consumate la 100 g de greutate corporală pentru fiecare săptămână de hrănire monitorizată. MEI pentru animalele martor a fost de 20,69 ± 1,0 kcal · zi -1 -1 100 g -1 comparativ cu animalele T3 TX, care a fost 30,94 ± 0,91 kcal · zi -1 -1 100 g -1 pentru saptamana 1. Pentru săptămâna 2, MEI a fost de 20,26 ± 0,90 și 29,65 ± 1,60 pentru martori și respectiv pentru animalele T3 TX. După cum se vede în Fig. 3B, MEI pentru animalele T3 TX a fost semnificativ mai mare pentru ambele saptamana 1 (t = 5,64, df = 12, P
FIG. 3.Efectul leziunilor cronice asupra aportului caloric al chow-ului de laborator standard (Purina # 5001). A: animalele cu T3 TX au consumat un număr mai mare de calorii pe noapte. Această diferență în aportul caloric a fost semnificativ diferită de animalele martor de către ziua 14 (*P
Toleranța la glucoză și sensibilitatea la insulină în SCI cronice.
Nivelurile bazale de glucoză din sânge au măsurat 4 ore în ciclul luminos la 1 săptămână preoperator și postoperator săptămâni 1 și 16 nu a arătat nicio diferență semnificativă a glicemiei între grupuri pentru un moment dat (Tabelul 1, P > 0,05). Nivelurile pre-chirurgicale ale glicemiei în timpul IPGTT nu au fost semnificativ diferite între animalele atribuite oricărui grup chirurgical (datele nu sunt prezentate). La 1 săptămână după operație, nu a existat nicio diferență între grupurile de glucoză din sânge (Fig. 4A) sau în zona de sub curba (ASC) a IPGTT (Fig. 4C, P > 0,05). În timpul testului IPGTT administrat la 16 săptămâni după operație, șobolanii T3 TX au prezentat un nivel mai scăzut al glicemiei până la punctul de timp de 30 de minute, care a rămas mai mic pe tot restul perioadei de testare (Fig. 4B). Ulterior, ASC a fost semnificativ mai mică la șobolanii T3 TX (t = 2,55, df = 12, P 0,05). Răspunsul la insulină la IPGTT a fost mai mic în toate momentele la șobolanii T3 TX (Fig. 5A), iar ASC pentru insulină pentru întreaga perioadă de prelevare a fost semnificativ mai mică (t = 3,13, df = 12, P
FIG. 4.Efectul leziunii cronice asupra nivelului glucozei serice IPGTT la momentul inițial (B) imediat înainte de injectarea glucozei (2 mg/kg ip) și la intervale de 15 minute după injectare. A: la 1 săptămână post-SCI, animalele cu T3 TX nu au prezentat nicio diferență în toleranța la glucoză în comparație cu animalele de control (P
FIG. 5.Efectul leziunii cronice asupra nivelului de insulină serică IPGTT la animale la 16 săptămâni post-SCI. A: animalele cu T3 TX au avut valori mai mici ale insulinei serice comparativ cu animalele martor. B: insulina serică a fost semnificativ mai mică (*P
tabelul 1. Glucoza bazală postită la șobolanii martori și transecți la nivelul coloanei vertebrale
Valorile sunt exprimate ca medii ± SE. Valorile bazale ale glucozei postite sunt date în miligrame pe decilitru.
Compoziția corpului și expresia ARN UCP1 după SCI.
Măsurarea in vivo a masei de țesut slab a fost semnificativ mai mică la șobolanii T3 TX, măsurată prin RMN la încheierea monitorizării consumului de alimente (t = 5,54, df = 12, P 0,05). Raportul corespunzător dintre masa grasă și țesutul slab a fost chiar mai redus la animalele T3 TX comparativ cu martorii (t = 4,40, df = 12, P 0,05). În cele din urmă, nivelul de expresie al ARNm UCP1 în IBAT de la șobolani din grupul T3 TX (0,55 ± 0,06, înseamnă ± SE, AU) a fost semnificativ mai mic decât cel al controalelor chirurgicale (1,09 ± 0,08, înseamnă ± SE, AU; t = 5,91, df = 12, P
FIG. 6.Efectul leziunii cronice asupra compoziției corpului, determinat de RMN in vivo, și greutatea post mortem a țesutului țesutului adipos maro intrascapular (IBAT), tamponului gras adipos alb gonadal (gWAT) sau tamponului adipos alb adipos retroperitoneal (rWAT). A: masa țesutului slab (LM), determinată de RMN in vivo, este semnificativ redusă la animalele T3 TX comparativ cu shams. B: raportul dintre masa grasă și masa slabă (FM/LM), determinat de RMN in vivo, este semnificativ mai mic la animale la 16 săptămâni post-SCI. C: atât gWAT post mortem cât și rWAT au fost semnificativ mai mici la animalele cu T3 TX decât martorii, diferența dintre greutățile IBAT nu a atins semnificația statistică (*P
În prezentul studiu, demonstrăm că 1) greutatea corporală scăzută cronică, așa cum se observă într-un subgrup al populației SCI umane, apare într-un model de rozătoare al SCI cronice; 2) în ciuda creșterii aportului caloric cumulativ în LS cronice, greutatea corporală scăzută persistă la animalele rănite; 3) masa adiposă albă este mai mică în SCI; 4) nivelurile bazale de glucoză sunt neschimbate, dar toleranța la glucoză este semnificativ îmbunătățită la animalele cronice T3 SCI; 5) nivelurile de insulină bazală sunt mai mici la animalele cronice T3 SCI; și 6) termogeneza, măsurată prin UCP1 ARN, a fost mai mică la animalele SCI. Aceste date furnizează primele dovezi directe că SCI toracic ridicat a declanșat o pierdere prelungită a greutății corporale post-vătămare, inclusiv a masei grase, care nu se datorează hipofagiei sau creșterii termogenezei mediate prin simpatie, dar există în ciuda hiperfagiei semnificative a animalelor rănite.
Datele noastre săptămânale privind greutatea corporală demonstrează că diferența de greutate dintre șobolanii SCI și non-SCI a continuat să crească pe tot parcursul experimentului. Acest lucru a reflectat rata de creștere a animalelor de control non-SCI, deoarece greutățile corporale ale SCI nu au fost semnificativ diferite de nivelurile pre-prejudiciu începând cu 5 săptămâni postoperator. Observațiile noastre sugerează că șobolanii SCI apără o greutate corporală stabilită. Mai exact, am observat că șobolanii SCI care au fost postiti peste noapte pentru testarea bazică a glucozei s-au întors la greutatea corporală prefasturată la aceeași rată ca și controalele simulate la post. Astfel, în timp ce șobolanii SCI au menținut o greutate corporală mai mică, aceștia au fost capabili să compenseze rapid aportul redus de energie impus de post. Acest efect este în concordanță cu rapoartele anterioare conform cărora pierderile de greutate induse de post la animalele intacte din punct de vedere neuronal sunt inversate rapid după restabilirea hranei (26).
Dovezile din datele noastre care trasează aportul caloric cumulat de T3 TX și animalele de control pe o perioadă de 2 săptămâni indică faptul că animalele rănite pe termen lung consumau un număr mai mare de calorii decât martorii. Atrofia musculară post-vătămată demonstrată anterior (20, 24, 34, 44) și confirmată în propriile noastre date RMN, care este asociată cu o reducere a cheltuielilor de energie (31), ar prezice o reducere proporțională a hrănirii ad libitum; cu toate acestea, în timpul monitorizării hranei noastre, am observat contrariul. Acest consum caloric crescut a fost mai clar evident în aportul mediu de energie, deoarece animalele rănite pe termen lung consumau mai multe calorii în ciuda unei greutăți corporale mai mici. În studii separate efectuate pe animale de la laboratorul nostru de monitorizare a șobolanilor cu SCI acut, aportul caloric din hrănirea ad libitum la șobolanii transsecați T3 revine la niveluri comparabile cu șirurile chirurgicale în decurs de 1 săptămână după operație. La fel ca și în cazul datelor noastre actuale, greutatea corporală la aceste animale SCI acute a rămas sub nivelurile de pre-vătămare până la sfârșitul perioadei de observație de 3 săptămâni și a fost cu 20% sub cohorta de controale chirurgicale (G. M. Holmes, observații nepublicate).
Măsurile noastre de toleranță la glucoză și sensibilitatea la insulină sugerează o homeostazie cu carbohidrați extrem de eficientă, care ar fi de așteptat de la subiecții slabi (18, 23). Analiza noastră atât a compoziției corpului in vivo la 16 săptămâni după intervenție chirurgicală, cât și a greutăților post mortem ale tampoanelor de grăsime gonadală și retroperitoneală a indicat faptul că masa grasă a șobolanilor cronici SCI a fost semnificativ redusă. Când carbohidrații disponibili nu satisfac cererea de energie, trigliceridele stocate în țesutul adipos alb sunt transformate în acizi grași liberi, iar masa grasă poate fi epuizată rapid în timpul unei perioade de post impuse (4). În mod surprinzător, reducerea observată a masei grase a șobolanilor SCI a avut loc în ciuda unui aport caloric cumulativ mai mare. La animalele intacte din punct de vedere neuronal, mobilizarea lipidelor în țesutul adipos alb este mediată de inervația simpatică a grăsimii albe (3), în timp ce denervarea grăsimii albe diminuează mobilizarea grăsimilor (21, 46). Postul crește atât rotația noradrenergică (37), cât și inervația noradrenergică a țesutului adipos alb (22). Deoarece deversarea simpatică către grăsimea albă ar fi probabil diminuată după SCI, ar fi de așteptat ca țesutul adipos alb să crească în dimensiune după rănire, dar acest lucru nu a fost cazul.
Această lucrare a fost susținută de NINDS 49177 (GMH), S. Primeaux și Laboratorul de obezitate dietetică sunt susținute de NIDDK 32089 (acordat GA Bray) și Fundația Medicală Pennington.
NOTĂ DE PICIOASĂ
Costurile de publicare a acestui articol au fost suportate parțial prin plata taxelor de pagină. Prin urmare, articolul trebuie marcat prin prezenta „publicitate”În conformitate cu 18 U.S.C. Secțiunea 1734 doar pentru a indica acest fapt.
Autorii doresc să-i mulțumească lui G. A. Bray în Laboratorul de obezitate dietetică pentru comentarii la pregătirea acestui raport și pentru accesul la resursele RT-PCR din laboratorul său, C. Morrison pentru sugestii și sfaturi valoroase. Mulțumim Dr. Barry Robert, Cynthia Kloster și Hsin (Frank) Hsu pentru asistența lor tehnică.
- Efectele pierderii de greutate identice asupra compoziției corpului și caracteristicile rezistenței la insulină la obezi
- Efectele presopuncturii auriculare asupra parametrilor greutății corporale la pacienții cu schizofrenie cronică
- Efectele suplimentelor CLA asupra greutății corporale și oxidării grăsimilor - Vizualizare text complet
- Efectele vaporilor de țigări electronice asupra masei corporale, aportului alimentar și compoziției corporale - Breit -
- Descoperiți cum să tăiați grăsimea corporală fără a pierde în greutate de Michael Gulyas Medium
