Abstract
Orice comportament complex necesită o coordonare specifică între diferite rețele neuronale care controlează diferitele sale aspecte pentru a obține o ieșire comportamentală semnificativă. O astfel de coordonare asigură producția ordonată a unui comportament complex și reprezintă un principiu universal al funcționării SNC atât la animale vertebrate, cât și la animale nevertebrate. Studiul actual se concentrează asupra comportamentului hrănitor al moluștei pteropode carnivore Clione limacina și mecanismele neuronale de coordonare între principalele elemente ale acestui comportament complex.
Descriem în acest studiu și discutăm rolul unei interneuron cerebrale simetric bilateral, desemnată celulă Cr-BM, care produce o influență excitativă proeminentă asupra tuturor rețelelor neuronale care controlează trei structuri majore de hrănire în Clione: conuri bucale, cârlige chitinoase și radulă. O descriere generală preliminară a unora dintre aceste efecte a fost publicată anterior (Norekian 1995). Influența excitativă puternică generală produsă de neuronul Cr-BM asupra tuturor rețelelor neuronale de hrănire identificate este probabil importantă în perioada de „extracție a prăzii” a comportamentului de hrănire după capturarea prăzii. În plus față de activarea generală, neuronul Cr-BM are o puternică influență de coordonare asupra elementelor individuale ale fiecărei rețele neuronale, ceea ce contribuie la coordonarea dependentă de fază a activității lor ritmice. Interneuronul Cr-BM utilizează aparent GABA ca emițător de excitare pe baza experimentelor cu dublă etichetare, imitând efectul GABA exogen și blocând efectele antagoniștilor GABA. Acesta reprezintă un alt exemplu interesant al rolului excitator al GABA în comportamentul alimentar al Clione (Arshavsky și colab. 1993; Norekian 1999).
Exemplare adulte de C. limacina au fost colectate la Friday Harbor Laboratories, Universitatea din Washington (Friday Harbor, WA) în sezonul de primăvară - vară și la Laboratorul maritim al Mării Albe al Institutului Zoologic (Marea Albă, Rusia) în sezonul de vară - toamnă. Animalele au fost ținute în borcane de 1 galon la frigider la 5-7 ° C. Înainte de disecție, animalele au fost anesteziate într-un amestec 1: 1 de apă de mare și MgCl2 izotonică și apoi fixate strâns pe o placă Petri acoperită cu elastomer de silicon (Sylgard). Au fost efectuate experimente electrofiziologice pe preparate reduse constând din SNC, cap și aripi. Toți nervii centrali care inervau capul erau intacti. Înainte de înregistrarea electrofiziologică, teaca ganglionilor centrali a fost înmuiată prin scăldarea preparatului într-o soluție de 1 mg/ml de protează (Sigma, tip XIV) timp de 5 minute, urmată de o spălare de 30 de minute în apă de mare filtrată.
Înregistrările intracelulare de la neuroni individuali au fost realizate cu microelectrozi de sticlă (rezistențe: 10-30 MΩ) umplute cu 2 M acetat de potasiu. Semnalele electrofiziologice au fost amplificate, afișate și înregistrate folosind tehnici electrofiziologice convenționale. Stimularea intracelulară a fost realizată printr-un circuit de punte amplificator. Pentru a testa conexiunile monosinaptice, a fost utilizată o soluție de cationi cu înaltă divalență [conținând (în mM) 110 MgCl2, 25 CaCl2, 400 NaCl, 10 KCl și 3 NaHCO3, pH 7,4]. Pentru investigarea morfologică a neuronilor înregistrați, o soluție de 5% de 5 (6) -carboxifluoresceină (Sigma) preparată în acetat de potasiu 2 M a fost iontoforizată prin intermediul electrozilor de înregistrare (rezistențe, 20-40 MΩ) cu curent negativ de 1 până la 10-nA impulsuri timp de 5-30 min. Celulele injectate au fost observate în direct în vasul de înregistrare cu un microscop de epifluorescență Nikon și cu un microscop confocal cu scanare laser MRC 600 BioRad (Hercules, CA).
GABA a fost aplicat local pe soma neuronilor identificați prin ejecție de presiune sau aplicare ionoforetică. Pentru ejectarea sub presiune, micropipetele de sticlă au fost umplute cu soluție de 5 mM GABA în apă de mare filtrată și conectate la sistemul de presiune a aerului (PV830 Pneumatic PicoPump, WPI), care a furnizat impulsuri de presiune de 40-60 p.s.i. și 200-ms durată. S-a adăugat colorant Fast Green (0,02%) în soluția de monitorizare a eliberării medicamentului. Pentru aplicații iontoporetice, am folosit micropipete de sticlă cu diametrul vârfului 1-2 μm umplute cu soluție 1 M GABA (pH 4). Curenții ionoforetici au avut amplitudine între 50 și 100 nA și au fost aplicați sub formă de impulsuri scurte cu durata de 50 - 100 ms (Stimulator S4KR și Unitatea de izolare Stimulus SIU 4678, Instrumentele de iarbă). Antagoniștii GABA au fost aplicați cu utilizarea unei pipete gradate de 1 ml. Concentrația finală a fost estimată din volumul cunoscut de soluție injectată și volumul cunoscut de soluție salină în vasul de înregistrare.
Pentru experimentele cu dublă etichetare, interneuronii au fost injectați cu neurobiotină (Vector Laboratories). Preparatele au fost apoi fixate în paraformaldehidă 4% și glutaraldehidă 0,1% în PBS și incubate 12 ore în avidină marcată cu roșu Texas (Vector Laboratories) pentru a vizualiza interneuronii plini de neurobiotină. Preparatele au fost apoi prelucrate pentru reacția imunocitochimică descrisă în textul precedent. Prin schimbarea filtrelor în microscopul de fluorescență sau microscopul confocal cu scanare laser pentru roșu Texas și fluoresceină, interneuronii au fost identificați ca imunoreactivi GABA. Texas Red nu a fost vizibil cu filtrele de fluoresceină, iar fluoresceina nu a fost vizibilă cu filtrele Texas Red, oferind astfel o comparație clară în timpul comutării filtrului.
Morfologia interneuronului Cr-BM și efectul general asupra rețelelor neuronale
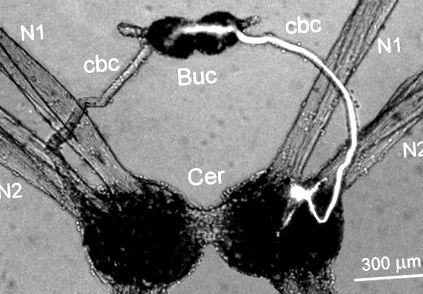
Interneuronul Cr-BM simetric bilateral a fost localizat pe suprafața ventrală a ganglionilor cerebrali din regiunea anterioară dintre nervii capului N1 și N2 care inervează capul animalului (Fig. 1). Dimensiunea corpului celulei a fost de 25-30 μm în diametru. Un singur axon mare al neuronului Cr-BM a ieșit din ganglionii cerebrali în conjunctivul ipsilateral cerebro-bucal și a inervat neuropilul ambilor ganglioni bucali (Fig. 1). Câteva procese mici s-au ramificat și în neuropilul ganglionului cerebral ipsilateral. Structura morfologică a 16 interneuroni Cr-BM a fost studiată în 12 preparate după injecție intracelulară cu colorant fluorescent carboxifluoresceină.
FIG. 1.Structura morfologică a interneuronului Cr-BM drept injectat cu carboxifluoresceină. Corpul celulei este situat în ganglionii cerebrali (Cer) în apropierea bazei nervilor capului N1 și N2 și proiectează un axon mare către ganglionii bucali (Buc) prin intermediul conectivului cerebro-bucal (cbc). Microfotografia a fost obținută folosind microscopul cu epifluorescență.
FIG. 2.A: stimularea interneuronului Cr-BM a produs activitate ritmică durabilă în rețeaua de control a radulei, urmărită prin înregistrarea interneuronului Bc-PIN activ în faza de protejare a radulei. B: explozia indusă de vârfuri în neuronul Cr-BM a declanșat activitate ritmică în rețeaua de control a cârligului, urmărită prin înregistrarea protractorului cârlig Bc-HP motoneuron. C: interneuronul Cr-BM a activat și neuronii Cr-A care controlează deschiderea pliurilor cutanate și protejarea conului bucal. Frecvența de tragere indusă de neuronul Cr-BM în aceste experimente a variat între 20 și 40 Hz.
Conexiuni sinaptice specifice produse de interneuronii Cr-BM
Interneuronul Cr-BM a indus activitate ritmică în rețeaua neuronală bucală care controlează mișcările radulei. Motoneuronii radrului protractor au primit potențiale proeminente postsinaptice de excitare (PSP) de la neuronii Cr-BM. Fiecare vârf de neuron Cr-BM indus a produs un singur PSP de excitare a neuronului Bc-RP (EPSP), care a persistat în soluția cu înaltă divalență, sugerând o conexiune monosinaptică (n = 14; FIG. 3A). Interneuronul Bc-PIN, care este activ în faza de protejare a radulei, a primit, de asemenea, intrări de excitare proeminente de la interneuronul Cr-BM. Fiecare vârf Cr-BM a generat un EPSP de amplitudine mare în celula Bc-PIN, care a persistat în soluție cu înaltă divalență (n = 26; FIG. 3A). Motoneuronii retractori de radulă Bc-RR au primit intrări inhibitorii de la interneuronii Cr-BM. Fiecare vârf indus de neuron Cr-BM a declanșat un singur neuron Bc-RR IPSP, care a persistat în soluție cu înaltă divalență, sugerând conexiune monosinaptică (n = 12; FIG. 3B). Astfel, având efectul excitator general asupra radulei care controlează sistemul neuronal, neuronii Cr-BM au produs, de asemenea, intrări de coordonare pentru elementele specifice ale acestui sistem, asigurându-se că neuronul protractor și radula retractorul radulei sunt activi în fazele opuse ciclului lor ritmic.
FIG. 3.A: fiecare vârf indus în interneuronul Cr-BM a produs EPSP individual în motoneuronul protractorului radulei (Bc-RP) și interneuronului Bc-PIN, care este activ în faza de protejare a radulei. B: fiecare vârf unic în interneuronul Cr-BM a indus, de asemenea, un singur potențial inhibitor postsinaptic (IPSP) în motoneuronul retractorului radulei (Bc-RR). Experimentele au fost efectuate într-o soluție cu nivel înalt de divalență.
FIG. 4.Explozia indusă de vârfuri în interneuronul Cr-BM a produs activarea generală a motoneuronului retractorului cu cârlig (Bc-HR) cu întârziere notabilă (A). Această întârziere a fost atribuită IPSP-urilor cu amplitudine mică rapidă primite de neuronul Bc-HR de la interneuronul Cr-BM (B). În plus față de aceste IPSP rapide, răspunsul neuronului Bc-HR la activarea neuronului Cr-BM a inclus o depolarizare lentă de lungă durată, care a fost responsabilă pentru activarea generală a motoneuronului Bc-HR. C: motoneuronul transportorului cu cârlig (Bc-HP) a fost inhibat de interneuronul Cr-BM, răspunzând cu IPSP rapide la 1 vârf: 1 raport IPSP.
FIG. 5.A: intrările excitatorii de la interneuronul Cr-BM la neuronii Cr-A au dispărut după ce a fost tăiată conexiunea cerebro-bucală. B: fiecare vârf indus în interneuronul Bc-PIN produs în neuronul Cr-A1 EPSP individual care a persistat în soluție cu înaltă divalență. C: EPSP din neuronul Cr-Ai (*) a apărut numai atunci când EPSP monosinaptic indus de neuronul Cr-BM din neuronul Bc-PIN a atins pragul și a generat potențialul de acțiune.
Caracteristica vizibilă a tuturor PSP-urilor induse de neuronii Cr-BM în neuronii bucali a fost facilitarea lor proeminentă cu tragere repetată a neuronilor Cr-BM (Fig. 6, A și B). Facilitarea a fost dependentă de frecvență, cu cele mai mari valori înregistrate în timpul frecvenței creșterii neuronului Cr-BM de 20 Hz și aproape dispărând la frecvența de 1 Hz (Fig. 6, A - C). Figura 6A oferă evaluarea cantitativă a acestei facilitări prin compararea raportului dintre amplitudinea celui de-al doilea și primul EPSP din neuronul Bc-PIN la diferite frecvențe de declanșare ale exploziei induse de neuronul Cr-BM. Un alt exemplu este o comparație între primul și maximul PSP din tren. O astfel de creștere a amplitudinii EPSP calculată pentru neuronul Bc-PIN în timpul declanșării induse de neuronul Cr-BM la o frecvență de 3 până la 8 Hz a fost de 502 ± 59% (n = 20).
FIG. 6.Facilitarea EPSP-urilor induse de neuronul Cr-BM în neuronul Bc-PIN a fost dependentă de frecvență. A: scara verticală arată raportul dintre amplitudinea celui de-al doilea și primul EPSP, în timp ce scala orizontală arată durata dintre primul și al doilea vârf în neuronul Cr-BM. Coeficientul de corelație a fost de 0,71. B: La frecvența de tragere a neuronilor Cr-BM de 6 Hz, EPSP-urile neuronului Bc-PIN au demonstrat o facilitare proeminentă. C: frecvențele de declanșare de ≤1 Hz nu au reușit să inducă nicio creștere semnificativă a amplitudinii EPSP.
Interneuronii Cr-BM sunt GABAergici
FIG. 7.A: Imunoreactivitatea GABA în ganglionii cerebrali. Vârfurile de săgeată identifică neuronul GABAergic Cr-Ai descris anterior (Norekian 1999). Săgețile indică 2 corpuri celulare imunoreactive simetrice lângă baza nervilor capului N1 și N2, care păreau a fi corpurile celulare ale neuronilor Cr-BM. Următoarele experimente cu dublă etichetare au confirmat că. B: imagine a ganglionului cerebral drept obținută prin filtrele Texas Red. O singură interneuronă Cr-BM a fost umplută cu neurobiotină și vizualizată de Texas Red. C: imagine a aceluiași ganglion cerebral obținut prin filtrele de fluorescenă. Această imagine prezintă imunoreactivitatea GABA (antiserurile GABA au fost etichetate cu fluoresceină). Rețineți că pe ambele imagini neuronul Cr-BM proiectează un axon mare în conjunctivul cerebro-bucal (cbc) și au mai multe procese mici care inervează neuropilul cerebral. Toate imaginile reprezintă o reconstrucție a microscopului confocal compus din mai multe secțiuni optice.
GABA exogen a mimat efectele produse de interneuronul Cr-BM asupra tuturor celulelor bucale postsinaptice. Aplicarea locală a GABA prin ejecție de presiune sau iontoforeză a produs depolarizarea neuronilor Bc-RP cu protractor de radulă (n = 4; FIG. 8A) și hiperpolarizarea neuronilor retractor Bc-RR (n = 6; FIG. 8B). Interneuronul Bc-PIN a răspuns, de asemenea, cu o depolarizare proeminentă la aplicația GABA (n = 9; FIG. 8C). GABA aplicat local a produs, de asemenea, depolarizarea neuronului retractor cu cârlig Bc-HR neuroni (n = 5; FIG. 8D) și hiperpolarizarea neuronului Bc-HP al transportorului cu cârlig (n = 10; FIG. 8E). Nu a existat nicio indicație de hiperpolarizare în neuronul Bc-HR, chiar dacă neuronul Cr-BM a produs în această celulă o combinație rapidă IPSP/EPSP lentă, care poate fi explicată prin efectul de mascare al unei depolarizări mai puternice sau prin prezența unui singur tip de receptor. pe suprafața somatelor.
FIG. 8.Efectul GABA exogen asupra protonei radulei Bc-RP motoneuron (A), retractor radula Bc-RR motoneuron (B), Interneuron Bc-PIN (C), retractor cu cârlig Bc-HR motoneuron (D), și transportor cu cârlig Bc-HP motoneuron (E). GABA a fost aplicat local prin ejecția de presiune indicată de o linie groasă în A sau puls de curent intoforetic în FI. Rețineți că neuronii activi în fazele opuse ale ritmului de hrănire bucală au tip opus de răspuns GABA - depolarizare vs. hiperpolarizare. Hiperpolarizarea indusă de GABA în neuronul Bc-HP a fost blocată reversibil de 2 mM bicuculină (E).
FIG. 9.Antagonistul GABA, bicucullină, IPSP induse de neuronul Cr-BM blocat reversibil în protractorul cu cârlig al neuronului Bc-HP (A). Picrotoxina a blocat numai IPSP-urile rapide în retractorul cu cârlig al neuronului Bc-HR (B). Rețineți că răspunsul depolarizant indus de neuronul Cr-BM a rămas încă intact. EPSP-urile induse de neuronul Cr-BM în neuronul Bc-PIN au fost blocate doar parțial de bicuculină (C).
Efecte postsinaptice suplimentare ale interneuronilor Cr-BM
FIG. 10.A: desen schematic care arată structura morfologică a neuronului recent identificat Bc-L, care declanșează închiderea și strângerea pliurilor pielii. Corpul său celular este situat în ganglionii bucali. Un axon mare iese din ganglionii bucali prin nervul cârligului, traversează întregul sac cârlig stâng fără nici o ramificare și intră în țesutul pliurilor pielii ipsilaterale. B: explozia indusă de vârfuri în interneuronul Cr-BM a produs o inhibiție proeminentă a neuronului Bc-L activ spontan. C: fiecare creștere indusă de neuron Cr-BM a produs IPSP individual în neuronul Bc-L în soluție divalentă ridicată. D: interneuronul Cr-BM a produs, de asemenea, intrări de excitare în neuronul MCC cerebral serotoninergic.
Probabil cea mai cunoscută celulă implicată în controlul comportamentului de hrănire în moluștele gastropode este neuronul gigantic cerebral serotonergic MCC. Am constatat că interneuronul Cr-BM a produs intrări de excitare la neuronii MCC (n = 8; FIG. 10D). Aceste intrări au fost relativ slabe și de natură polisinaptică.
Coordonarea între trei structuri majore de hrănire și rețelele neuronale subiacente
Rolul excitator al GABA în comportamentul de hrănire
Interneuroni cerebro-bucali și moluște gastropode
Această lucrare a fost susținută de Grantul IBN-0235107 al Fundației Naționale a Științei, Organizația Tratatului Atlanticului de Nord Grantul de legătură colaborativă 979205 și un grant de la Fundația Rusă pentru Cercetare de Bază.
- Efectul hrănirii prelungite a morcovilor cruzi asupra conținutului de vitamina A din ficat și rinichi la câine - R
- Efectul conținutului de energie dietetică asupra comportamentului hrănitor al doratei (Sparus aurata) și
- Efectul sulfatului de zinc asupra hrănirii și creșterii Spodoptera littoralis Boisd
- Efectul hrănirii rațelor cu mușchi diferite surse de proteine Performanța, conținutul de acid gras acid-3
- Efectul diferitelor strategii de hrănire asupra cererii de dorată (Sparus aurata) - hrănire