Ji-Young Kim
1 Departamentul de Științe Biomedice, Universitatea din Ulsan, Colegiul de Medicină, Asan Institute for Life Sciences, Asan Medical Center, Seoul, Coreea
2 Institutul de Tehnologie Bio-Medicală, Universitatea din Ulsan, Colegiul de Medicină, Seul, Coreea
Min-Seo Kwon
1 Departamentul de Științe Biomedice, Universitatea din Ulsan, Colegiul de Medicină, Asan Institute for Life Sciences, Asan Medical Center, Seoul, Coreea
2 Institutul de Tehnologie Bio-Medicală, Universitatea din Ulsan, Colegiul de Medicină, Seul, Coreea
Fiul lui Junghyun
3 Departamentul de chimie biologică, Universitatea de Știință și Tehnologie din Coreea, Daejeon, Coreea
4 Centrul de control al dopajului, Institutul Coreean de Știință și Tehnologie, Seul, Coreea
Sang-Wook Kang
1 Departamentul de Științe Biomedice, Universitatea din Ulsan, Colegiul de Medicină, Asan Institute for Life Sciences, Asan Medical Center, Seoul, Coreea
Youngsup Song
1 Departamentul de Științe Biomedice, Universitatea din Ulsan, Colegiul de Medicină, Asan Institute for Life Sciences, Asan Medical Center, Seoul, Coreea
Conceptualizare: YS JK.
Analiza formală: JK YS.
Achiziție de finanțare: YS.
Investigație: JK MK HS.
Metodologie: YS JK SK.
Administrarea proiectului: YS SK.
Resurse: JK MK.
Supraveghere: YS.
Validare: JK MK.
Vizualizare: JK YS.
Scriere - schiță originală: YS JK.
Scriere - recenzie și editare: YS.
Date asociate
Toate datele noastre sunt conținute în hârtie și fișiere de informații de susținere
Abstract
Introducere
Peste 30% din populația SUA suferă de obezitate. Este un factor de risc grav care poate induce sau exacerba multe tulburări metabolice, inclusiv boli cardiovasculare, dislipidemie și diabet. De asemenea, a fost asociat cu probleme de sănătate mintală; există o prevalență crescută a depresiei în rândul pacienților obezi [1], care la rândul său afectează negativ multe aspecte ale vieții și poate duce la afectarea comportamentului social, tulburări alimentare și scăderea stimei de sine [2]. Prin urmare, reducerea țesutului adipos este importantă pentru rezolvarea problemelor medicale, precum și pentru scopuri estetice.
În acest studiu, am utilizat atât metode in vitro, cât și un model de șobolan in vivo pentru a compara activitățile de reducere a grăsimilor din PPC și DC și le-am testat specificitatea adipocitelor.
Materiale și metode
Reactivi
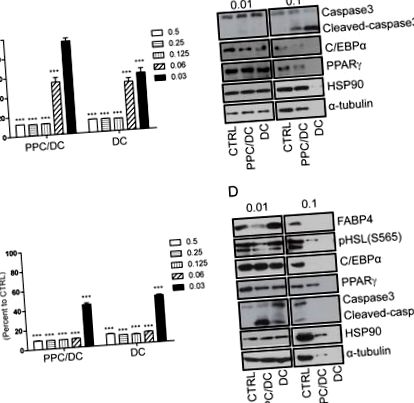
PPC (97,8% polien fosfatidilcolină pură) și sodiu DC (99,1% pur) au fost achiziționate de la Lipoid (Lipoid Kosmetik AG, Elveția) și respectiv NZP (New Zealand Pharmaceuticals, Ltd., Noua Zeelandă). Formula PPC/DC prezentată în Fig 1 conține 5% PPC și 2,4% DC sodiu în apă, iar soluția DC prezentată în Figura conține 2,4% DC sodiu. Pentru tratamentul PPC și DC în preadipocite 3T3L1, adipocite și șobolani, soluții stoc 5% PPC și DC au fost preparate în etanol și, respectiv, în apă.
A. Viabilitatea celulelor 3T3L1 și B. adipocite a fost măsurată la opt ore după tratament cu diferite doze de formulă PPC/DC sau DC numai utilizând testul MTT. Probele de proteine din preadipocite C. 3T3L1 și D. adipocite după 0,01% sau 0,1% formulă PPC/DC sau tratament DC timp de opt ore, respectiv, au fost preparate și analizate prin Western blot.
Animale și design experimental
Analiza RMN
Aproximativ 10 imagini au fost luate pentru a acoperi întreaga zonă a tamponului de grăsime inghinală pentru fiecare animal, înainte de injectare și la 7, 14 și 28 de zile după injectare. După colectarea tuturor imaginilor, a fost efectuată o analiză oarbă pentru măsurarea suprafeței de grăsime inghinală folosind imaginea J cu pragul de intensitate a grăsimii (intensitatea albului) stabilit la 10.000.
Cultura 3T3L1 și diferențierea adipocitelor
Linia celulară 3T3L1 a fost cultivată în mediul esențial minim Dulbecco suplimentat cu 10% ser fetal bovin (HyClone, Logan, UT, SUA) și 1% penicilină-streptomicină. Pentru diferențierea adipocitelor, celulele 3 × 10 5 3T3L1 au fost placate în plăci cu 12 godeuri. La două zile după placare, adipogeneza a fost indusă prin trecerea la un mediu de cultură 3T3L1 suplimentat cu 4 mg/ml dexametazonă, 0,5 μM IBX, 0,5 unitate/ml Humulin (Lilly, SUA) și 100 nM rosiglitazonă (Roche, Elveția). La două zile după expunerea celulelor la mediul de inducție adipogen, acesta a fost înlocuit cu mediu de cultură 3T3L1 proaspăt conținând doar 0,5 unități/ml Humulin și 100 nM rosiglitazonă. Mediul proaspăt a fost adăugat la fiecare două zile pentru alte 5 sau 6 zile. Adipogeneza a fost determinată prin evaluarea microscopică cu lumină a formării vacuolului lipidic și a colorării cu roșu uleios.
Analiza viabilității celulare
Soluțiile stoc PPC sau DC (5%) au fost diluate pentru a obține 1000 × pentru fiecare concentrație și au fost aplicate pe mediul de cultură celulară, astfel încât concentrația finală a solventului (etanol pentru PPC și apă pentru DC) expus celulelor a fost 0,1 %. Viabilitatea celulară a fost evaluată utilizând testul MTT. Pe scurt, cu o zi înainte de experiment, 10 × 104 celule au fost placate în plăci de cultură tisulară cu 24 de godeuri. În ziua experimentului, s-a adăugat PPC, DC sau controlul (etanol ca control PPC și apă ca control DC), așa cum se indică în legendele din figură; cu o oră înainte de încheierea experimentului, s-au aplicat 5 mg/ml MTT (Duchefa Biochemie, Olanda). Celulele au fost spălate cu PBS și s-a aplicat 150 pl DMSO timp de 15 minute pentru a extrage colorantul. Viabilitatea celulei a fost estimată prin măsurarea absorbanței la 565 nm folosind un cititor de plăci (BioTek, SUA).
Western blot și anticorpi
Cu o zi înainte de ziua experimentală, celulele preadipocite 3 × 10 5 3T3L1 au fost placate în plăci cu 12 godeuri și formula PPC/DC, PPC sau DC a fost aplicată așa cum se indică în figuri. Preadipocitul 3T3L1 a fost diferențiat în adipocite în conformitate cu protocolul de diferențiere a adipocitelor prezentat mai sus. După confirmarea diferențierii adipocitelor prin vizualizarea formării de vacuole lipidice utilizând colorarea cu ulei roșu O, adipocitele diferențiate au fost tratate cu formula PPC/DC, PPC sau DC. Probele de proteine au fost preparate în 120 μl de tampon de liză (10 mM Tris (pH 7,4), EDTA și 1% SDS suplimentat cu un inhibitor de proteinază (Roche)), precum și o placă cu 24 de godeuri. Pentru analiza imunoblot, anticorpii primari pentru PPARγ, C/EBPα, FABP4, α-tubulină, HSP90 α/β (Santa Cruz Biotechnology, Inc., Santa Cruz, CA, SUA), PARP, caspază-3 și fosfo-hormoni sensibili au fost utilizate lipaza (HSL) (Cell Signaling Technology, Danvers, MA, SUA) și anticorpii secundari pentru IgG anti-iepure sau anti-șoarece conjugat cu HRP (Thermo Fisher, SUA).
Histologie
Țesutul izolat de la șobolani a fost imediat fixat cu 4% paraformaldehidă și încorporat în parafină. Secțiunile (5-μm grosime) au fost colorate cu hematoxilină și eozină sau s-a efectuat colorarea imunohistochimică folosind anticorpul F4/80 (Abcam, Cambridge, Marea Britanie) urmată de aplicarea metodei de colorare avidin-biotină, DAB (Vector Laboratories, Burlingame, CA, SUA).
analiza expresiei ARNm
A fost preparat ARN total și primul ADNc sintetizat a fost utilizat pentru exprimarea ARNm așa cum s-a descris anterior [14]. Pe scurt, imediat după disecție, țesutul de șobolan a fost înghețat în azot lichid și menținut la -80 ° C pentru prelucrare ulterioară. Probele de țesut au fost măcinate în azot lichid și ARN-ul total a fost extras folosind reactivul Tri-ARN conform instrucțiunilor producătorului. Aproximativ 500 ng de ARN total au fost folosite pentru prima sinteză a ADNc (Toyobo, Osaka, Japonia), iar expresia ARNm a fost cuantificată folosind transcrierea inversă cantitativă-PCR (qRT-PCR) cu amestec de PCR verde SYBR (Toyobo, Osaka, Japonia). Următorii primeri au fost utilizați pentru amplificarea și cuantificarea specifică a expresiei genelor cu RT-PCR în timp real: EMR1; EMR1-F: 5'-AGGGCCTGGAAGAATCTTGT-3 'și EMR1-R: 5'-CGTGTTGATGCAAATGAAGG-3', IL1β; IL1β-F: 5'-AAATACCTGTGGCCTTGGGC-3 'și IL1β-R: 5'-CTTGGGATCCACACT CTCCAG-3' și FABP4; FABP4-F: 5′-TCTGGTGAAGCC CAAGATCG-3 ′ și FABP4-R: 5′-CCTCTGGGTTTCCGCCAGTT-3 ′ .
Statistici
PPC are o specificitate mai mare față de adipocite decât DC
Deoarece formula PPC/DC părea să aibă o eficiență mai mare în ceea ce privește liza adipocitelor decât DC singur, am investigat dacă PPC a fost componenta activă responsabilă de acest lucru. Pentru a testa acest lucru, am efectuat un test de viabilitate celulară comparând efectele individuale ale PPC și DC. Am constatat că, în timp ce scăderea viabilității preadipocitelor 3T3L1 atunci când a fost tratată cu DC a fost mai mare decât cea observată atunci când celulele au fost tratate cu PPC (Fig. 2A), viabilitatea adipocitelor diferențiate a scăzut cu o cantitate comparabilă atunci când a fost tratată cu PPC sau DC (Fig. 2A). 2B). De asemenea, am observat că tratamentul cu PPC a indus o scădere a vacuolelor lipidice, care se găsesc în mod specific în adipocitele mature, după cum se indică prin numărul redus de celule colorate pozitiv cu Oil Red O (S1 Fig și S2 Fig). Imaginea confocală cu celule vii a arătat, de asemenea, că în timpul unui tratament de opt ore, PPC a indus o reducere mai puternică a vacuolelor lipidice în adipocite comparativ cu DC (Fig 2C și 2D, fișiere video S1 - S4).
A. Viabilitatea preadipocitului 3T3L1 și B. adipocitului a fost măsurată la opt ore după tratament cu diferite doze de PPC sau DC utilizând testul MTT. Imagini confocale vii de preadipocite C. 3T3L1 și D. adipocite capturate înainte (0 h) și opt ore de tratament cu 0,03% PPC sau DC. Punctele albe indică vacuolele lipidice ale adipocitelor mature, iar tratamentul de opt ore cu PPC a scăzut numărul de celule lipidice vacuole pozitive într-o măsură mai mare decât tratamentul DC. Probele de proteine din preadipocitele E. 3T3L1 și F. adipocite tratate cu 0,01% sau 0,03% PPC sau respectiv DC timp de opt ore au fost preparate și expresia preadipocitului (C/EBPα, PPARγ și HSL) și adipocitului matur (C/Markeri EBPα, PPARγ, HSL și FABP4), markeri apoptotici (clivat-caspază3 și clivat-parp), precum și cantitatea de controale de încărcare (HSP90 și α-tubulină) au fost analizate utilizând Western blot. Bara de scară indică 20 μm.
Reducerea țesutului adipos de PPC sau DC într-un model de șobolan
Imaginile RM au fost achiziționate pentru a măsura suprafața inghinală a șobolanilor Sprague-Dawley, înainte de (Pre) și 7, 14 și 28 de zile după injectarea a 25 mg de PPC (n = 6), 12,5 mg de PPC (n = 6), 25 mg DC (n = 5) sau 12,5 mg DC (n = 5) într-o parte a tamponului de grăsime inghinală bilaterală și soluție de control (etanol pentru PPC și PBS pentru DC) în cealaltă parte. Datele sunt prezentate ca procent din suprafața tamponului de grăsime inghinală injectată cu PPC sau DC în zona tamponului de grăsime injectat de control.
Greutățile țesutului excizat bilateral, inclusiv țesutul adipos inghinal (IngWAT), țesutul adipos epididimal (EpiWAT), mușchiul cvadriceps și țesutul din rinichi, au fost măsurate la 30 de zile după injectarea a 25 mg PPC (n = 6), 12,5 mg PPC n = 6), 25 mg DC (n = 5) sau 12,5 mg DC (n = 5). Datele sunt prezentate ca procentul din greutatea țesutului rezultat din injecția PPC sau DC la greutatea țesutului rezultat din injectarea soluției de control.
Injecția DC provoacă un răspuns inflamator mai puternic decât PPC
A. Colorarea hematoxilinei și eozinei a secțiunilor de țesut adipos inghinal de la șobolani la 30 de zile după control, injecție PPC sau DC. Săgeata indică infiltrarea macrofagelor, iar bara de scală indică 50 μm. B. Analiza expresiei genetice a țesutului adipos inghinal injectat cu control sau 25 mg sau 12,5 mg PPC sau respectiv DC. Folosind qRT-PCR în timp real, nivelurile relative de expresie ale FABP4, un marker pentru adipocite mature și markeri EMR1, NOS2, CD68, CD80 și IL1β pentru macrofage, în țesutul adipos inghinal injectat cu PPC sau DC au fost comparate cu expresia din țesut adipos inghinal injectat cu etanol sau, respectiv, soluții de control PBS.
Discuţie
Deși liposucția a devenit o procedură predominantă și eficientă pentru reducerea grăsimii corporale, aceasta necesită, în general, anestezie și prezintă un risc de complicații medicale și chiar de deces în rare ocazii. De la prima sa aplicare în tratamentul cu xantelasma, injecția de PPC derivat din soia a apărut ca o procedură alternativă pentru reducerea depozitelor de grăsime localizate. De fapt, mai multe studii clinice au demonstrat că injectarea unei formule care conține PPC și DC contribuie la reducerea volumului țesutului adipos [5-7, 16].
Procedurile non-chirurgicale de reducere a grăsimii au multe avantaje, deoarece sunt rentabile, nu necesită anestezie sau spitalizare și nu prezintă niciun risc de cicatrici operatorii. Cu toate acestea, siguranța este cel mai important criteriu de aplicare ca agent terapeutic. Injecțiile DC au fost asociate cu multe evenimente adverse, inclusiv durere, edem, amorțeală și umflături, deși acestea au fost tranzitorii și limitate la locurile injectate [17]. Mai mult, pacienții care au primit injecții DC s-au plâns de durere mai mult decât cei tratați cu formula PPC/DC [13]. Deoarece țesutul adipos este conectat direct la sistemul nervos [19, 20], durerea după tratamentul PPC/DC ar putea fi cauzată de leziuni neuronale mediate de DC. Alternativ, un răspuns inflamator poate fi responsabil pentru durere, deoarece s-a observat o infiltrare crescută a macrofagelor în urma tratamentului DC. Mecanismul care stă la baza acestuia rămâne să fie elucidat și sunt necesare studii clinice suplimentare, care implică probabil scorul duratei și intensității durerii după tratamentul cu PPC sau DC.
Limita majoră a studiului nostru a fost metodologia utilizată pentru a pregăti soluția PPC. Deoarece PPC nu se dizolvă bine în apă, am folosit etanol ca solvent. Cu toate acestea, am folosit doar 0,1% etanol (1 μl de PPC în etanol la 1 ml de mediu de cultură) pentru a trata preadipocitele sau adipocitele cu PPC. La această concentrație, etanolul în sine nu a afectat viabilitatea celulară, deoarece probele tratate cu 0,1% apă (controlul DC) sau 0,1% etanol (controlul PPC) au prezentat o viabilitate comparabilă a celulei. Mai mult, am comparat activitatea morții celulare a PPC cu aceeași cantitate de control al etanolului. Astfel, rolul PPC în inducerea morții celulelor adipocitare a fost demonstrat în mod concludent.
Au fost raportate mai multe efecte benefice ale PPC, inclusiv cele legate de gestionarea hiperlipidemiei, demenței și fibrozei anti-hepatice [25-30]. Deși injecția cu PPC pare, de asemenea, să inducă umflături, studiul nostru arată că efectele sale sunt mai tranzitorii și mai ușoare decât cele induse de DC. Prin urmare, propunem PPC să fie un agent promițător pentru procedurile de adipo-distrugere, deoarece acționează selectiv asupra adipocitelor. Dezvoltarea unei metodologii mai bune pentru prepararea PPC care este adecvată pentru oameni, optimizarea dozei utilizate și a intervalului de dozare și combinarea cu alte tratamente [31] care minimizează efectele adverse ar trebui explorate pentru aplicații terapeutice.
- Clasamentul Efectului oficial harful al pastilelor dietetice care nu sunt reglementate de FDA
- Efectul satisfăcător al dietelor bogate în proteine asupra subiecților antrenați în rezistență în deficit energetic - PubMed
- Nige; s Dieta; Blog de nutriție Izbucnind din cusături Adipocitele obeze explodează literalmente și lasă un
- Polimeri fără text complet Efectul conținutului de co-monomeri asupra umflăturii și a mecanismului
- Reddit - nutriție - Gânduri la dieta extremă a idolilor kpop (este modul de înfometare cu efect yoyo real)