Editorii noștri vor examina ceea ce ați trimis și vor stabili dacă să revizuiți articolul.
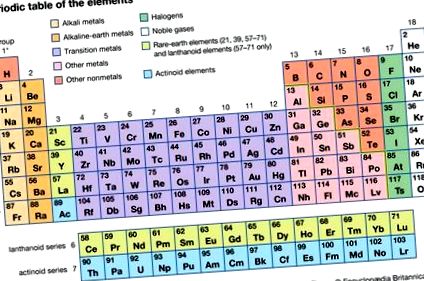
Element de grup carbon, oricare dintre cele șase elemente chimice care alcătuiesc grupa 14 (IVa) din tabelul periodic - și anume carbon (C), siliciu (Si), germaniu (Ge), staniu (Sn), plumb (Pb) și fleroviu (Fl ).
Cu excepția germaniului și a fleroviului produs artificial, toate aceste elemente sunt familiare în viața de zi cu zi fie ca element pur, fie sub formă de compuși, deși, cu excepția siliciului, niciunul nu este deosebit de abundent în scoarța terestră. Carbonul formează o varietate aproape infinită de compuși, atât în regatele vegetale, cât și în cele animale. Siliciul și mineralele silicat sunt componente fundamentale ale scoarței terestre; silice (dioxid de siliciu) este nisip. Staniul și plumbul, cu abundențe în scoarță mai mici decât cele ale unor așa-numite elemente rare, sunt totuși comune în viața de zi cu zi. Ele apar în depozite minerale foarte concentrate, pot fi obținute cu ușurință în stare metalică din aceste minerale și sunt utile ca metale și ca aliaje în multe aplicații. Pe de altă parte, germaniu formează puține minerale caracteristice și se găsește cel mai frecvent numai în concentrații mici, în asociere cu blenda minerală de zinc și în cărbuni. Deși germaniul este într-adevăr unul dintre elementele mai rare, și-a asumat importanța la recunoașterea proprietăților sale ca semiconductor (adică capacitatea limitată de a conduce electricitatea).
Chimie comparată
În tabelul periodic, elementele cu opt electroni din exterior formează grupul cunoscut sub numele de gaze nobile (Grupul 18 [0]), cel mai puțin reactiv dintre elemente. Elementele grupului de carbon (Grupul 14), cu patru electroni, ocupă o poziție de mijloc. Elementele din stânga grupului 14 au mai puțin de patru electroni în carcasa de valență și tind să-i piardă (cu sarcinile lor negative) pentru a deveni ioni încărcați pozitiv, reprezentați de simbolul elementului cu un supercript care indică numărul și semnul taxe; astfel de elemente se numesc metale. Nemetalele (cu excepția borului) se află în grupurile din dreapta grupului 14; fiecare are mai mult de patru electroni în învelișul său exterior și tinde să dobândească electroni pentru a-și completa octetul, formând ioni încărcați negativ.
Reacțiile chimice rezultă din schimbul de electroni între atomi. În general, dacă un metal își pierde câțiva electroni de valență față de un nemetal, ionii încărcați în mod opus rezultați sunt atrași unii de alții și formează o legătură, clasificată ca ionică sau electrovalentă. Două metale, dintre care niciunul nu își poate pierde efectiv electronii de valență în reacția chimică, le pot împărți totuși în perechi în așa fel încât rezultă ceea ce se numește o legătură covalentă. Atomii metalici se vor lega între ei într-un al treilea tip de legătură, care eliberează electronii lor de valență într-un mod care le permite să conducă electricitatea.
- Cea mai bună combinație de suplimente pentru pierderea în greutate și creșterea energiei Keto Select - Storm Ventures Group
- 10 moduri în care rețelele sociale pot ajuta la pierderea în greutate - Courtney Medical Group
- Întrebați un grup comunitar Forum dietetician MyNetDiary
- 10 semne de avertizare ale cancerului de col uterin pe care nu trebuie să le ignorați niciodată Geelong Medical; Grupul de sănătate
- Articolul Impactul cărbunelui activ din gropile de date, permanganat de potasiu și combinația acestora