AM Egorov
Facultatea de Chimie, M.V. Universitatea de Stat Lomonosov din Moscova, Leninskie Gori, 1, clădire. 3, Moscova, 119991, Rusia
M. M. Ulyashova
Facultatea de Chimie, M.V. Universitatea de Stat Lomonosov din Moscova, Leninskie Gori, 1, clădire. 3, Moscova, 119991, Rusia
M. Yu. Rubtsova
Facultatea de Chimie, M.V. Universitatea de Stat Lomonosov din Moscova, Leninskie Gori, 1, clădire. 3, Moscova, 119991, Rusia
Abstract
Rezistența microorganismelor la antibiotice se dezvoltă de peste 2 miliarde de ani și este răspândită pe scară largă printre diferiți reprezentanți ai lumii microbiologice. Enzimele bacteriene joacă un rol cheie în apariția rezistenței. Clasificarea acestor enzime se bazează pe participarea lor la diverse mecanisme biochimice: modificarea enzimelor care acționează ca ținte antibiotice, modificarea enzimatică a țintelor intracelulare, transformarea enzimatică a antibioticelor și implementarea reacțiilor de metabolism celular. Principalele mecanisme de dezvoltare a rezistenței sunt asociate cu evoluția superfamiliei de enzime bacteriene datorită variabilității genelor care le codifică. Colecția tuturor genelor de rezistență la antibiotice este cunoscută sub numele de rezistom. Zeci de mii de enzime și mutanții lor care pun în aplicare diferite mecanisme de rezistență formează o nouă comunitate numită „enzistomul”. Analiza structurii și caracteristicilor funcționale ale enzimelor, care sunt țintele diferitelor clase de antibiotice, ne vor permite să dezvoltăm noi strategii pentru depășirea rezistenței.
INTRODUCERE
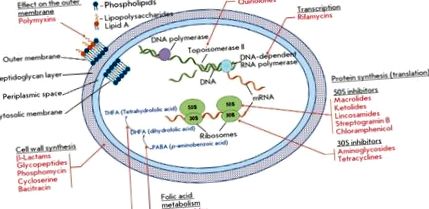
Rezistența la antibiotice a agenților cauzali ai bolilor infecțioase este o problemă globală în biologie și medicină [1, 2]. Medicamentele antimicrobiene moderne (DMA) reprezintă cel mai mare grup de medicamente farmaceutice, incluzând 16 clase de compuși naturali și sintetici (Fig. 1).
Principalele clase de medicamente antimicrobiene, țintele lor și efectul lor asupra principalelor procese de activitate vitală a unei celule bacteriene
Sinteza antibioticelor există în natură de mai bine de 2 miliarde de ani. În tot acest timp, bacteriile au dezvoltat mecanisme de rezistență la acțiunea lor toxică. Rezistența poate apărea ca un proces adaptiv care nu are legătură cu structura unui antibiotic sau se poate dezvolta ca rezultat al selecției tulpinilor rezistente de microorganisme sub influența antibioticelor. Factorii antropici asociați cu aplicarea antibioticelor în medicină și, mai ales, în agricultură de la mijlocul secolului al XX-lea au dus la o evoluție semnificativă a mecanismelor de rezistență; timpul necesar dezvoltării rezistenței la medicamente noi s-a redus semnificativ [3, 4].
Rolul enzimelor bacteriene în dezvoltarea rezistenței este destul de versatil și implică mai multe mecanisme cheie (Fig. 2) [5]. Enzimele implicate în biosinteza peretelui celular, precum și sinteza acizilor nucleici și a metaboliților, servesc drept țintă directă pentru antibiotice. Mecanismul de rezistență este asociat cu modificări structurale ale acestor enzime. Un alt mecanism este asociat cu modificarea enzimatică a elementelor structurale afectate de antibiotice: de exemplu, modificarea ribozomilor prin metiltransferaze. Un grup mare de enzime modifică sau distrug structura antibioticelor prin inactivarea lor. Enzimele care catalizează procesele metabolice și modifică AMD sub formă de promedicamente sunt, de asemenea, implicate în dezvoltarea rezistenței.
Clase de enzime implicate în diferite mecanisme de rezistență la medicamente antimicrobiene
Enzimele bacteriene care determină rezistența aparțin de obicei superfamiliei mari; multe dintre ele provin din enzime care inițial aveau alte funcții [6]. Genele responsabile de sinteza acestor enzime și variabilitatea lor mutațională sunt adesea localizate pe elemente genetice mobile, asigurând astfel răspândirea rapidă a rezistenței între microorganisme.
Această revizuire prezintă date privind caracteristicile funcționale ale principalelor clase și grupuri de enzime bacteriene implicate în implementarea mecanismelor de rezistență bacteriană la DMA.
ENZIMELE BACTERIENE CA OBIECTIVELE AMD
Proteine care leagă penicilina
Domeniile C-terminale ale tuturor PBP sunt țintele antibioticelor β-lactamice, care constituie mai mult de jumătate din toate DMA utilizate în prezent [10]. Aceste antibiotice conțin un inel β-lactamic, un analog structural al dipeptidei D-Ala-D-Ala și, prin urmare, acționează ca inhibitori competitivi ai PBP. Interacțiunea dintre gruparea carbonil din inelul β-lactam și grupul hidroxil al serinei în centrul activ al unui PBP dă naștere unei forme acilate inactive a enzimei. Inhibarea ireversibilă perturbă sinteza peretelui celular bacterian [9, 10].
Principalele motive pentru care bacteriile gram-pozitive dezvoltă rezistență la antibiotice β-lactamice includ mutații în PBP-urile native, hiperproducerea lor și sinteza de noi PBP care sunt insensibile la inhibarea de β-lactame [11]. Astăzi, răspândirea tulpinilor Staphylococcus aureus rezistente la meticilină și alte peniciline semisintetice și cefalosporine reprezintă o amenințare [12]. Rezistența este determinată de expresia celei de-a cincea enzime, PBP2a (în plus față de cele patru PBP native), care are o afinitate scăzută pentru antibioticele β-lactamice și prezintă doar activitate transpeptidază. Figura 4 prezintă mecanismul de rezistență: fără un antibiotic, ambele domenii ale unei PBP cu greutate moleculară mare sunt implicate în biosinteza peptidoglicanului (A); numai domeniul glicoziltransferazei rămâne activ într-un PBP cu greutate moleculară mare în prezența unui antibiotic, în timp ce domeniul transpeptidazei este acilat și nu formează legături încrucișate. PBP2a (B) cu greutate moleculară mică dobândită este cea care prezintă activitate transpeptidază în tulpina rezistentă. Ca urmare, viabilitatea celulei este restabilită.
Rolul proteinelor care leagă penicilina în rezistența bacteriilor gram-pozitive la antibiotice β-lactamice. Tulpină sensibilă A, tulpină rezistentă la B
Enzimele PBP2a sunt codificate de genele mecA [13] sau mecC [14]. Genele mecA și mecC, împreună cu genele care le reglementează expresia (mecI, mecR1 și mecR2), sunt componentele elementului genetic mobil al cromozomului casetei stafilococice mec [15].
Proteinele aparținând familiei PBP joacă un rol crucial în formarea peretelui celular bacterian și sunt precursori ai rezistenței cauzate de producția de β-lactamază (a se vedea secțiunea „β-Lactamaze”).
Topoizomeraze de tip II: ADN girază și topoizomerază IV
Topoizomerazele de tip II includ ADN girază și topoizomerază IV, care catalizează modificări în configurația spațială a moleculei ADN în timpul replicării, transcripției și diviziunii celulare [16, 17]. ADN giraza și topoizomeraza IV sunt enzime heterotetramerice: ADN giraza constă din două subunități GyrA (97 kDa) și două subunități GyrB (90 kDa); topoizomeraza IV constă din două subunități ParC (84 kDa) și două subunități ParE (70 kDa). Subunitățile GyrA și ParC formează domeniile catalitice implicate în formarea complexelor cu molecula ADN pentru spargerea/ligarea acesteia; subunitățile GyrB și ParE prezintă activitate ATPase pentru a furniza energie procesului.
ADN giraza și topoizomeraza IV servesc drept ținte pentru chinolone și derivații lor, fluorochinolone. Formarea complexului ADN de tip topoizomerază II este o condiție necesară pentru inhibare (Fig. 5). Locul de legare a antibioticului la enzimă în complexul ternar este cunoscut sub numele de buzunar de legare a chinolonelor [17, 18].
Structura schematică a unui complex ternar între topoizomerazele de tip II, ADN și chinolonele. (Gyr A, Gyr B - subunități girază, Par C, Par E - subunități topoizomerază IV)
Antibioticul se leagă non-covalent de locul activ al enzimei, astfel încât mișcarea enzimei și furca de replicare de-a lungul moleculei de ADN sunt oprite [19]. Formarea complexului terțiar chinolon - topoizomerază II - ADN oprește nu numai replicarea, ci și transcrierea, deoarece mișcarea ARN polimerazei de-a lungul șablonului ADN este inhibată [20]. În aceasta, se formează pauze în molecula de ADN bicatenar, care determină și acțiunea bactericidă a chinolonelor [21]. Chinolonele nu afectează topoizomerazele de tip II la mamifere, deoarece diferă semnificativ de topoizomerazele bacteriene.
Mutațiile aminoacizilor din regiunea QRDR a subunităților GyrA și ParC ale topoizomerazelor de tip II de la E. coli, care sunt responsabile de rezistența la chinolone. Culoarea indică pozițiile mutațiilor a căror combinație provoacă un efect sinergic
ARN polimerază dependentă de ADN
Efectul bactericid al rifamicinelor (rifampicină, rifabutină) constă în inhibarea ARN polimerazei dependente de ADN [23]. Această enzimă este formată din cinci subunități: două α- (greutatea moleculară a fiecărei subunități este de 35 kDa), β- (155 kDa), β’- (165 kDa) și σ-subunități (70 kDa). Cele patru subunități ββ’αα formează așa-numita apoenzimă, care prezintă activitate catalitică și efectuează toate etapele principale ale transcripției. Inițierea transcrierii și recunoașterea promotorilor genetici bacterieni necesită formarea unei holoenzime, care are loc atunci când subunitatea σ reglatoare se leagă de apoenzimă [24].
Rifamicinele se leagă selectiv de subunitatea β a enzimei din apropierea canalului principal și inhibă alungirea catenei de ARN originare. Apariția rezistenței la rifamicine în cele mai multe cazuri este asociată cu mutații într-un fragment relativ mic al genei rpoB (codoni 507-533) care codifică subunitatea β a ARN polimerazei. Mutațiile reziduurilor de aminoacizi la pozițiile 513, 516, 526 și 531 (Fig. 7) sunt caracterizate de cel mai înalt grad de polimorfism [25].
Mutații de aminoacizi în fragmentul RpoB al subunității β a ARN polimerazei, care sunt responsabile de rezistența la rifamicine
Enzime care catalizează biosinteza acizilor micolici
Termenul „acizi micolici” este un nume generic pentru un grup de acizi grași ramificați cu lanț lung, componente ale peretelui celular micobacterian. Unele medicamente antituberculozice, derivați ai acidului izonicotinic (izoniazid, etionamid și protionamid), suprimă sinteza acizilor micolici [25, 26]. Aceste medicamente sunt direcționate către proteina reductază enil-acil purtătoare (cunoscută sub numele de InhA), care este o componentă a acidului gras sintaz FAS-II. Catalizează reducerea acizilor grași nesaturați D2 la aceia saturați utilizând cofactorul NADPH ca donator de hidrogen [27]. Sinteza perturbată a acizilor micolici suprimă sinteza peretelui celular micobacterian.
Rezistența la aceste medicamente este cauzată de mutații ale genei inhA, care afectează fie regiunea promotoră a operonului mabA-inhA și provoacă hiperproducție a enzimei, fie secvența care codifică enzima, reducând astfel afinitatea acesteia pentru complexul dintre izonicotinic. radical acid și NAD + [28, 29].
ENZIME BACTERIENE CARE MODIFICĂ TINTELE CELULARE A AMD
ARNm metiltransferaze
Ribozomii bacterieni acționează ca ținte pentru multe DMA [30]. Subunitatea mică 30S este formată din ARNr 16S și 21 proteine. Aminoglicozidele se leagă de subunitatea 30S pentru a produce legături de hidrogen cu bazele azotate ale mai multor nucleotide ale ARNr 16S, care previne legarea corectă a aminoacil-ARNt la anticodon și duce la erori de sinteză a proteinelor și la moartea celulară ulterioară (Fig. 8A). Unele aminoglicozide pot inhiba direct inițierea sau bloca alungirea lanțului polipeptidic [30, 31].
Legarea aminoglicozidelor (A) și a antibioticelor grupului MKLS (B) de ribozom și efectul acestora asupra sintezei proteinelor
Unul dintre mecanismele de rezistență la aminoglicozide este metilarea sitului A al 16S rRNA de către 16S rRNA metiltransferaze bacteriene care are ca rezultat o pierdere a capacității de legare la ribozom de către antibiotice [32, 33]. S-adenozil-L-metionina (SAM) donează gruparea metil pentru aceste enzime. Au fost descrise unsprezece metiltransferaze 16S ARNr diferite, care pot fi împărțite în două grupe în funcție de tipul de nucleotidă modificată în situl A. Enzimele clasificate în primul grup (ArmA, RmtA, RmtB, RmtC, RmtD1, RmtD2, RmtE, RmtF, RmtG și RmtH) catalizează metilarea ARNr 16S în poziția N7 a nucleotidei G1405 și fac bacteriile rezistente doar la 4,6-disubstituite aminoglicozide. Al doilea grup include NmpA metiltransferaza, care metilează nucleotida A1408 în poziția N1 și conferă rezistență tuturor aminoglicozidelor cunoscute, cu excepția streptomicinei și spectinomicinei [31, 32].
Genele care codifică aceste enzime se localizează în principal la plasmide conjugative și/sau sunt asociate cu transpozoni; acestea sunt adesea legate de alte gene de rezistență la antibiotice [34]. Enzimele RmtB și ArmA sunt cele mai frecvente. Producătorii de RmtB au fost izolați nu numai din specimenele clinice de agenți patogeni umani, ci și de la animalele domestice, ceea ce indică faptul că factorii determinanți ai rezistenței pot fi probabil transmiși de la animale la oameni [33].
Macrolidele, cetolidele, lincosamidele și streptogramina B (grupul MKLS conform denumirii componentelor sale) sunt direcționate către subunitatea mare 50S a ribozomului conținând ARNr 5S și 23S și 33 proteine ribozomale. În ciuda diferențelor în structura lor, aceste antibiotice au un site comun de legare cu subunitatea 50S în imediata apropiere a centrului peptidil transferazei. Între timp, ele închid tunelul ribozomal, elementul structural situat în subunitatea mare ribozomală. Această interacțiune are ca rezultat disocierea peptidil-ARNt de ribozom, ceea ce duce la întreruperea translocației și terminarea sintezei proteinelor (Fig. 8B).
O căutare activă pentru inhibitori eficienți ai ARNm metiltransferazei este în curs de desfășurare. Inhibitorii centrului de legare SAM al enzimelor care imită molecula - donator al grupării metil au fost propuși ca inhibitori ai ARN metiltransferazei, dar s-au dovedit a fi neselectivi [37]. Au fost, de asemenea, propuși compuși care inhibă atât centrele de legare SAM, cât și cele de legare a substratului [38].
Enzime implicate în modificarea peptidoglicanului în peretele celular bacterian
Fosfoetanolamină transferaze
Polimixinele (colistina) sunt vizate lipopolizaharidele membranei exterioare a bacteriilor Gram-negative. Principalul constituent al acestor DMA este polipeptida ciclică încărcată pozitiv, al cărei mecanism de acțiune este similar cu cel al detergenților cationici. Interacțiunea dintre moleculele de polimixină și grupurile fosfat încărcate negativ de lipopolizaharide neutralizează sarcina membranei și modifică permeabilitatea membranei pentru componentele intra și extracelulare. Principalul mecanism de rezistență la polimixine este asociat cu închiderea canalului de penetrare a antibioticului în celulă. Acest canal este închis prin modificarea lipidei A (componenta lipopolizaharidelor) cu fosfoetanolamină, care este catalizată de fosfoetanol amină transferază (Fig. 9) [44]. Gena care codifică această enzimă are localizare cromozomială. Gena mcr-1 a fost recent detectată pe plasmide [45]. Dezvoltarea acestui tip de rezistență este asociată cu mutații ale genelor fosfoetanolamin transferazei [46].
Schema de modificare a lipidei A, o componentă a lipopolizaharidelor membranei celulare externe, prin fosfoetanolamină transferază
- Medicamente și medicamente anti-infecțioase - Tablete antibiotice Unitate 100% orientată spre export din Mumbai
- 10 exerciții de bandă de rezistență pentru picioare mai puternice în afara online
- 4 factori de blocare metabolică asociați cu rezistența la pierderea grăsimilor - Pinnacle Fitness Center
- 5 exerciții cu cercul de rezistență pentru un antrenament pe tot corpul
- 10 exerciții de bandă de rezistență pentru a construi forța totală a corpului