Laboratorul John B. Pierce,
Laboratorul John B. Pierce,
Departamentul de Fiziologie Celulară și Moleculară, Școala de Medicină a Universității Yale, New Haven, Connecticut 06519
Abstract
Postul determină o creștere progresivă a metabolismului lipidic în mușchiul scheletic. Pentru a determina efectele postului asupra reglării transcripționale a genelor importante pentru controlul metabolic în mușchiul scheletic compus din diferite tipuri de fibre, nucleii de la șobolanii de control și cei de post (24 și 72 de ore) au fost supuși unei analize nucleare funcționale folosind un RT-PCR -tehnica bazata. Postul a crescut (P mușchiul scheletic, în virtutea masei sale și a necesarului total de energie, este țesutul primar responsabil pentru eliminarea glucozei și lipidelor din circulație și joacă astfel un rol cheie în menținerea homeostaziei metabolice generale (33, 42). Recunoașterea tot mai mare a faptului că modificările subtile ale echilibrului energetic, atunci când sunt luate în considerare pe perioade prelungite de timp, reprezintă un factor de risc semnificativ pentru dezvoltarea unor anomalii metabolice precum rezistența la insulină, hipertrigliceridemia, obezitatea și diabetul zaharat non-insulinodependent a intensificat căutarea pentru semnalizarea celulară specifică și proteine reglatoare care pot influența controlul metabolic al mușchilor scheletici (32).
Cele mai multe progrese în înțelegerea noastră a modului în care pot fi sesizate provocări acute la nivelul metabolismului intermediar și la care se poate răspunde la nivel molecular au apărut din activitatea în ficat, rinichi și țesut adipos. De exemplu, tranziția de la starea alimentată la starea de post activează în mod dramatic transcrierea unui număr de gene care codifică enzime cu roluri care limitează rata în gluconeogeneza hepatică, oxidarea acizilor grași și ketogeneza. Ajutată de studii moleculare la șoareci transgenici și diverse sisteme de cultură celulară, caracterizarea detaliată a elementelor de reglare din regiunile promotor ale acestor gene a condus la identificarea proteinelor cheie de semnalizare și a factorilor de transcripție care răspund la diverse manipulări nutriționale și/sau hormonale (13, 19.30).
Materiale.
Șobolani Sprague-Dawley masculi au fost crescuți în casă sau au fost cumpărați de la Charles River Laboratory (Wilmington, MA). Toți șobolanii au fost adăpostiți individual într-o cameră cu temperatură (22 ° C) și lumină controlată (întuneric 9:00 AM-9: 00 PM) și li s-a oferit acces gratuit la alimente (dieta Purina Rodent) și apă. Compușii radio-marcați au fost achiziționați de la Amersham Pharmacia Biotech. Toate celelalte substanțe chimice au fost de calitate biologică moleculară și au fost achiziționate de la Boehringer Mannheim, GIBCO-BRL, Promega sau Sigma Chemical.
Proiectare experimentală.
Șobolanii cântăreau 340-360 g în momentul fiecărui experiment. Hrana a fost îndepărtată de la șobolanii experimentali la începutul ciclului întunecat (9:00 AM) și a fost reținută timp de 24 sau 72 de ore, menținând în același timp accesul liber la apă. Șobolanii de control au continuat să aibă acces gratuit la alimente și apă. Într-un al doilea set de experimente, cererea metabolică a crescut în timpul postului (24 de ore) prin faptul că șobolanii au efectuat două perioade de 2 ore de exerciții de rulare (18 m/min, înclinare de 5 °) începând cu 1 și 6 ore după îndepărtarea alimentelor, 10: 00 AM și 15:00). Șobolanii au fost uciși la 24 de ore (∼16 h după ultima luptă de exerciții) și au fost comparați cu șobolani de control suplimentari și 24 de ore post. La finalizarea experimentelor, șobolanii au fost anesteziați (35 mg/kg ip pentobarbital sodiu) și așezați pe un tampon de încălzire pentru a menține temperatura corpului în timpul intervenției chirurgicale.
Izolarea nucleelor.
Determinarea ratei de transcriere prin RT-PCR.
RT al ARN născut a fost efectuat utilizând sistemul Superscript II RNase H - (GIBCO-BRL) conform instrucțiunilor producătorului. Pe scurt, 18 μl de ARN au fost amestecate cu 1,5 μl oligo (dT) 12-18 (500 ng/μl), încălzite la 70 ° C timp de 10 min și răcite rapid pe gheață timp de 5 min. După rotirea condensului, 6 μl de tampon de reacție 5 × (250 mM Tris, pH 8,3, 375 mM KCl și 15 mM NaCl), 3 μl de 0,1 M DTT și 1,5 μl de amestec dNTP (10 mM fiecare din dATP, dCTP, dGTP și dTTP) au fost adăugate la fiecare probă. După o preincubare de 2 minute la 42 ° C, s-au adăugat 1,0 pl de Superscript II și probele au fost incubate la 42 ° C timp de 50 min. Enzima a fost inactivată prin incubare la 70 ° C timp de 15 min. Pentru a ține cont de diferențele în conținutul de nuclee dintre probe înainte de reacția de testare, produsele RT au fost diluate cu H2O fără nuclează pe baza conținutului relativ de ADN genomic al fiecărui preparat de nuclee (vezi mai jos). Volumul mediu a fost stabilit la 150 μl.
Tabelul 1. Amorsele și condițiile de reacție utilizate pentru PCR pe RT-ARN nuclear
UCP3, proteina 3 de decuplare; LPL, lipoproteină lipazică; CPT I, carnitin palmitoiltransferaza I; LCAD, acil-CoA dehidrogenază cu lanț lung; MCAD, acil-CoA dehidrogenază cu lanț mediu; HK II, hexokinaza II; [MgCl2], concentrare MgCl2; AT, temperatura de recoacere.
Izolarea și cuantificarea ADN-ului genomic.
Pentru a corecta diferențele inițiale în conținutul de nuclee dintre probe, ADN-ul genomic a fost izolat dintr-o porțiune din fiecare probă de nuclee în aceeași zi cu reacția nucleară. O alicotă de 20 μl de nuclee a fost plasată în 380 μl de tampon de digestie (10 mM Tris, pH 8,0, 100 mM NaCl, 25 mM EDTA, 0,5% SDS și 100 μg de proteină K) și incubat la 50 ° C pentru ( 6 ore. După adăugarea a încă 380 μl de H2O fără nuclează, ADN-ul a fost izolat prin extracție cu un volum egal de fenol-cloroform-isoamil OH (25: 24: 1), separat prin centrifugare (12.000 g, 4 ° C), și precipitat din faza apoasă rezultată prin adăugarea de 1 10 vol 3 M NaOAc -, 100 μg de ARNt (pentru a ajuta la vizualizarea peletelor de ADN) și 2,5 vol EtOH 100%. ADN-ul a fost peletat (12.000g, 10 min, 4 ° C), clătit cu 70% EtOH și resuspendat în 50 μl de 10 mM Tris și 1 mM EDTA (TE, pH 8,0) peste noapte la 4 ° C. Cuantificarea relativă a ADN-ului genomic (conținutul de nuclee inițiale) a fost determinată prin amplificarea PCR a genei β-actină. Aceste date au fost utilizate pentru a ajusta diluțiile finale ale produselor de reacție RT corespunzătoare din reacțiile nucleare de funcționare (înainte de PCR, vezi mai sus) pentru a ține cont de diferențele mici în conținutul de nuclee inițiale între probe.
Determinarea activității transcripționale totale.
Efectul postului asupra activității transcripționale totale.
Pentru a determina influența potențială a postului asupra activității transcripționale generale în mușchiul scheletic, o porțiune de nuclee din fiecare probă a fost supusă reacției nucleare de funcționare în care UTP rece a fost înlocuit cu [32 P] UTP. Radioactivitatea totală a ARN-ului nuclear izolat normalizat la ADN genomic a fost luată ca un indice al activității transcripționale totale. Așa cum se arată în FIG. 2, postul a redus semnificativ activitatea transcripțională totală cu 20-53% la mușchiul plantar și gastrocnemius alb. Scăderea a fost evidentă în primele 24 de ore și nu a mai fost deprimată după 72 de ore. Deși răspunsurile au fost oarecum variabile, postul a avut și tendința (P = 0,051) pentru a scădea activitatea transcripțională totală în mușchiul gastrocnemius roșu. Activitatea transcripțională totală în mușchiul soleu nu a fost afectată de post. 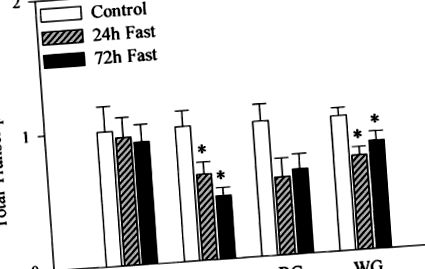
FIG. 2.Activitate transcripțională totală în mușchii scheletici de la șobolani martori și 24 de ore și 72 de ore. Alicote de nuclee izolate din mușchiul soleus (Sol), plantaris (PL) și roșu (RG) și gastrocnemius alb (WG) au fost supuse unei analize nucleare în prezența [32 P] UTP așa cum este descris în materiale și metode . Formarea totală a transcrierii ARN a fost determinată prin spectrometrie de scintilație lichidă, normalizată la conținutul de ADN genomic pentru a ține cont de variațiile conținutului nucleelor și exprimată în raport cu martorii. Valorile sunt medii ± SE. * În mod semnificativ (P
Rata medie de transcripție a genei β-actinei, determinată de analiza nucleară RT-PCR, a scăzut, de asemenea, cu postul la plantari (6,7-14,7%), gastrocnemius roșu (27-32%) și gastrocnemius alb (43- 50%, P
FIG. 3.Analiza nucleară de funcționare a nucleelor izolate de mușchii indicați ai controlului, șobolani 24-h-post și 72-h-post. Se arată imaginea negativă a produselor PCR (colorate cu bromură de etidiu) generate de analiza nucleară bazată pe RT-PCR, reprezentând rata relativă de transcripție a genelor pentru decuplarea proteinei 3 (UCP3), lipaprotein lipazei (LPL), carnitinei musculare palmitoiltransferaza I (CPT I), acil-CoA dehidrogenaza cu lanț lung (LCAD), acil-CoA dehidrogenaza cu lanț mediu (MCAD), hexokinaza II (HKII) și β-actina (β-A). Se arată analiza fiecărei gene pentru un singur set de probe per mușchi.
FIG. 4.Date de cuantificare a modificărilor induse de repaus în rata de transcripție reprezentate în Fig. 3. Un rezumat al imaginii și analiza statistică (n = 9-14 șobolani/grup) a modificărilor ratei de transcripție pentru genele indicate (definite în Fig. 3) în mușchii controlului soleus, PL, RG și WG, 24-h-post și 72-h-post șobolani. Toate datele au fost normalizate la β-actină și au fost exprimate în raport cu controalele (setate la 1,0) ca medie ± SE. Rețineți că, din cauza schimbărilor mari în transcripție, y-axa pentru UCP3 este mai mare decât pentru toate celelalte gene. * În mod semnificativ (P
Odată cu folosirea postului ca provocare metabolică, intenția prezentului studiu a fost de a testa ipoteza că o cerere crescută și/sau furnizarea de acizi grași în mușchiul scheletic declanșează un răspuns adaptiv care include activarea transcripțională coordonată a genelor care codifică pentru proteine necesare transportului și oxidării acizilor grași. În sprijinul acestei ipoteze, rata de transcripție a genelor LPL, CPT I și LCAD a crescut semnificativ cu 1,7 până la 2,0 ori, 2,1 până la 3,0 ori, respectiv, între 1,7 și 3,7 ori, peste 24- 72 h de post (Fig. 4). Nu s-au găsit diferențe între șobolanii cu post de 24 și 72 de ore. În comparație cu LCAD, modificările ratei de transcripție a genei MCAD nu au fost la fel de dramatice sau în concordanță cu activarea semnificativă (de la 2,0 la 2,3 ori) evidentă doar la mușchiul gastrocnemius alb. Postul nu a influențat rata de transcripție a genelor LPL, CPT I, LCAD sau MCAD în mușchiul soleu. Pentru a servi drept comparație pentru genele metabolismului grăsimilor, rata de transcripție a genei hexokinazei II a fost, de asemenea, determinată și s-a constatat că a crescut semnificativ numai după 72 de ore de post în solus (2,0 ori), gastrocnemiu roșu (1,8 ori), și mușchii albi gastrocnemius (de 1,5 ori).
Efectul creșterii cererii metabolice asupra reglării transcripționale în timpul postului.
FIG. 5.Analiza nucleară a nucleelor izolate de mușchii de control indicați, postat 24 h (F) sau postat 24 h + exercitat (FE; 2 × 2 h atacuri de rulare efectuate în cursul primelor 8 ore ) șobolani. Este prezentată imaginea negativă a produselor PCR (colorate cu bromură de etidiu) generate de analiza nucleară bazată pe RT-PCR, reprezentând rata relativă de transcripție a genelor indicate (definite în Fig. 3). Este prezentată analiza fiecărei gene pentru un singur set de probe per mușchi.
FIG. 6.Efectul creșterii cererii metabolice asupra răspunsurilor transcripționale la 24 de ore de post. Un rezumat al imaginii și analizei statistice (n = 6-14 șobolani/grup) reprezentați în Fig. 5 dintre modificările ratei de transcripție pentru genele indicate (definite în Fig. 3) în mușchii soleus, PL, RG și WG de post (24 h) sau post (24 h) + exercitat (2 × 2-h exercițiu de rulare efectuat în timpul inițialelor 8 h) șobolani. Toate datele au fost normalizate la β-actină și au fost exprimate în raport cu controalele (setate la 1,0, datele nu sunt prezentate) ca medii ± SE. Rețineți că, din cauza schimbărilor mari în transcripție,y-axa pentru UCP3 este mai mare decât pentru toate celelalte gene. * În mod semnificativ (P
Scopul principal al prezentului studiu a fost de a testa ipoteza că o provocare metabolică severă a mușchilor scheletici, cum ar fi postul, declanșează un răspuns adaptativ coordonat în reglarea transcripțională a genelor cu roluri critice în metabolismul substratului. Rezultatele prezentului studiu demonstrează că postul induce o creștere coordonată a ratei de transcripție a unui număr de gene înrudite metabolic, în special în mușchiul scheletic cu contracție rapidă. Principalul răspuns a fost o creștere dramatică a ratei de transcripție a genei UCP3 la mușchii plantari, gastrocnemius roșu și gastrocnemius alb în 24 de ore după îndepărtarea alimentelor. Activarea transcripțională a mai multor gene necesare pentru metabolismul lipidelor a avut loc, de asemenea, ca răspuns la post, sugerând un mecanism comun de reglare. În mod surprinzător, totuși, cererea metabolică adăugată impusă de exercițiile fizice efectuate în primele ore după îndepărtarea alimentelor a atenuat activarea transcripțională constatată numai cu 24 de ore de post, sugerând prezența unor mecanisme de reglare opuse.
Mușchiul soleului la șobolani este compus în principal din fibre cu contracție lentă care se bazează puternic pe metabolismul oxidativ. ARNm LPL s-a dovedit a crește cu ~ 50% în mușchiul solei după 1 zi de post (21). În schimb, rata de transcripție a LPL în studiul de față nu s-a modificat la nivelul mușchiului soleu, sugerând că modificările expresiei LPL induse de postul la mușchi compus în principal din fibre oxidative cu contracție lentă pot implica mecanisme de control posttranscripțional.
Pe scurt, rezultatele prezentului studiu demonstrează că postul induce o creștere marcată a transcrierii genei UCP3 și o creștere coordonată a transcrierii mai multor gene necesare pentru metabolismul lipidelor la mușchiul scheletic roșu și alb cu contracție rapidă, reflectând probabil dependența crescută a mușchilor pe metabolismul acizilor grași în timpul foametei. În mod surprinzător, totuși, creșterea cererii metabolice în mușchiul scheletic în primele 8 ore ale unui post de 24 de ore atenuează semnificativ activarea transcripțională a mai multor gene metabolice asociate cu metabolismul lipidic în mușchiul roșu scheletic, crescând posibilitatea ca postul și exercițiile fizice să declanșeze opoziție. mecanisme de reglementare.
Mulțumim doctorilor. Henritte Pilegaard și David Cameron-Smith pentru discuții utile și revizuirea manuscrisului.
NOTĂ DE PICIOASĂ
Această lucrare a fost susținută de un grant de la Centrul de cercetare endocrinologică Yale Diabetes și de către Institutul Național de Artrită și Boli Musculo-scheletice și de Boli AR-45372.
Costurile de publicare a acestui articol au fost suportate parțial prin plata taxelor de pagină. Prin urmare, articolul trebuie marcat prin prezenta „publicitate”În conformitate cu 18 U.S.C. §1734 numai pentru a indica acest fapt.
REFERINȚE
NOTE AUTORULUI
Adresa pentru cereri de reimprimare și alte corespondențe: P. D. Neufer, The John B. Pierce Laboratory, Yale Univ. Școala de Medicină, 290 Congress Ave., New Haven, CT 06519 (E-mail: [email protected] org).
- Antrenamentul fizic cu scăderea în greutate și o dietă cu indice glicemic ridicat sau scăzut reduce metabolismul
- Semnalele de dietă și exerciții fizice reglează SIRT3 și activează AMPK și PGC-1α în mușchiul scheletic
- Fitness și sănătatea ta Beneficiile fizice, mentale și de restaurare ale Institutului de exerciții pentru
- Enhancer Vitamine și minerale Magazin web metabolic
- Discrepanța între aportul caloric auto-raportat și efectiv și exercițiile fizice la subiecții obezi - PubMed
