Alice P. Liou
1 Institutul pentru obezitate, nutriție și metabolism, Spitalul General din Massachusetts, Boston, MA 02114, SUA
Peter J. Turnbaugh
2 FAS Center for Systems Biology, Harvard University, Cambridge, MA 02138, SUA
Abstract
Cercetări recente sugerează că obezitatea poate fi influențată nu numai de factorii de risc dietetici și genetici, ci și de trilioanele de microorganisme care locuiesc în tractul nostru gastro-intestinal. În concordanță cu această noțiune, Cho et al. (2012) folosesc șoareci pentru a demonstra că tratamentul cu antibiotice subterapeutice promovează adipozitatea.
Oamenii și alte mamifere au co-evoluat cu trilioane de microorganisme care prosperă în corpul nostru și în corpul nostru. Interacțiunile gazdă-microbiene care rezultă sunt deseori benefice; cu toate acestea, se consideră că perturbarea acestui echilibru delicat duce la un risc crescut de boală (Dethlefsen și colab., 2007). Eforturile recente au caracterizat pe larg compoziția comunităților microbiene găsite în mai multe habitate corporale (Consortium, 2012), dar abia începem să descoperim consecințele neintenționate ale unui stil de viață occidental asupra partenerilor noștri microbieni (Blaser și Falkow, 2009). În special, antibioticele cu spectru larg administrate oral au un potențial clar de a influența microbii care locuiesc în tractul nostru gastro-intestinal (microbiota intestinală).
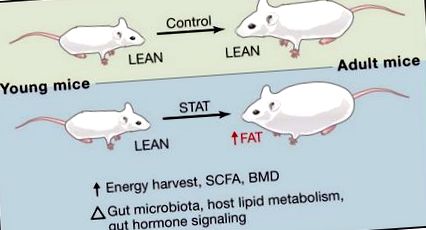
Dar care sunt consecințele funcționale ale utilizării pe scară largă a antibioticelor? O posibilă ramificație este modificarea balanței energiei gazdei. O serie de studii au legat microbiota intestinală de obezitate (Backhed și colab., 2004; Turnbaugh și colab., 2006) și antibiotice cu doze mici au fost folosite de zeci de ani pentru a spori creșterea și eficiența hranei animalelor de fermă (Jukes, 1971) . Mecanismele prin care antibioticele promovează acest fenomen și dacă utilizarea crescândă a antibioticelor la copii contribuie la o predispoziție la obezitate mai târziu în viață sunt în prezent necunoscute. Sunt necesare sisteme de modele tratabile pentru a distruge mulți factori confuzi care pot influența echilibrul energetic al gazdei. Recent, munca depusă de Martin Blaser și colegii săi (Cho et al., 2012) a făcut un prim pas important spre abordarea acestor probleme, expunând șoarecii tineri la diferite tratamente cu doze mici de antibiotice timp de 7 săptămâni, rezultând o adipozitate crescută (Figura 1).
Comparativ cu șoarecii martori, STAT are ca rezultat o greutate corporală totală similară, dar creșterea adipozității, recoltarea energiei alimentare, densitatea minerală osoasă (BMD) și nivelurile de acid gras cu lanț scurt (SCFA). Aceste diferențe fenotipice au fost asociate cu modificări ale comunității microbiene intestinale, metabolismul lipidic al gazdei și semnalizarea hormonului intestinal. Studiile viitoare promit să elucideze baza mecanicistă pentru aceste schimbări.
Răspunsul microbian la tratamentul cu antibiotice subterapeutice (STAT) a fost evident mai degrabă printr-o structură comunitară modificată decât prin abundența totală. O schimbare către un raport Firmicutes crescut cu Bacteroidetes a fost asociată cu o stare obeză (Ley și colab., 2005; Turnbaugh și colab., 2006). În mod surprinzător, această schimbare a fost evidentă după administrarea concomitentă de penicilină și vancomicină, doi compuși care vizează în primul rând gram-pozitivi (adică Firmicutes) și nu după administrarea oricărui antibiotic singur. Chlortetraciclina, un alt antimicrobian care acționează printr-un mecanism diferit, a provocat, de asemenea, această schimbare. Având în vedere diferitele moduri de acțiune și gama acestor antimicrobiene, acest lucru pune sub semnul întrebării modul în care aceste diferite antibiotice afectează comunitatea microbiană și în ce măsură grupurile taxonomice microbiene individuale sau grupurile multiple care lucrează în comun ar putea contribui direct la dezvoltarea adipozității.
Interesant este că, spre deosebire de ceea ce se vede la animale, STAT a avut un efect minim asupra greutății corporale globale și a eficienței hranei la șoareci. Autorii au raportat o rată de creștere accelerată în prima săptămână a STAT și o creștere a densității minerale osoase după 3 săptămâni. Este posibil ca această creștere inițială accelerată spre maturitate să fie suficientă pentru a promova depunerea grăsimilor.
Această lucrare ridică multe întrebări cu privire la potențialele legături dintre expunerea la antibiotice și adipozitate. Având în vedere că utilizarea antibioticelor are un efect mai mare asupra creșterii la animalele tinere decât la animalele mature (Jukes, 1971), în ce măsură efectul STAT depinde de vârsta șoarecilor? Este acest fenomen unic vieții timpurii? Cât de mult, dacă este deloc, efectul depinde de antibioticele specifice utilizate și de proporțiile lor relative? Influențează antibioticele echilibrul energetic al gazdei prin efecte directe asupra gazdei sau fenotipurile observate depind în totalitate de microbiota intestinală? În ce măsură prevalența și transferul orizontal al genelor de rezistență la antibiotice influențează creșterea adipozității? Cât de dependente sunt aceste efecte de alți factori despre care se știe că influențează microbiota intestinală și echilibrul energetic al gazdei; de exemplu, consumul unei diete „occidentale” bogate în grăsimi/cu conținut ridicat de zahăr ar exacerba efectele STAT? De asemenea, în timp ce o mare parte din atenția dedicată rolului microbiotei în reglarea metabolismului gazdei se concentrează pe creșterea recoltei energetice dietetice, ce impact ar putea avea microbiota pe cealaltă parte a ecuației bilanțului energetic? Există vreun efect al microbiotei intestinale asupra cheltuielilor de energie?
Poate cel mai important, această lucrare oferă un model animal tractabil pentru a investiga aceste întrebări, precum și multe alte întrebări arzătoare cu privire la consecințele energetice ale perturbărilor asupra microbiotei intestinale. De remarcat, un alt studiu recent realizat de Blaser și colegii săi susține relevanța acestor descoperiri pentru oameni: sugarii expuși la antibiotice în primele 6 luni de viață au crescut masa corporală mai târziu în viață (Trasande și colab., 2012). Împreună, aceste rezultate subliniază o viziune asupra metabolismului uman ca un compozit al genomului nostru uman și microbian și nevoia critică pentru o mai bună înțelegere a modului în care aceste interacțiuni gazdă-microbiană contribuie la sănătate și boli în prezența sau absența unei game largi de terapie administrată oral.
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Cele mai bune 10 shake-uri bogate în calorii pentru creșterea în greutate sănătate perfectă
- 5 obiceiuri zilnice pentru a câștiga în greutate în mod natural într-o lună Revista CEO - India
- Caloriile arse în treburile casnice plictisitoare pot ajuta la combaterea creșterii în greutate la domiciliu - Washingtonul
- Cele mai bune suplimente pentru scăderea în greutate - capsule de 5p pe zi pentru a preveni creșterea în greutate - Business Telegraph
- 5 trucuri cu privire la modul de numărare a caloriilor pentru a pierde (sau a crește) în greutate