Termeni asociați:
- Levotiroxină
- Liotironină
- Hormonul tiroidian
- Tiroglobulina
- Boala tiroidiană
- Determinarea hormonilor
- Tiroidita
- Hipotiroidism
- Tirotropina
Descărcați în format PDF
Despre această pagină
Volumul II
Extract de tiroidă animală
Extractul tiroidian desecat (DTE), deși eficient, nu mai este recomandat de ghiduri, având în vedere disponibilitatea largă a levotiroxinei sintetice. 118 După ingestia de tiroidă deshidratată, pot apărea niveluri serice ușor crescute de T3 asociate cu simptome tirotoxice tranzitorii, cum ar fi palpitații; acest lucru nu se observă după levotiroxină. Un studiu recent care a comparat DTE (tiroida Armor, fiecare bob de 65 mg conținând 38 mcg L-T4 și 9 mcg L-T3) și levotiroxina a raportat o pierdere modestă în greutate și o preferință mai mare a pacientului pentru DTE față de levotiroxină; T3 seric a fost mai mare și FT4 a fost mai scăzut în timpul DTE decât în timpul tratamentului cu levotiroxină. 153 Unii pacienți preferă utilizarea tiroidei desicate și acest lucru poate fi acceptabil atât timp cât nivelurile de TSH sunt normale.
Utilizarea retinoizilor pentru creșterea absorbției de iod radioactiv în cancerul tiroidian
Wendy Ella, Susan Short, în Comprehensive Handbook of Iodine, 2009
Captarea iodului de către celulele tiroidiene
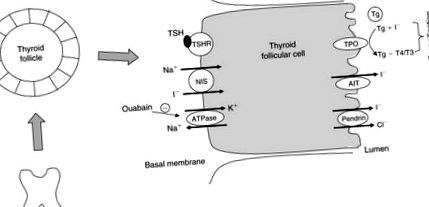
Glanda tiroidă extrage iod din circulație și conține până la 90% din iodul total al corpului. Acumularea de iod din fluxul sanguin în foliculii tiroidieni este mediată de o moleculă transportoare transmembranară numită iportură de sodiu simporter (NIS) (Dai și colab., 1996). Este o glicoproteină legată de membrană cu 13 domenii transmembranare și este exprimată pe membrana basolaterală a celulelor foliculare tiroidiene.
În tiroida normală, NIS transportă două Na + și unul I - în jos gradientul ionic Na + generat de activitatea Na +/K + enzimă adenozin trifosfatază (ATPază) (Figura 102.2). Dacă ATPaza este blocată cu ouabain, absorbția de iod tiroidian este, de asemenea, blocată.
Figura 102.2. Moleculele implicate în iodură (I -) se transportă prin celula foliculului tiroidian. TSH, hormon stimulator al tiroidei; TSHR, receptor TSH; NIS, simportor de iodură de sodiu; TPO, enzima peroxidazei tiroidiene; AIT, transportor de iodură apical; Tg, tiroglobulină.
Iodura din celulele apicale este eliberată în lumenul folicular prin intermediul unui transportor de iodură apical (Rodriguez și colab., 2002) și pendrin, produsul genei sindromului Pendreds (Royaux și colab., 2000; Yoshida și colab., 2004). Iodul este apoi transferat pe tiroglobulină (Tg), care se află la nivelul membranei apicale în afara celulelor foliculare și suferă iodarea reziduurilor de tirozină internă catalizate de peroxidazele tiroidiene (TPO). TSH reglează în sus expresia genelor legate de procesarea iodurii și sintezei hormonale în tiroidă, inclusiv NIS, Tg și TPO (Dunn și Dunn, 2001).
Tratamentul cancerului tiroidian diferențiat cu radioiod se bazează pe capacitatea celulelor maligne de a acumula iod în același mod ca celulele epiteliale tiroidiene normale.
Radioiodura este administrată ca preparat oral și absorbită din stomac și intestinul subțire. Apoi, este concentrat în țesuturi prin funcția NIS și combinat cu Tg, prelungind timpul de înjumătățire biologic al radioiodului. Izotopii cu energie ridicată cu o perioadă de înjumătățire lungă, cum ar fi I-131, sunt utilizați terapeutic pentru a distruge țesutul tiroidian atât în hipertiroidism, cât și în cancerul tiroidian metastatic după tiroidectomie.
Tratamentul cu iod radioactiv poate distruge microcarcinomul ocult și poate reduce rata de progresie a tumorii metastatice (Hershman și colab., 1995; Schlumberger, 1998). Este evident că eficacitatea tratamentului cu iod radioactiv depinde de maximizarea absorbției de iod radioactiv și de prelungirea perioadei de timp în care persistă în țesutul tiroidian.
Absorbția de iod după stimularea cu TSH este suficientă în majoritatea cancerelor tiroidiene diferențiate pentru a utiliza iod radioactiv care emite β pentru tratamentul bolilor reziduale și metastatice. TSH seric crescut (care poate fi atins prin retragerea hormonilor tiroidieni după tiroidectomie sau administrarea de TSH uman recombinant) stimulează direct expresia genei NIS și transportul și inserția NIS în membrana plasmatică, crescând absorbția de iod radioactiv. Mai mult de 70% cancerele tiroidiene diferențiate concentrează radioiodul după stimularea TSH. Restul de 10-20% din cancerele tiroidiene diferențiate nu exprimă NIS în ciuda stimulării TSH, care este asociată cu un prognostic slab (Robbins și colab., 1991; Schmutzler și Koehrle, 2000).
Expresia NIS în tumorile tiroidiene se corelează cu capacitatea lor de a concentra radioiodul. Schmutzler și colab. (1997) au raportat că expresia reglată în jos a genei NIS a dus la rezistență la terapia I-131, deoarece a redus absorbția de iodură în celulele canceroase tiroidiene. Reglarea expresiei NIS în celulele tiroidiene normale și maligne a fost investigată pe larg și au fost recunoscuți diferiți agenți care influențează expresia.
Șobolanul și NIS uman au fost clonate și caracterizate în 1996. Una dintre abordările pentru creșterea expresiei NIS este transferul de gene. Multe studii au investigat efectul transferului NIS asupra terapiei cu iod radioactiv (Lee și colab., 2004; Spitzweg și colab., 2003) și s-a demonstrat că transfecția NIS printr-un vector viral induce captarea iodurii în mai multe linii de celule tumorale non-tiroidiene umane și xenogrefe, inclusiv glioame, cancer de prostată, cancer ovarian și cancer de colon (Mandell și colab., 1999; Cho și colab., 2000).
O abordare alternativă investigată în studii recente este de a induce expresia NIS în cancerul tiroidian agresiv prin administrarea de agenți de diferențiere, inclusiv liganzi ai receptorilor nucleari și inhibitori ai modificărilor epigenetice. O gamă largă de agenți de diferențiere au fost utilizați pentru a stimula expresia NIS atât în modele in vitro, cât și in vivo, iar câțiva au fost utilizați în studii clinice. Retinoizii sunt un astfel de grup de agenți de diferențiere care au fost investigați pe larg.
Hormoni tiroidieni
Kiyoshi Yamauchi, în Manualul hormonilor, 2016
Istorie
În 1895, Adolf Magnus-Levy a constatat că hrănirea extractului de glandă tiroidă la pacienți a crescut rata metabolică a acestora [1]. Compusul activ a fost izolat din glandele tiroide de către Edward Calvin Kendall în 1914 și a fost numit tiroxină (T4) [2]. T4 a fost sintetizat în 1927. Mai târziu, 3,3 ′, 5-triiodotironină (T3), care este fiziologic mai activă decât T4, a fost izolată din plasmă. În 1966, sa descoperit că T3 stimulează activitatea ARN-polimerazei ADN-dependentă. ADNc-urile receptorilor de hormoni tiroidieni nucleari (TR) au fost clonate în 1986. Tironaminele, metaboliții decarboxilați și deiodinați ai hormonilor tiroidieni (THs), s-au dovedit a fi potențiali liganzi pentru un receptor 1 asociat aminei (TAAR1), o nouă clasă de G receptori cuplați cu proteine (GPCR), în 2004 [3]. Un receptor de membrană plasmatică pentru THs a fost identificat ca fiind pe integrina αvβ3 în 2005 [4] .
Hipotiroidism
Înlocuirea tiroidei porcine deshidratate
Hormonul tiroidian porcin (de exemplu, Armor, Nature-Throid, Westhroid) este un medicament mai vechi utilizat în hipotiroidism considerat de unii din comunitatea medicală ca fiind învechit și de alții ca la fel de eficient sau superior hormonilor sintetici. Tiroida porcină deshidratată conține aproximativ 20% T3 și 80% T4, precum și alți compuși iodați, diiodotirozina (T2) și monoiodotirozina (T1), care pot juca un rol în ameliorarea suplimentară a simptomelor. Ca și în cazul omologilor săi sintetici T4 și T3, monitorizarea atentă a simptomelor și regimul testelor funcției tiroidiene sunt importante atunci când aveți grijă de un pacient care a prescris înlocuirea tiroidei porcine. Dozele recomandate de hormoni tiroidieni sunt prezentate în Tabelul 33-4. 2, 55, 56, 58, 59
1 cereale (60 mg) tiroidă porcină deshidratată = 100 mcg tiroxină (T4) și 25 mcg triiodotironină (T3).
- Transferul învățării - o prezentare generală a subiectelor ScienceDirect
- Analiza termogravimetrică - o prezentare generală a subiectelor ScienceDirect
- Yohimbina - o prezentare generală a subiectelor ScienceDirect
- Concentratul de proteine din zer - o prezentare generală Subiecte ScienceDirect
- Woodlouse - o prezentare generală Subiecte ScienceDirect