Nathalia da Costa Pereira Soares
1 Program de absolvire a științei Alimentos, Institutul de Chimie, Universitatea Federală din Rio de Janeiro
Clara Lima Machado
2 Centrul de biochimie nutrițională, Laboratorul de alimente funcționale și biotehnologie, Universitatea Federală a Statului Rio de Janeiro
Bruno Boquimpani Trindade
2 Centrul de biochimie nutrițională, Laboratorul de alimente funcționale și biotehnologie, Universitatea Federală a Statului Rio de Janeiro
Ingridy Celestino do Canto Lima
3 Fundação Centro Universitário Estadual da Zona Oeste, Rio de Janeiro, Brazilia
4 Programul de biologie celulară, coordonarea Pesquisa, Institutul Național al Cancerului José Alencar Gomes da Silva, Rio de Janeiro, Brazilia
Etel Rodrigues Pereira Gimba
4 Programul de biologie celulară, coordonarea Pesquisa, Institutul Național al Cancerului José Alencar Gomes da Silva, Rio de Janeiro, Brazilia
5 Institutul de Umanități și Sănătate, Departamentul de Științe Naturale, Universidade Federal Fluminense, Rio de Janeiro, Brazilia
Anderson Junger Teodoro
2 Centrul de biochimie nutrițională, Laboratorul de alimente funcționale și biotehnologie, Universitatea Federală a Statului Rio de Janeiro
Christina Takiya
6 Institutul de Biofizică Carlos Chagas Filho, Universitatea Federală din Rio de Janeiro
Radovan Borojevic
7 Centrul de Medicină Regenerativă, Facultatea de Medicină din Petrópolis - FASE, Rio de Janeiro, Brazilia
Abstract
Introducere
Dovezile epidemiologice indică faptul că consumul ridicat de fructe și legume reduce riscul patologiilor cronice, cum ar fi cancerul și bolile cardiovasculare (Rissanen și colab., 2003; Jian și colab., 2005). De exemplu, consumul a patru sau cinci porții de produse din roșii pe săptămână a fost asociat cu un risc cu 40% mai mic de cancer de prostată în S.U.A. bărbați (Giovannucci și colab., 1995). Cei mai abundenți fitonutrienți din roșii sunt carotenoizii, licopenul fiind cel mai proeminent. Mecanismele prin care licopenul reduce riscul de cancer de prostată sunt încă neclare. S-a demonstrat că licopenul inhibă proliferarea în mai multe linii celulare tumorale (Chen și colab., 2001). Cu toate acestea, absorbția slabă a carotenoizilor de către rozătoarele de laborator a împiedicat sever utilizarea modelelor animale în studiile de prevenire a cancerului pentru a evalua eficacitatea și mecanismul de acțiune al licopenului (Lee și colab., 1999).
Mai mult de 80% din aportul licopen dietetic (un carotenoid fără activitate de provitamină A) provine din consumul de produse din roșii, inclusiv roșii crude, suc de roșii și sosuri de roșii (USDA, 2003). Numeroase studii au demonstrat o asociere inversă între aportul de licopen din dietă și riscul de cancer de prostată (Mills și colab., 1989; Giovannucci și colab., 2002). În special, consumul mai mare de produse din roșii, aportul estimat de licopen din dietă și concentrațiile circulante de licopen sunt invers asociate cu riscul de cancer de prostată în mai multe studii de cohortă umană (Wan și colab., 2014). Studiile de laborator au furnizat dovezi că roșiile și licopenul pot suprima leziunile oxidative, pot modula semnalizarea intracelulară, rezultând o proliferare redusă și pot spori sensibilitatea la apoptoză, printre alte mecanisme (Tan și colab., 2010). Unele rapoarte au fost sugerate că aportul de roșii sau licopen poate modula producția de testosteron, concentrațiile serice și metabolismul și poate avea un impact asupra expresiei genelor în celulele canceroase de prostată umane.
În special, licopenul gătit sau consumat în mediu uleios, cum ar fi pasta de roșii, sosul de roșii sau pizza, par a fi optime pentru absorbția eficientă a licopenului (Kirsh și colab., 2006). Prin urmare, eficacitatea sa biologică poate varia în funcție de sursa specifică de hrană și de metoda de preparare. Pentru a înțelege mai bine cum licopenul poate reduce riscul de cancer de prostată, în acest studiu am evaluat efectele putative ale a 4 tipuri de produse alimentare pe bază de roșii asupra comportamentului celulelor cancerului de prostată (PCa), în special asupra modulării viabilității celulare și a apoptozei.
Materiale și metode
Reactivi de cultură celulară
Mediul de cultură celulară Dulbecco (DMEM) și albumina serică bovină au fost obținute de la Sigma, iar serul bovin fetal (FBS) de la Laborclin (São Paulo, Brazilia). Flacoane de cultură celulară și răzuitoare de celule au fost obținute de la Nunc (Roskilde, Danemarca). Toate substanțele chimice au fost de calitate analitică.
Probe și extracție de licopen
Ketchup, sos de roșii, extract de roșii și pastă de roșii au fost cumpărate la supermarketul local (Rio de Janeiro, Brazilia). Extractele de licopen au fost obținute folosind etanol ca solvent (Nunes și Mercadante, 2004). Licopenul a fost identificat și cuantificat prin cromatografie lichidă de înaltă performanță. Extractele de licopen descrise mai sus au fost supuse procesului de liofilizare. Materialul obținut din acest proces a fost măcinat pentru a obține o „făină” și depozitat în sticle de chihlimbar la -18 ° C până la procedurile de testare în culturi de celule primare PCa.
Izolarea și caracterizarea culturilor de celule primare
Celulele PCa au fost obținute din fragmente de țesuturi de prostată obținute din cazuri de cancer supuse prostatectomiei radicale. Participanții și-au dat consimțământul scris pentru a participa la acest studiu după semnarea în Termenul de consimțământ stabilit. Procedurile au fost aprobate de Comitetul de Etică al Spitalului Universitar Clementino Fraga Filho, Universitatea Federală din Rio de Janeiro, Protocol-CAAE0029.0.197.000-05.
Experimente de cultură celulară
Celulele PCa primare au fost placate în baloane de cultură celulară de 25 cm2 la o densitate de 1,0 × 106 celule/balon și menținute în DMEM suplimentat cu 10% ser fetal bovin (FBS) și 2 g/L tampon HEPES, pH 7,4, sub un 5 % Atmosferă de CO2. Pasajele celulare s-au făcut de două ori pe săptămână și s-au efectuat prin tripsinizare la atingerea 70-80% din confluență. Pentru fiecare experiment, celulele PCa primare au fost însămânțate la o densitate de 104 celule/cm2 în plăci cu 6 și 96 de puțuri pentru analize de apoptoză și, respectiv, de viabilitate celulară. Extractele de licopen testate anterior pentru solubilitatea produselor în apă și concentrația finală obținută a fost de 5 mg/ml. Extractele de licopen din diferitele produse alimentare pe bază de roșii au fost apoi adăugate pe farfurii. Celulele netratate (controale) au fost incluse pe fiecare placă. Celulele au fost apoi incubate timp de 96 de ore cu înlocuire medie zilnică.
Analize de viabilitate celulară
Starea viabilității liniei celulare canceroase a fost determinată prin testul MTT (3- [4,5-dimetiltiazol-2-il] -2,5-difeniltetrazolium bromură; albastru tiazolil) (Sigma, New York, SUA) așa cum a fost descris pentru prima dată de Mosmann (1983). Rata de inhibare a proliferării celulare (CPIR) a fost calculată utilizând următoarea formulă: CPIR = (1 - valoarea medie a absorbanței grupului experimental/valoarea medie a absorbanței grupului martor) × 100%.
Testele de apoptoză
Celulele au fost resuspendate în 400 μL de tampon de legare conținând 5 μL de anexină V FITC și 5 μL de iodură de propidiu (Kit de detectare a apoptozei II, BDBiosciences) timp de 15 minute la temperatura camerei. Legarea anexinei V a fost evaluată prin citometrie în flux (FACScalibur, BD Biosciences) și, după achiziționarea a 20.000 de evenimente, datele au fost analizate în software-ul Cell Quest.
PCR cantitativ în timp real
ARN-ul total din celulele PCa a fost extras folosind RNeasy Mini Kit (Qiagen), conform instrucțiunilor producătorului. Randamentul și calitatea ARN au fost determinate de un spectrofotometru NanoDrop ND-1000 V3.2 (Nanodrop Technologies, Wilmington, DE). Cantități egale (1 μg) de ARN din celule au fost transcrise invers folosind kitul de sinteză ADNc „Sistemul de sinteză First-Strand Superscript II pentru RT-PCR” (Invitrogen) și primerul Oligo (dT) (Invitrogen). ADNc a fost utilizat ca șablon pentru reacția în lanț a polimerazei în timp real ulterioară (RT-PCR). PCR cantitativă în timp real a fost efectuată într-un cicler termic CFX96 Real Time System (BIORAD) C1000 utilizând sisteme SYBRGreen (Applied Biosystems, Grand Island, NY) urmând instrucțiunile producătorului. Transcrierea nivelurilor de expresie TP53 și Bcl-2 a fost normalizată utilizând GAPDH ca genă constitutivă. Următorii primeri au fost utilizați în testele PCR în timp real pentru aceste gene: TP53 (înainte: 5'TAACAGTTCCTGCATGGGCGGC-3 '); invers: 5'AGGACAGGCACAAACACGCACC-3'), Bcl-2 (înainte: 5'-CTGCACCTGACGCCCTTCC;
5’-CACATGACCCCACCGAACTCAAAGA-3 ’) și GAPDH
invers: 5’GGTGTCGCTGTTGAAGTCAGAG-3 ’). Pentru a evalua calitatea produselor RT-PCR, s-au efectuat analize ale curbei de topire după fiecare test. Expresia relativă a fost determinată folosind metoda ∆∆CT.
analize statistice
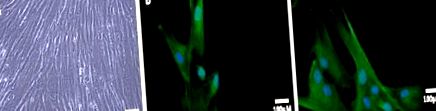
Datele prezentate sunt valori medii ± eroare standard a trei experimente independente făcute în duplicat (n = 6). Comparațiile statistice au fost efectuate prin analiza varianței și testul post hoc al lui Tukey folosind programul Graph Pad Prism 5.0 și Statistical 6.0. Diferențele au fost considerate semnificative atunci când P Figura 1A). Aceste celule au fost caracterizate prin expresia citokeratinei 5 (CK5), un marker al celulelor proliferante bazale din epiteliul prostatei (Figura 1B). Au fost, de asemenea, pozitivi pentru racemaza alfa-metilacil CoA (Figura 1C), care este considerat a fi un marker util pentru transformarea neoplazică în prostată (Iwasa și colab., 2007).
Caracterizarea celulelor stabilite PCa primare. Micrografie cu contrast de fază a celulelor izolate de cancer de prostată primare (A). Celulele PCa primare au fost colorate pentru CK5 (B) și racemază (C). Nucleii celulari au fost colorați cu DAPI
Conținutul total de licopen din produsele alimentare pe bază de roșii
Figura 2 arată conținutul total de licopen în produsele pe bază de roșii. Rezultatele au arătat că conținutul mediu de licopen din pasta de roșii a fost de 75,00 μg/g, 160,36 μg/g în sos de roșii, 141,71 μg/g în ketchup și 80,99 μg/g în extract de roșii. Conținutul total de licopen a fost statistic diferit între probele de extract de roșii, ketchup și sos de roșii. Cu toate acestea, conținutul total de licopen obținut pentru pasta de roșii nu a fost statistic diferit de valorile prezentate de extractul de roșii. Potrivit lui Barber and Barber (2002) și Waliszewski și Blasco (2010), deși ketchup-ul are concentrații mari de licopen, atunci când este evaluat raportul total de carotenoizi față de izomerii cis-licopen, extractul de roșii are un raport mai mic și, prin urmare, un conținut mai mare de izomeri de cis-licopen.
Efectul pastei de tomate, a extractului de roșii, a sosului de roșii și a ketchupului asupra viabilității celulei PCa după expunerea de 96 H. Rezultatele sunt exprimate ca mijloace ± eroare standard. Diferențe semnificative între celulele netratate (martor) și cele tratate cu extracte de roșii (5 mg/ml) au fost comparate prin testul post-hoc al comparației multiple a lui Tukey. *: Semnificativ vs. control la P Tabelul 1 și Figura 4), odată ce modificările echilibrului dintre proliferare și apoptoză sunt asociate cu cancerul. Am evaluat efectul licopenului din toate cele 4 produse pe bază de roșii, după 96 de ore de incubație pe diferite etape ale morții celulare în celulele PCa. Tabelul 1 arată procentul de celule viabile, apoptotice timpurii, apoptotice tardive și necrotice tratate cu pastă de roșii, extract de roșii, sos de roșii și ketchup (5 mg/mL). Licopenul obținut din pasta de roșii, extracte de roșii și sos de roșii a promovat în mod semnificativ apoptoza în celulele PCa, cu o creștere medie de 51,07 ori mai mare a ratelor apoptotice (apoptoza timpurie mai târzie), comparativ cu martorul (celule netratate). În timp ce licopenul din pasta de roșii a promovat o creștere de 40,7 ori a ratelor apoptotice (apoptoza timpurie mai târzie), ketchupul a avut cel mai scăzut răspuns obținut în stadiul apoptozei târzii.
tabelul 1
Efectul produselor pe bază de tomate asupra etapelor procesului de moarte celulară în celulele PCa primare după 96 ore de tratament.
| PCa | Celule viabile | 96,1 ± 0,8 a | 44,2 ± 2,2 b | 40,1 ± 2,3 b | 40,2 ± 2,1 b | 76,9 ± 0,9 c |
| Apoptoza precoce | 0,8 ± 0,2 a | 13,2 ± 1,7 b | 9,02 ± 0,3 c | 6,9 ± 0,4 zile | 2,9 ± 0,3 e | |
| Apoptoza tardivă | 0,7 ± 0,02 a | 40,7 ± 0,4 b | 49,7 ± 1,7 | 52,4 ± 1,6 c | 19,1 ± 0,5 d | |
| Celule necrotice | 3,2 ± 0,1 a | 1,8 ± 0,1 b | 1,4 ± 0,3 b | 0,7 ± 0,1 c | 1,1 ± 0,2 zile |
- Cum ar trebui să comercializez produse alimentare și nutriționale sănătoase Agenția pentru relații cu mass-media
- Mancarea nedorita nu este singurul inamic in lupta impotriva obezitatii - sunt produsele care pretind a fi
- Mâncare de pisică de casă 5 rețete și sfaturi despre alimentele umane pe care le puteți împărtăși
- Rezultatele învățării Departamentul de Știința Alimentelor și Nutriția Umană Iowa State University
- Cum mâncați prea multe calorii din orice mâncare vă face să vă îngrășați; Performanță umană completă