Abstract
Introducere
Rezistența la insulină este cea mai strâns asociată cu obezitatea viscerală (Kissebah, 1997; Jensen, 2006). Dovezile din studiile efectuate la oameni și animale indică faptul că obezitatea datorată hipertrofiei adipocitelor are ca rezultat rezistența la insulină și diabet, în timp ce restaurarea nivelurilor normale de țesut adipos atenuează rezistența la insulină prezentă în obezitate (Spiegelmanand Flier, 1996; Murphy și colab., 1997; Wickelgren, 1998 Brunzell și Hokanson, 1999). Adipocitele hipertrofice cresc TNFα, leptina și acizii grași liberi circulanți, care au fost implicați în dezvoltarea rezistenței la insulină (Hotamisligil și colab., 1993; Taylor și colab., 1996; Boden, 1997; Okuno și colab., 1998). Astfel, conversia adipocitelor hipertrofice în adipocite mici pare să joace un rol important atât în atenuarea rezistenței la insulină, cât și a diabetului (Okuno și colab., 1998; de Souza și colab., 2001).
Fibrații acționează ca agoniști ai receptorilor activi ai proliferatorului peroxizom nuclear (PPARα) care reglează expresia genelor critice pentru metabolismul lipidelor și lipoproteinelor (Schoonjans și colab., 1996; Staels și colab., 1998; Kliewer și colab., 1999). S-a demonstrat că fibratul reglează obezitatea la rozătoare prin creșterea oxidării hepatice a acizilor grași și scăderea nivelurilor de trigliceride circulante responsabile de hipertrofia și hiperplazia celulelor adipoase (Yoon și colab., 2002, 2003; Jeong și colab., 2004a, b), sugerând că PPARα este implicat în controlul rezistenței la insulină cauzată de obezitate. Cu toate acestea, studiile au arătat că îmbunătățirea semnalizării insulinei prin activarea PPARα se datorează în mare măsură scăderii lipidelor ectopice în țesutul neadipos.
Deși PPARα joacă un rol important în oxidarea acizilor grași în ficat și mușchiul scheletal, se raportează că activatorii PPARα pot afecta metabolismul țesutului adipos. De exemplu, administrarea de bezafibrat, un activator tipic PPAR, duce la diferențierea adipocitelor în celule asemănătoare preadipocitelor prin activarea genelor implicate atât în β-oxidarea mitocondrială, cât și în cea peroxizomală (Cabrero și colab., 2001; Vázquez și colab., 2001 ); ligandul PPARα GI259578A scade dimensiunea medie a adipocitelor în țesutul adipos alb (Okamoto și colab., 2007). În consecință, presupunem că activarea PPARα adiposă prin fenofibrat poate inhiba hipertrofia adipocitelor, rezultând o ameliorare a rezistenței la insulină.
Prin urmare, obiectivele prezentului studiu au fost 1) de a determina dacă fenofibratul activează expresia adipoasă a genelor țintă PPARα implicate în β-oxidarea acidului gras și 2) de a examina efectele ulterioare ale fenofibratului asupra dimensiunii adipocitelor și a sensibilității la insulină. Datele noastre au demonstrat că tratamentul cu fenofibrat a crescut expresia ARNm a enzimelor responsabile de β-oxidarea acidului gras în țesutul adipos visceral, ducând la o reducere a dimensiunii adipocitelor și la ameliorarea rezistenței la insulină.
Rezultate
Reglarea greutății corporale, a grăsimii viscerale și a dimensiunii adipocitelor prin fenofibrat
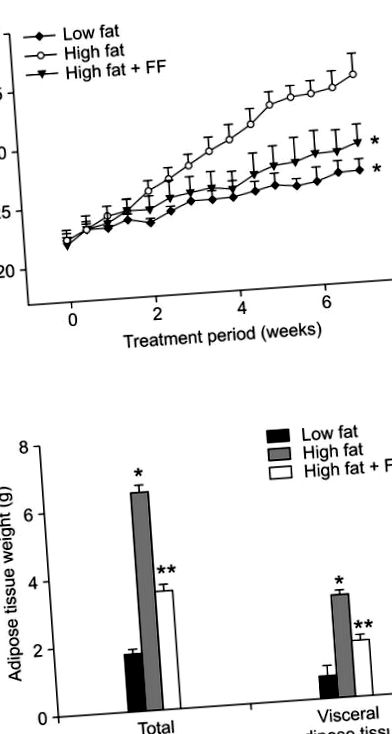
Tratamentul cu fenofibrați a împiedicat creșterea greutății corporale indusă de dieta bogată în grăsimi (Figura 1A). Atât greutățile totale, cât și cele viscerale ale țesutului adipos au fost, de asemenea, reduse la șoareci, cărora li s-a administrat o dietă bogată în grăsimi suplimentată cu fenofibrat, în comparație cu șoarecii care au primit o dietă bogată în grăsimi (Figura 1B). Analiza histologică a arătat că fenofibratul a provocat o scădere cu 43% a dimensiunii adipocitelor în țesutul adipos epididimal la șoarecii hrăniți cu fenofibrat, cu conținut ridicat de grăsimi, față de șoarecii hrăniți cu o dietă bogată în grăsimi (Figura 2A). Dimensiunea medie a adipocitelor la șoarecii obezi hrăniți cu diete bogate în grăsimi a fost de 5.505 ± 354 µm 2, în timp ce dimensiunea adipocitelor a fost de 3.135 ± 182 µm 2 la șoarecii obezi tratați cu fenofibrat (Figura 2B). Numărul de adipocite într-o zonă fixă a fost crescut cu 75% la șoarecii obezi tratați cu fenofibrat comparativ cu șoarecii hrăniți cu obezitate alimentată cu grăsimi ridicate (Figura 2C), sugerând că fenofibratul a determinat o creștere a adipocitelor mici și o scădere a adipocitelor mari în epididim. țesutul adipos al șoarecilor obezi. În ceea ce privește semnificația fiziologică a acestor modificări, moleculele care sunt fie generate, fie secretate de adipocite hipertrofice au fost implicate în dezvoltarea rezistenței la insulină (Hotamisligil și colab., 1993; Taylor și colab., 1996). Astfel, fenofibratul poate atenua rezistența la insulină, cel puțin parțial, datorită capacității sale de a reduce dimensiunea adipocitelor.
Exprimarea genelor țintă PPARα implicate în β-oxidarea acidului gras în țesutul adipos visceral și adipocite diferențiate 3T3-L1
Pentru a determina dacă reducerea dimensiunii adipocitelor poate fi indusă de acțiunile PPARα mediate de fenofibrat în țesutul adipos, am măsurat nivelurile de ARNm ale enzimelor țintă PPARα responsabile de β-oxidarea peroxizomală și mitocondrială a acidului gras β în țesutul adipos visceral al șoarecilor obezi și adipocitelor de șoarece culturi. Șoarecii hrăniți cu diete bogate în grăsimi, tratați cu fenofibrat, au prezentat niveluri substanțial mai mari de ARNm de enzime pentru β-oxidarea acidului gras în țesutul adipos epididimal [de exemplu, acil-CoA oxidază (ACOX), enoil-CoA hidratază/3-hidroxiacil-CoA dehidrogenază (HD) și acil-CoA dehidrogenază cu lanț mediu (MCAD) cu 186%, 145% și, respectiv, 20%] comparativ cu șoarecii hrăniți cu diete bogate în grăsimi (Figura 3). În mod similar, tratamentul cu puternicul ligand PPARα, Wy14.643, a crescut expresia ARNm a ACOX, HD și MCAD cu 50%, 18% și, respectiv, 11%, în celule 3T3-L1 diferențiate (Figura 4). Aceste rezultate sugerează că fenofibratul poate reduce dimensiunea adipocitelor, parțial, prin activarea PPARα adiposă.
Exprimarea genelor markerului adipos
Deoarece rozătoarele obeze, rezistente la insulină, cu adipocite hipertrofice sunt cunoscute pentru supraexprimarea genelor markerului adipocitelor, cum ar fi PPARγ, proteina adipocitelor care leagă acidul gras, leptina și TNFα (Brun și colab., 1997; Okuno și colab., 1998), noi au testat efectele fenofibratului asupra expresiei leptinei și TNFα mARN în țesutul adipos epididimal. În concordanță cu efectele fenofibratului asupra dimensiunii adipocitelor, tratamentul cu fenofibrat a scăzut semnificativ nivelurile de ARNm de leptină și TNFα cu 19% și, respectiv, 26%, comparativ cu cele din grupul care a primit doar o dietă bogată în grăsimi (Figura 5).
Niveluri circulante de lipide, glucoză și insulină
Nivelurile de acid gras și trigliceride fără ser au fost mai mari cu 24% și, respectiv, 91%, în grupul cu dietă bogată în grăsimi, comparativ cu grupul de control cu dietă cu conținut scăzut de grăsimi (Tabelul 1). Cu toate acestea, nivelurile de acizi grași fără ser au scăzut cu 12%, iar nivelurile plasmatice ale trigliceridelor au scăzut cu 35% la șoarecii tratați cu fenofibrat comparativ cu cei de la șoarecii hrăniți cu diete bogate în grăsimi. Fenofibratul a provocat, de asemenea, o scădere atât a nivelului de insulină plasmatică, cât și a nivelului de glucoză cu 58% și, respectiv, 42% la animalele hrănite cu diete bogate în grăsimi, îmbunătățind astfel rezistența la insulină la șoarecii obezi.
Test de toleranță intraperitoneală la glucoză
Efectele fenofibratului asupra modificărilor nivelurilor de glucoză din sânge au fost măsurate în timpul testului de toleranță la glucoză intraperitoneală la șoarecii alimentați cu diete bogate în grăsimi. După șapte săptămâni de tratament cu fenofibrat, șoarecii au prezentat reduceri semnificative ale concentrațiilor de glucoză din sânge după administrarea intraperitoneală de glucoză, comparativ cu șoarecii martori obezi (Figura 6). Aceste rezultate indică faptul că fenofibratul poate îmbunătăți toleranța la glucoză la șoarecii cu obezitate indusă de dietă.
Discuţie
Acumularea de grăsime viscerală datorată hipertrofiei adipocitelor induce modificări în producția și secreția de adipokine, cum ar fi adiponectina, visfatina, leptina și TNFα, implicate în dezvoltarea rezistenței la insulină (Ahima, 2006; Bulcao și colab., 2006; Matsuzawa, 2006 ). Leptina și TNFα sunt supraexprimate în țesuturile adipoase ale rozătoarelor obeze, rezistente la insulină, care au adipocite hipertrofice (Hotamisligil și colab., 1993; Maffei și colab., 1995; Okuno și colab., 1998; Kralisch și colab., 2007) . Deoarece s-a raportat că leptina și TNFα sunt cel puțin parțial responsabile de rezistența la insulină cauzată de obezitate (Hotamisligil și colab., 1996; Ceddia și colab., 1998), scăderea expresiei leptinei și TNFα poate contribui la ameliorarea rezistenței la insulină. . În studiul nostru, tratamentul șoarecilor obezi cu fenofibrat a scăzut nivelurile de ARNm de leptină și TNFα, deși modificările nivelurilor circulante de adipokine de către fenofibrat nu au fost măsurate. Astfel, se pare că fenofibratul contribuie la îmbunătățirea rezistenței la insulină prin scăderea expresiei moleculelor de semnalizare în adipocitele hipertrofice.
În plus, multe dovezi obținute din studii genetice la om și din studii de rozătoare indică faptul că PPARα joacă un rol în dezvoltarea obezității și a adipozității, deși PPARα este exprimat la un nivel scăzut în țesutul adipos alb. Studiile genetice la om au arătat că un polimorfism de câștig de funcție L162V în gena PPARα este asociat cu adipozitate redusă în populația generală (Bosse și colab., 2003). Studiile pe rozătoare au arătat, de asemenea, că depozitele mai mari de adipoză gonadală au fost observate reproductibil la șoareci PPARα-nul (Akiyama și colab., 2001), sugerând că fenofibratul activator PPARα poate fi utilizat ca inhibitor al masei grase corporale. Cu toate acestea, până în prezent, fenofibratul nu a fost utilizat pentru a controla masa țesutului adipos la om, probabil din cauza posibilității ca doza de fenofibrat pentru pierderea de grăsime să provoace efecte secundare nedorite, deși rezultatele noastre actuale arată că fenofibratul a scăzut semnificativ masa de grăsime viscerală la șoarecii obezi.
În concluzie, aceste studii demonstrează că tratamentul cu fenofibrat crește expresia genelor țintă PPARα implicate în β-oxidarea acidului gras în țesutul adipos visceral al șoarecilor obezi, rezistenți la insulină. Aceste modificări au condus la scăderea dimensiunii adipocitelor, precum și la scăderea acizilor grași fără ser, la leptina adiposă și la expresia ARNm TNFα, reducând astfel incidența rezistenței la insulină.
Metode
Animale
Pentru toate experimentele, șoarecii în vârstă de opt săptămâni (C57BL/6J) au fost găzduiți și crescuți la Institutul de Cercetare Coreeană pentru Biosștiință și Biotehnologie în condiții fără patogeni, cu un ciclu de lumină/întuneric standard de 12 ore. Înainte de administrarea unor diete speciale, șoarecii au fost hrăniți cu chow și apă standard pentru rozătoare ad libitum. Șoarecii au fost împărțiți aleatoriu în trei grupuri (n = 5/grup), dintre care unul a primit o dietă cu conținut scăzut de grăsimi (4,5% grăsimi, g/g, CJ, Coreea). Un alt grup a primit o dietă bogată în grăsimi conținând 35% grăsimi (g/g, Research Diets, New Brunswick, NJ), iar grupul final a fost hrănit cu aceeași dietă bogată în grăsimi suplimentată cu fenofibrat (0,05%, g/g) timp de șapte săptămâni (Jeong și colab., 2004b; Jeong și Yoon, 2007). Compoziția dietei bogate în grăsimi este prezentată în tabelul de date suplimentare S1. În toate experimentele, greutățile corporale au fost măsurate zilnic folosind un echilibru de încărcare de sus, iar persoana care a măsurat greutatea corporală a fost orbită pentru fiecare grup de tratament. Animalele au fost sacrificate prin dislocare cervicală, iar țesuturile au fost recoltate, cântărite, congelate rapid în azot lichid și depozitate la -80 ℃ până la utilizare.
Testele de toleranță la glucoză au fost efectuate prin injecție intraperitoneală (IP) de glucoză (2 g/kg greutate corporală) la șoareci cu o dietă bogată în grăsimi sau aceeași dietă bogată suplimentată cu fenofibrat timp de 7 săptămâni. Glicemia a fost măsurată utilizând un sistem Accu-Chek Performa (Roche, Germania) la intervalele de timp indicate.
Diferențierea 3T3-L1
Celulele 3T3-L1 de șoarece (ATCC) din plăci cu 6 godeuri au fost proliferate în DMEM conținând 10% ser de vițel bovin (Gibco-BRL, Grand Island, NY). După ce celulele au fost menținute confluente timp de două zile, au fost incubate în mediu de inducție (ziua 0) conținând 1 µM dexametazonă, 0,5 mM 1-metil-3-izobutil-xantină și 1 µg/ml insulină în DMEM cu 10% FBS (Gibco -BRL). Culturile au fost continuate încă două zile pentru a induce diferențierea adipocitelor. Ulterior, celulele au fost cultivate în DMEM cu 10% FBS pentru restul procesului de diferențiere. Toate celelalte tratamente au fost administrate numai în ziua 0 până în ziua 2, iar mediul a fost schimbat în fiecare zi.
Determinarea nivelului de glucoză plasmatică, insulină, trigliceride și acizi grași liberi
Nivelurile de trigliceride și glucoză au fost măsurate folosind un analizor chimic automat din sânge (CIBA Corning, Oberlin, OH). Nivelurile de acizi grași liberi și insulină au fost măsurate utilizând SICDIA NEFAZYME (Shinyang Chemical, Seoul, Coreea) și un kit de radioimunologie pentru insulină de șobolan (Linco, St. Charles, MO), respectiv.
Analiza histologică
Pentru colorarea hematoxilinei și eozinei (H&E), țesuturile adipose epididimale au fost fixate în formalină 10% tamponată cu fosfat timp de o zi și prelucrate într-o manieră de rutină pentru secțiunile de parafină. Cinci secțiuni groase de micrometri au fost tăiate și colorate cu H&E pentru examinare microscopică. Pentru a cuantifica numărul și dimensiunea adipocitelor, secțiunile colorate cu H & E au fost analizate folosind un sistem de analiză a imaginii (Image Pro-Plus, Silver Spring, MD).
RT-PCR
ARN celular total a fost preparat utilizând reactivul Trizol (Gibco-BRL, Grand Island, NY). Două ARN total total au fost transcrise invers folosind transcriptaza inversă a virusului leucemiei murinice Moloney și un primer antisens pentru a genera ADNc în condiții standard. Probele de ADNc au fost amplificate prin PCR într-un termociclator MJ Research (Waltham, MA). Primerii PCR utilizați pentru amplificare sunt prezentați în tabelul de date suplimentare S2. Reacția a constat din 30 de cicluri de denaturare timp de 1 min la 94 ℃, recoacere timp de 1 min la 58 ℃ și alungire timp de 1 min la 72 ℃. Produsele PCR au fost analizate prin electroforeză pe un gel de agaroză 1%. Produsele PCR au fost cuantificate din geluri de agaroză folosind kitul GeneGenius (Syngene, Cambridge, Marea Britanie).
analize statistice
Dacă nu se specifică altfel, toate valorile sunt exprimate ca medie ± SD. Toate datele au fost analizate de cei nepereche, Student's t-test pentru diferențe semnificative între valorile medii ale fiecărui grup utilizând SigmaPlot 2001 (SPSS Inc, Chicago, IL).
- Indicii din chirurgia bariatrică care inversează rezistența la insulină pentru a vindeca inima
- Fenofibrat, sensibilitate la insulină și pierdere în greutate Forumuri zilnice pentru diabet
- Deficiența ”mitocondriilor în mușchi nu cauzează diabet zaharat cu rezistență la insulină
- Alegut unul din zi Adiposul de la Doctor Who SYFY WIRE
- Efectele pierderii în greutate și exercițiilor fizice asupra concentrațiilor serice de apelină și expresiei țesutului adipos în