Abstract
Obezitatea este o stare de dereglare metabolică a întregului organism și un factor major care contribuie la epidemia diabetului insulino-rezistent. Tratamentul non-farmacologic al obezității cu intervenții chirurgicale bariatrice are ca rezultat o inversare dramatică și aproape instantanee a rezistenței la insulină. Prezenta revizuire abordează colectiv dovezile acestui fenomen în literatură și discută potențialele mecanisme metabolice și neurohumorale. Propunem că restricția nutrienților scade mecanismele de apărare ale celulei pentru supraîncărcarea nutrienților în organele sensibile la insulină.
Introducere
Obezitatea este o stare de dereglare metabolică a întregului organism și un factor major care contribuie la epidemia de diabet [1]. Dintre americanii de peste 20 de ani, aproximativ 150 de milioane sunt supraponderali sau obezi, reprezentând aproape jumătate din populație [2]. Deși Asociația Americană a Diabetului (ADA) și Organizația Mondială a Sănătății (OMS) diferă în ceea ce privește definiția și criteriile de diagnostic ale „prediabetului” sau „afectarea reglării glucozei” [3], sunt în deplin acord cu privire la impactul devastator al obezității și diabet zaharat. are și va avea în continuare asistență medicală.
Dr. Walter Pories a început să efectueze o intervenție chirurgicală de bypass gastric în anii 1980. El și-a dat seama rapid că atunci când a operat pacienți obezi cu diabet, pacienții nu mai aveau nevoie de insulină [4]. Mai mult, această schimbare timpurie a metabolismului glucozei părea să apară chiar înainte de pierderea substanțială în greutate. Când a fost propus pentru prima dată, noțiunea că diabetul poate fi vindecat cu bypass gastric părea destul de ciudată. Au trecut 15 ani de la prima procedură de bypass gastric înaintea Dr. Pories și-a publicat datele arătând că, în rândul celor 146 de persoane, cohorta de diabet, 121 (83%) au devenit fără diabet post-operator [5].
Acest succes chirurgical ridică întrebări cu privire la mecanismele care stau la baza inversării rezistenței la insulină după o intervenție chirurgicală de slăbire. Mecanismele moleculare care stau la baza rezistenței la insulină și sindromul metabolic sunt extrem de complexe, în special în ceea ce privește sistemul cardiovascular [6-8]. Efectele chirurgiei bariatrice asupra rezistenței la insulină și a altor markeri metabolici ai obezității ne-au oferit o poartă de acces în acest domeniu remarcabil de cercetare.
Consecințele rezistenței la insulină
Rezistența la insulină este definită ca abilitatea redusă a mușchilor și a altor țesuturi sensibile la insulină de a transporta glucoza din fluxul sanguin în celulă [9]. În realitate, însă, rezistența la insulină este o tulburare metabolică de complexitate extremă care nu este încă pe deplin înțeleasă. Rezistența la insulină datorată excesului de nutrienți este un fenomen bine cunoscut [10]. De exemplu, rezistența la insulină și metabolismul modificat al acidului gras liber (FFA) sunt legate intrinsec [11]. Niveluri crescute de acizi grași liberi de plasmă și creșterea lipogenezei hepatice sunt observate de obicei în starea rezistentă la insulină [12] [13]. Mai mult, mai multe studii au arătat o relație puternică între rezistența la insulină și creșterea conținutului de trigliceride intramiocelulare prin biopsie musculară și imagistică prin rezonanță magnetică nucleară [14, 15]. Acest concept este extrem de important în ceea ce privește lipotoxicitatea, care va fi discutat mai târziu.
Se știe încă din anii 1960 că acizii grași concurează cu glucoza pentru oxidarea substratului; se crede că acest război intracelular implică niveluri ridicate de citrat și acumularea de glucoză-6-fosfat și inhibarea activității hexokinazei II [11]. Inhibarea glicolizei cu acizi grași are ca rezultat creșterea concentrațiilor intracelulare de glucoză și scăderea absorbției glucozei [11]. Această ipoteză convențională a fost contestată recent și acum se crede că acumularea de metaboliți ai acizilor grași poate interfera direct cu semnalizarea în aval a receptorilor de insulină, reducând activitatea de transport a glucozei prin receptorul GLUT-4 [16].
Cel mai important efect al rezistenței la insulină este diferența în furnizarea crescută de substraturi care furnizează energie și oxidarea redusă a acestora. În esență, alimentarea cu combustibil în exces și oxidarea redusă sunt caracteristici cheie ale rezistenței la insulină, cu consecințe profunde asupra metabolismului celular. S-a propus ca dezechilibrul în partiționarea dintre adipocit la mușchi și ficat, care este cel mai responsabil pentru afectarea metabolismului glucozei și a rezistenței la insulină. Consecințele obezității și rezistenței la insulină includ niveluri ridicate de glucoză și acizi grași liberi, concentrații crescute de insulină și leptină și niveluri scăzute de adiponectină; alți markeri metabolici includ proteine C-reactive ridicate (CRP) și niveluri alfa ale factorului de necroză tumorală (TNF) [17].
A durat destul de mult timp până când experții au ajuns la un consens cu privire la criteriile de diagnostic ale sindromului metabolic [18] și a fost necesară o scurtă discuție asupra sindromului metabolic în contextul obezității și rezistenței la insulină. Punctul de articulație din definiția sa este obezitatea centrală manifestată prin circumferința mărită a taliei; alți parametri includ niveluri crescute de trigliceride, niveluri ridicate de glucoză din sânge și valori ale tensiunii arteriale, pe lângă un nivel scăzut al colesterolului HDL. Utilitatea sindromului metabolic ca predictor al bolilor cardiovasculare (BCV) și al diabetului nu este împărtășită de toți. În 2004, ADA a prezentat un raport care sugerează că „furnizorii ar trebui să evite etichetarea pacienților cu termenul de sindrom metabolic”, argumentând că „adulții cu orice factor major de risc pentru BCV ar trebui evaluați pentru prezența altor factori de risc pentru BCV” și „că toate BCV factorii de risc ar trebui tratați individual și agresiv '[19]. În același timp, există criterii pentru sindromul metabolic la persoanele cu obezitate metabolică, cu greutate normală [20].
Reticența de a accepta sindromul metabolic ca o știință exactă este oarecum de înțeles. De exemplu, nu toți indivizii obezi sunt rezistenți la insulină, dar există o corelație puternică între obezitate și rezistența la insulină. Într-un studiu de aproape 5.000 de participanți, sondajele naționale de examinare a sănătății și nutriției (NHANES), [21] au clasificat populația de pacienți în grupe de greutate pe baza indicelui de masă corporală (IMC). Utilizând criteriile de diagnostic ale sindromului metabolic, evaluarea modelului de homeostazie (HOMA) a rezistenței la insulină și măsurătorile CRP, s-a constatat că 32% dintre subiecții obezi sunt „sănătoși din punct de vedere metabolic” și 24% dintre indivizii cu greutate normală au fost anormali din punct de vedere metabolic. Ce facem din indivizii obezi „sănătoși din punct de vedere metabolic” care nu prezintă trăsături ale sindromului metabolic în afară de talia rotundă? Răspunsul încă nu este clar.
Modificări metabolice cu chirurgia bariatrică
Schimbările metabolice care însoțesc intervenția chirurgicală bariatrică, cum ar fi inversarea rezistenței la insulină, apar chiar înainte de a se produce o pierdere substanțială în greutate [22] [23] [24, 25]. Această descoperire neașteptată a fost oarecum contra-intuitivă, dar este un fapt bine stabilit. Nu pierderea în greutate reală este cea mai responsabilă pentru îmbunătățirea profilului metabolic după o intervenție chirurgicală bariatrică. În acest context, modificarea hormonilor enterici și a „diafragmei” acestora cu creierul a devenit o zonă de interes. Tipul intervenției chirurgicale joacă, de asemenea, un rol în prezicerea inversării deranjamentelor metabolice [25, 26]. Un studiu pe termen lung a arătat recent că chirurgia bariatrică este probabil mai eficientă decât îngrijirea standard în prevenirea diabetului de tip 2 la persoanele obeze [27]
Deși toate formele de chirurgie bariatrică de succes prezintă îmbunătățiri ale comorbidităților, procedurile malabsorptive, cum ar fi bypassul gastric Roux-en-Y (RYGB), au arătat o ameliorare mai dramatică a diabetului în comparație cu procedurile mai restrictive (adică bandarea gastrică) [28] . Aceasta completează unul dintre studiile noastre anterioare, care a arătat că, în comparație cu pacienții supuși RYGB, pierderea în greutate și normalizarea parametrilor metabolici au fost mai puțin pronunțate după 2 ani la pacienții supuși bandajului gastric [26].
Studiile noastre anterioare arată, de asemenea, o inversare dramatică a tulburărilor în metabolismul muscular [24]. Înscrierea prospectivă a inclus 43 de pacienți cărora li s-au efectuat profiluri metabolice și cardiovasculare extinse, precum și biopsii ale mușchilor scheletici efectuate în momentul operației, la 3 și 9 luni după operație. Tabelul 1 arată o reducere a nivelului de glucoză și insulină în repaus alimentar, precum și îmbunătățiri ale sensibilității la insulină și ale nivelului de leptină la 3 luni după operație. Între 3 și 9 luni postoperator, am observat, de asemenea, o scădere considerabilă a concentrațiilor plasmatice de FFA, trigliceride și leptină. Este important ca îmbunătățirile în metabolismul glucozei și rezistența la insulină să fie un fenomen perceput relativ devreme.
tabelul 1
Modificări fizice și hemodinamice și metabolice după operație
| Măsurători | ||||
| Legat de greutate | ||||
| Greutate (kg) | 21,5 (18,07–25,00) | 2) | 7,7 (6,70-8,89) | ‡ |
| DBP (mmHg) | 3,9 (−1.11–8.95) | 0,12 | 1,7 (−3,45–6,79) | 0,51 |
| HR (bpm) | 10,0 (5,53-14,53) | * Diferența medie este o scădere a valorii rezultatului, cu excepția cazului în care este indicată de o valoare negativă. | ||
CI 95% - Interval de încredere pentru diferență; IMC - Indicele masei corporale; Circ de talie. - Circumferinta taliei; SBP - tensiune arterială sistolică; DBP - tensiune arterială diastolică; HR - ritm cardiac; FFA - Acizi grași fără plasmă.
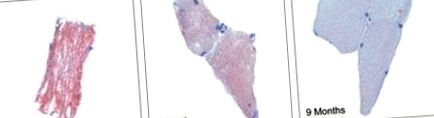
Este bine stabilit că țesutul non-adipos, cum ar fi inima și mușchii scheletici, vor stoca FFA suplimentare ca trigliceride intra-miocelulare [29], care pot fi evaluate cu ușurință histologic cu o colorare roșu-ulei-O. Figura 1 prezintă petele roșu-ulei-O ale probelor de biopsie a mușchilor scheletici în momentul intervenției chirurgicale, la 3 și 9 luni după operație [24]. Am demonstrat o reducere izbitoare a colorării la nouă luni; scăderea colorării între trei și nouă luni s-a corelat semnificativ cu o scădere a greutății și a masei grase. Mai mult, a existat, de asemenea, o asociere între intensitatea colorării și nivelurile plasmatice de FFA. Scăderea trigliceridelor intra-miocelulare este probabil rezultatul scăderii aportului de FFA, a ratei crescute de hidroliză a trigliceridelor și a ratei crescute de oxidare a FFA. Un astfel de fenomen este probabil un proces etapizat, complex, cu scopul de a inversa efectele lipotoxicității.
Petă roșie-ulei-O a biopsiilor musculare. Probele au fost obținute la momentul inițial, la 3 și 9 luni după operație. Diapozitivele sunt reprezentative pentru secțiunile fiecărui pacient la fiecare moment (timp de referință, 3 și 9 luni). Linia de bază vs 3 luni 4,2 UA (-2,4-10,9), p Haffner S, Taegtmeyer H. Obezitate epidemică și sindromul metabolic. Circulaţie. 2003; 108: 1541-1545. [PubMed] [Google Scholar]
- Modificări ale formei corporale dorite după intervenția chirurgicală bariatrică
- Bucătarul Mario Izzo constată că o rețetă pentru pierderea în greutate include o intervenție chirurgicală bariatrică
- Modificări ale activității sexuale după intervenția chirurgicală bariatrică - Olde Del Mar
- Procedură de chirurgie bariatrică cu comutator duodenal
- Deficiența ”mitocondriilor în mușchi nu cauzează diabet zaharat cu rezistență la insulină