Abstract
1. Introducere
Aminoacizii sunt elemente de bază pentru proteina microbiană, făcându-le importante pentru creșterea microbiană. Cu toate acestea, ele pot fi fermentate și ca sursă de energie [8]. Peptidele nedigerate sunt descompuse de bacteriile proteolitice și utilizate ulterior fie în fermentarea proteolitică, fie pentru a forma componente ale celulelor microbiene. Proteina microbiană are o proporție mare de aminoacizi cu lanț ramificat, deși compoziția exactă variază între tulpinile bacteriene [8]. Catabolismul are ca rezultat numeroși metaboliți care afectează gazda dincolo de disponibilitatea aminoacizilor. Soarta aminoacizilor depinde de factori ecologici și dietetici care influențează cantitățile relative de fermentație proteolitică. De exemplu, o cantitate redusă de fibre alimentare poate duce la creșterea fermentației proteolitice datorită cantității reduse de carbohidrați fermentabili din colon [9]. Schimbările către fermentația proteolitică crescută pot modifica abundența relativă a speciilor microbiene în intestin și pot genera produse metabolice bioactive, potențial dăunătoare [8].
Sunt disponibile informații limitate despre rolul fermentației proteolitice în rețelele metabolice complexe dintre microbii intestinali și gazda lor. Sunt necesare mai multe informații cu privire la ce produse sunt generate, care sunt speciile implicate sau afectate și modul în care aceste schimbări se reunesc pentru a afecta gazda. În completarea altor recenzii, vom descrie modul în care căile de fermentație proteolitică, metaboliții produși și modelul alimentar converg pentru a afecta sănătatea. În special, această revizuire se va concentra asupra efectelor specifice compartimentului fermentației proteolitice în diferite segmente ale intestinului împreună cu metaboliți precum amoniac, p-crezol și amine care pot forma sănătatea.
2. Fermentarea proteolitică implică multe căi metabolice
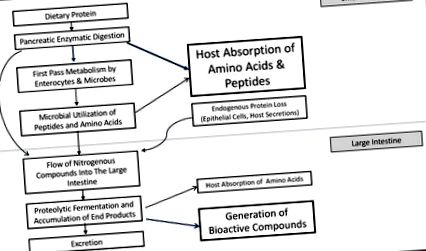
Modelarea rețelelor metabolice gazdă și microbiotă utilizând adnotarea genomului a identificat 3499 de reacții distincte; dintre acestea, 1267 sunt unice microbiotei și 1142 sunt împărtășite cu gazda [4]. Când aceste reacții sunt atribuite unor funcții mai mari, devin evidente interdependențele complexe ale metabolismului gazdei și ale microbiotei. Trei sferturi din toate căile utilizează atât reacții de gazdă, cât și reacții de microbiotă [4]. Această colaborare a reacțiilor gazdă și microbiană determină soarta proteinelor alimentare din intestin și efectele generale asupra echilibrului și metabolismului aminoacizilor gazdei (Figura 1). Relația dintre reacțiile metabolice complică, de asemenea, modelarea dinamicii fermentației în mediul intestinal, limitând înțelegerea noastră actuală despre fermentația proteinelor.
Soarta proteinelor alimentare din intestin este determinată de o rețea de procese metabolice, inclusiv digestia și utilizarea atât a gazdei, cât și a celor microbiene. Efectele dominante pentru fiecare compartiment sunt îngroșate și afișate cu săgeți albastru închis.
3. Fermentarea proteolitică produce metaboliți diferiți
Identificarea metaboliților generați prin fermentația proteolitică în lumenul intestinal a fost limitată până în prezent de complexitatea conținutului luminal și de limitările în clasificarea metaboliților ca gazdă sau derivată de microbi [4]. Similar fermentației cu fibre, fermentarea proteinelor produce acizi grași cu lanț scurt; cu toate acestea, aceștia sunt însoțiți de acizi grași cu lanț ramificat, amoniac, amine, hidrogen sulfurat, fenoli și indoli [14]. Unii aminoacizi au profiluri metabolice caracteristice, cum ar fi cele generate pentru aminoacizi cu lanț ramificat și aromatici, care pot fi folosiți ca indicator al fermentației proteinelor în intestin [15]. Multe dintre aceste produse sunt, de asemenea, identificate ca molecule bioactive cu rol în semnalizare.
Pe lângă BCFA și amoniac, se acordă o creștere a dobânzii către alți derivați metabolici ai fermentației proteolitice. Unele dintre aceste produse sunt implicate în boli, inclusiv cancerul colorectal, în timp ce altele, cum ar fi poliaminele dietetice, joacă roluri importante în fiziologia celulelor mucoasei intestinului subțire și dezvoltarea sistemului imunitar [4,22,23]. Poliaminele sunt produse printr-un set divers de căi care duc la decarboxilarea aminoacizilor [24,25]. Multe specii producătoare de amine din genuri, inclusiv Bifidobacterium, Clostridium, Lactobacillus, Escherichia și Klebsiella au fost identificate în microbiota intestinală [26]. Bacteriile utilizează poliamine în sinteza ARN, ca componente structurale ale membranelor celulare sau ale peptidoglicanului și pentru a proteja împotriva deteriorării speciilor reactive de oxigen sau a mediilor acide [27]. Această producție de amine în perioadele de stres fiziologic poate duce la modificări ale patogenității bacteriene, precum și susceptibilitatea gazdei la infecție, făcând acești compuși candidați pentru o explorare ulterioară în ceea ce privește rolul lor în infecția gastro-intestinală, precum și carcinogeneza, care este discutată în continuare secțiuni [27].
Zece căi de putrefacție care generează aceste diverse produse finale au fost identificate până acum și au fost atribuite multora dintre filele microbiene majore din intestin, inclusiv Firmicutes, Bacteroidetes și Proteobacteria [28]. Fermentarea aminoacizilor aromatici poate fi deosebit de importantă din punct de vedere biologic. deoarece acest lucru generează o gamă largă de produse finale bioactive, cum ar fi fenolul și p-crezolul (tirozina), sau indolul și skatolul (triptofanul) [4]. Construcția căilor probabilistice a identificat trei căi microbiene care catabolizează triptofanul și generează un total de 10 produse, dintre care șase participă la metabolismul gazdei [4]. Dovada rolului microbilor în producția acestor produse este demonstrată de abundența lor mică în conținutul cecal al șoarecilor fără germeni [4]. Metabolizarea microbiotică a tirozinei poate produce fenol, un produs care nu este detectat în absența microbilor [4]. Acești metaboliți sunt candidați excelenți pentru explorarea și validarea ulterioară pentru a identifica care specii microbiene pot fi importante în generarea de metaboliți specifici in vivo. În prezent, se știe puțin despre modul în care modificările microbiotei afectează producția acestor molecule bioactive.
4. Multe specii microbiene contribuie la fermentarea proteolitică
5. Fermentarea proteolitică în intestinul subțire afectează echilibrul aminoacizilor gazdă
În ciuda timpului de tranzit rapid și a unui grad ridicat de absorbție a gazdei de peptide și aminoacizi, dovezile sugerează că utilizarea microbiană a aminoacizilor începe în intestinul subțire [8,31]. O schimbare în structura microbiotei ileale a fost demonstrată ca răspuns la nivelurile de proteine dietetice [32]. Comparativ cu o dietă bogată în proteine (16% proteină brută), o proteină dietetică moderată (13% proteină brută) scade Clostridiaceae și aminele biogene în ileonul porcilor, crescând în același timp proteinele de joncțiune strânsă claudin și occludin [33]. Acest lucru contrazice alte studii care arată un efect benefic al aminelor asupra funcției intestinale și sugerează că poate exista un efect prag dincolo de care producția de amine este în detrimentul funcției de barieră intestinală. Poliaminele sunt ușor absorbite din lumenul intestinal și sunt regulatori importanți ai metabolismului celular, creșterii și proliferării [34]. Cu toate acestea, la concentrații mari de amine s-a demonstrat că provoacă inflamație și vărsare epitelială a mucoasei gastro-intestinale, precum și dezorganizarea țesutului pancreatic la animalele tinere [35].
6. Fermentarea proteolitică în intestinul gros generează produse finale bioactive
La om, fermentarea carbohidraților are loc în primul rând în colonul proximal, rezultând un colon distal care conține substrat fermentabil scăzut. Proteinele care curg în intestinul gros pot proveni din alimente nedigerate, celule bacteriene și pierderi endogene de intestin. Aceste pierderi endogene includ proteine din enzime, mucus și celule epiteliale sloughed [39]. Intestinul subțire are cea mai mare contribuție la pierderile endogene și poate fi afectat de factori precum calitatea proteinelor și aportul de fibre [39]. Tipul de fibre afectează și gradul de pierderi endogene. Tărâțele de grâu, de exemplu, măresc pierderile endogene, în timp ce nu se observă niciun efect cu celuloza [40]. Acest efect poate depinde de gradul în care un anumit tip de fibră crește secreția enzimatică și producția de mucoase sau scade digestibilitatea aminoacizilor din intestinul subțire [39,41]. Fluxul rezultat de proteine în intestinul gros nu poate duce la acumularea de produse nocive în aceste cazuri, deoarece este însoțită de carbohidrați microbieni accesibili.
7. Dieta afectează fermentația proteolitică
Această constatare a fermentației proteolitice crescute, în ciuda incidenței mai mici a CRC, sugerează că fermentația crescută a carbohidraților observată în sud-africanii din mediul rural poate exercita un efect protector împotriva efectelor metaboliților proteolitici asupra dezvoltării CRC. Când sunt examinate rețelele metabolice, fermentația aminoacizilor cu lanț ramificat pare a fi crescută în dieta africană. Cu toate acestea, p-crezolul urinar este mai mare la afro-americani înainte de intervenția dietetică [48]. Acest lucru susține sugestia că aportul ridicat de fibre poate modifica căile de fermentare a proteinelor și poate oferi efecte protectoare împotriva inflamației și a întreruperii ciclurilor celulare (Figura 2). Mecanismele care stau la baza acestei schimbări în fermentația proteolitică departe de metaboliții dăunători rămân a fi elucidate. Mecanismele posibile ar putea include inhibarea anumitor căi de fermentare sau fermentarea de către specii microbiene specifice. În mod similar, fermentarea fibrelor și modificările rezultate ale vâscozității digestive ar putea modifica interacțiunile dintre metaboliți și mucoasă, limitând efectele dăunătoare ale acestor metaboliți. Mai multe informații despre aceste interacțiuni metabolice complexe sunt necesare înainte de a putea face recomandări puternice.
- Pilula dietetică pe bază de plante Jadera, producător de capsule dietetice ușoare și exportatori din ID - 662139
- Jay Robb Pulbere de proteine de alb de ou Pierderea în greutate Suprimarea apetitului Dieta vegetariană eficientă pentru
- Dieta cu conținut scăzut de proteine pentru pierderea în greutate; Longevitate
- Cum să scapi de grăsimea viscerală Expert recomandă dieta și exercițiile cardio două dintre cele mai importante
- Includerea proteinelor în dietă poate ajuta la slăbire - Kunena