Jonathan D. Douros
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
Jingjing Niu
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
Sophia Sdao
2 Departamentul de Medicină, Divizia de Endocrinologie, Diabet și Metabolism, Universitatea din Wisconsin-Madison, Madison, Wisconsin, SUA.
Trillian Gregg
2 Departamentul de Medicină, Divizia de Endocrinologie, Diabet și Metabolism, Universitatea din Wisconsin-Madison, Madison, Wisconsin, SUA.
Kelsey Fisher-Wellman
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
Manish Bharadwaj
3 Center for Diabetes Research, Wake Forest School of Medicine, Winston-Salem, Carolina de Nord, SUA.
Anthony Molina
3 Center for Diabetes Research, Wake Forest School of Medicine, Winston-Salem, Carolina de Nord, SUA.
Ramamani Arumugam
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
MacKenzie Martin
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
Enrico Petretto
4 Center for Computational Biology, Duke-NUS Medical School, Singapore.
Matthew J. Merrins
2 Departamentul de Medicină, Divizia de Endocrinologie, Diabet și Metabolism, Universitatea din Wisconsin-Madison, Madison, Wisconsin, SUA.
Mark A. Herman
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
Jenny Tong
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
Jonathan Campbell
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
David D'Alessio
1 Divizia de endocrinologie, Duke Molecular Physiology Institute, Duke University, Durham, Carolina de Nord, SUA.
Date asociate
Abstract
Introducere
În primele săptămâni până la luni după operație, pacienții cu diabet demonstrează o oarecare restaurare a răspunsului acut al insulinei la glucoza intravenoasă (i.v.) (19-21), a cărei pierdere este o caracteristică distinctivă a disfuncției insulelor diabetice (22). Întoarcerea timpurie a răspunsului acut la insulină este independentă de greutate și nu depinde în mod direct de factorii insulinotropi din intestinul modificat chirurgical, deoarece stimulului celulei β i se administrează i.v. Această observație sugerează că chirurgia bariatrică îmbunătățește funcția insulelor într-un mod care nu necesită aport acut din surse neuroendocrine. Studiile descrise aici testează ipoteza că VSG îmbunătățește toleranța la glucoză prin creșterea secreției de insulină. În aceste studii, comparăm șoarecii cu VSG cu controale simulate chirurgicale (PF-Sham) hrănite în pereche pentru a evalua secreția de insulină in vivo și ex vivo independent de modificările greutății corporale, de cererea de insulină sau de echilibrul caloric.
Rezultate
Parametri metabolici preoperatori în dieta cu conținut ridicat de grăsimi - șoareci hrăniți.
Presurgical BW pentru o cohortă reprezentativă de șoareci la o dietă bogată în grăsimi (HFD; Research Diets, catalog D12451, 45% kcal din lipide; n = 15) pe parcursul a 8 săptămâni nu a diferit între animale înainte de VSG sau de intervenția chirurgicală simulată (Figura suplimentară 1A; material suplimentar disponibil online cu acest articol; https://doi.org/10.1172/jci.insight.126688DS1). Animalele au obținut un BW preoperator de 36,5 ± 1,07 g, cu
31% din creșterea în greutate care a avut loc în ultima săptămână înainte de operație. Speculăm că acest lucru se poate datora tranziției Asigurați-vă masa cu 2 zile înainte de operație sau stresului metabolic acumulat în timpul expunerii la HFD. Nici concentrația de glucoză, nici concentrațiile de insulină circulante nu au diferit între grupurile alocate intervenției chirurgicale VSG sau Sham în timpul preoperatoriei i.p. teste de toleranță la glucoză (IPGTTs) sau teste de toleranță la mese mixte (MMTTs; Figura suplimentară 1, B - E).
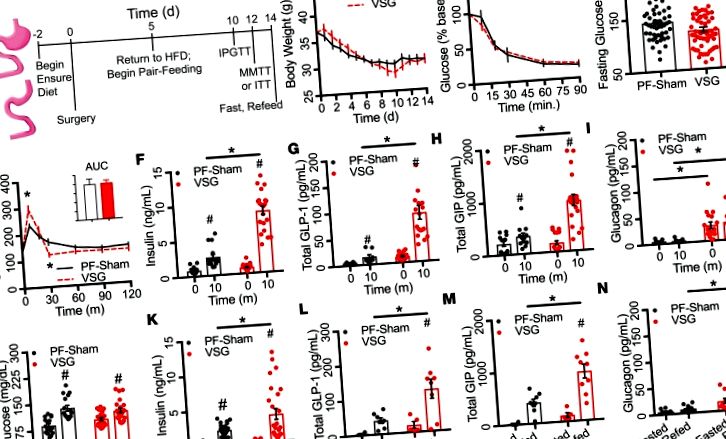
Secreția de insulină in vivo este îmbunătățită de VSG în timpul eliberării de nutrienți enterali.
O schemă a paradigmei experimentale utilizate este prezentată în Figura 1A. În primele 2 săptămâni după operație, ambele grupuri au pierdut
18% BW (7,46 ± 0,62 g; Figura 1B). BW și glicemia în timpul testelor de toleranță la insulină (prezentate ca procent din glucoza inițială; Figura 1C) nu au diferit între grupuri, indicând o sensibilitate comparabilă la insulină între cele 2 grupuri. Cu toate acestea, glucoza din sânge la jeun timp de 6 ore a fost semnificativ redusă în grupul VSG cu
63%, respectiv; Figura 2, B și C). Secreția de insulină (ng/ml) și excursia la glucoză (AUCIPGTT) au fost corelate invers în timpul IPGTT în grupul VSG (r 2 = 0,21, P ≤ 0,01; Figura 2D), dar nu și PF-Shams. Aceste rezultate sugerează 2 puncte importante. În primul rând, celulele β demonstrează o sensibilitate mai mare la glucoză, care este parțial independentă de stimularea acută de factori derivați din intestin după VSG. În al doilea rând, secreția de insulină îmbunătățită contribuie la îmbunătățirea toleranței la glucoză observată cu VSG.
(A - C) Glicemia și ASC integrată (A), insulină circulantă (B) și raportul insulină/glucoză (C) în timpul unui i.p. test de toleranță la glucoză (PF-Sham, n = 14-29; VSG, n = 16-36). (D) Corelația dintre secreția de insulină (ng/ml) și excursia la glucoză (AUCIPGTT; PF-Sham, n = 50; VSG, n = 59) în timpul unui i.p. test de toleranță la glucoză. Animalele PF-Sham sunt prezentate cu linii solide negre sau cercuri gri; Animalele VSG sunt afișate în linii punctate roșii sau cercuri roșii. Datele reprezintă media ± SEM; * P # P Figura 3A); 459 între VSG și ad libitum - grup alimentat, acționat simulat (AL-Sham; Figura 3B); și 38 între insulele PF-Sham și AL-Sham (Figura 3C) (Figura 3D ajustată de Bonferroni). Clusterul ierarhic pare, de asemenea, să distingă majoritatea șoarecilor AL-Sham de șoarecii PF-Sham. Analiza componentelor principale (PCA) a datelor transcripționale a arătat o separare semnificativă statistic a probelor VSG departe de probele AL- și PF-Sham de-a lungul axei primei componente principale; aceste separări au reprezentat 73% din varianța nivelurilor de expresie a genelor insulelor (Figura 3E). Kyoto Encyclopedia of Genes and Genomes (KEGG) analiza căilor (https://www.genome.jp/kegg/pathway.html) a genelor clasificate prin încărcarea PCA a arătat o îmbogățire semnificativă a mai multor căi, inclusiv secreția de insulină și Ca 2+ semnalizare (Tabelul 1). Aceste date ilustrează faptul că VSG reglează rapid expresia genelor insulelor într-un mod care este distinct de restricția calorică sau de chirurgia simulată. Căile evidențiate de această analiză imparțială sugerează că chirurgia bariatrică poate spori secreția de insulină prin modificarea funcției intrinseci a insulelor, inclusiv semnalizarea Ca 2+.
30%, P ≤ 0,001; Figura 4C) pentru VSG comparativ cu controalele PF-Sham și o tendință spre creșterea secreției de insulină de vârf (Figura 4D). Acest efect este consecvent în dimensiuni mai mari ale eșantionului (PF-Sham, 29; VSG, 39), unde secreția de insulină ca răspuns la schimbarea de la 2,7-10 mM glucoză a fost crescută în insulele VSG comparativ cu controalele PF-Sham (
Creștere de 53% prin ASC insulinică integrată, p = 0,013; Figura 4, E și F). Secreția de insulină și ASC ale insulinei ca răspuns la depolarizare cu 30 mM KCl nu au diferit între grupuri, sugerând că capacitatea secretorie de insulină nu a diferit (Figura 4, G și H). Sunt afectate mecanismele care leagă detectarea glucozei de secreția de insulină (Figura 4, I - M). Urmele reprezentative de Ca 2+ (Figura 4I), fracțiunea de platou (Figura 4J) și perioada (Figura 4K) demonstrează îmbunătățiri semnificative ale duratei și frecvenței pulsului (24, 25) a oscilațiilor Ca 2+ stimulate de glucoză în insulele VSG în 3 experimente independente, cu o tendință spre amplitudine crescută a oscilației Ca 2+ (Figura 4L). Fracția și perioada medie de platou pentru fiecare animal au fost, de asemenea, semnificativ diferite între grupuri; amplitudinea oscilatorie a fost neschimbată (Figura suplimentară 2, A - C). În plus, fracția de insule recrutate de 7 mM glucoză a crescut de> 2 ori la animalele VSG față de controalele PF-Sham (Figura 4M), în concordanță cu răspunsul secretor de insulină deplasat la stânga (Figura 4C). Aceste adaptări la șoareci VSG nu s-au datorat conținutului crescut de insulină per insulă sau compoziție de insulă (adică procentul de suprafață compus din celule β sau celule α) - niciuna dintre acestea nu a fost diferită între grupuri (Figura 4, N - P).
Efectul chirurgical pentru a spori GSIS in vivo independent de reglarea BW sau a incretinei acute crește posibilitatea ca această trăsătură să fie imprimată pe insulă prin modificări persistente ale funcției intrinseci, care pot fi vizualizate prin analiza programelor de expresie genică. În experimentele ulterioare de ARN-seq, insulele VSG prezintă 459 și 611 DEG (FDR ajustat P Figura 3A) demonstrează că modificarea postchirurgicală a transcriptomului insulei nu este pur și simplu un efect secundar al echilibrului energetic negativ, ci mai degrabă o fațetă unică a adaptării metabolice la interventie chirurgicala. Clusterul ierarhic și PCA au demonstrat separarea grupului VSG departe de ambele grupuri acționate în mod fals, în timp ce grupurile PF-Sham și AL-Sham sunt mult mai similare. Astfel, VSG a conferit insula cu un profil transcripțional unic, care a fost probabil în mare parte determinat de modificări ale transcrierilor celulelor β, deoarece aceste insule erau compuse din
85% celule β. Analiza de îmbogățire a setului de gene (GSEA) din primele 100 de gene exprimate cel mai variabil clasificate după valorile de încărcare a PCA sunt îmbogățite în căile KEGG pentru nu numai secreția de insulină, ci și semnalizarea Ca 2+ - un factor necesar pentru secreția de insulină (51). Mașinile canonice de detectare a glucozei, inclusiv glucokinaza și transportorii de glucoză, nu sunt modificate semnificativ. Deși nu este clar ce factor (i) unic (i) VSG determină aceste modificări în expresia genelor insulelor, influența dominantă a genelor precum Camk2a, Cacna1c și Adcy9 în analiza căii KEGG sugerează că balansul de ioni și/sau semnalizarea AMPc pot juca un rol rola. Transcrierile pentru receptorul GLP-1 (Glp1r), receptorul GIP (Gipr) și receptorul glucagonului (Gcgr) - receptorii cuplați ai proteinei G cunoscuți că stimulează AMPc - nu sunt modificați în insulă (Tabelul suplimentar 1), indicând faptul că sensibilitatea la acută stimulii incretinici nu pot fi îmbunătățiți la nivelul expresiei receptorilor după VSG. Cu toate acestea, rolul comunicării celulelor α- β (adică, produsele de proglucagon celular α potențând eliberarea insulinei) rămâne necunoscut (52, 53). În cele din urmă, aceste date demonstrează o remodelare unică a profilului transcriptomic al insulei de către VSG, care poate potența funcțional semnalizarea Ca 2+ și, ulterior, GSIS.
Am urmărit apoi să testăm dacă insulele VSG demonstrează o îmbunătățire funcțională a secreției de insulină atunci când sunt izolate din mediul in vivo. Insuletele izolate de șoareci VSG au prezentat un GSIS semnificativ crescut și un răspuns de insulină la stânga deplasat la glucoză comparativ cu martorii, în concordanță cu sensibilitatea crescută a celulelor β la glucoză. Acest profil secretor a fost coroborat de creșterea fluxurilor de Ca 2+ intra - β-celulare ca răspuns la expunerea crescută la glucoză și constatare convingătoare în măsura în care Ca 2+ este un mediator critic al exocitozei de insulină (24, 51). Ne-am concentrat asupra fracției platoului de calciu, a fracțiunii de timp petrecut în starea „pornită” a unei oscilații și a mecanismului prin care detectarea glucozei este codificată în oscilațiile metabolice și calcice ale celulei β (24, 25). Pe baza dependenței de glucoză a fracției platoului de calciu (54), se poate estima că VSG are efectul echivalent al creșterii glucozei extracelulare prin
3 mM. În consecință, procentul de insulițe care prezintă oscilații de calciu ca răspuns la 7 mM glucoză a fost, de asemenea, crescut de 2,2 ori în grupul VSG, indicând în continuare o sensibilitate crescută la glucoză în insulă după intervenția chirurgicală. Aceste diferențe sunt suficient de mari pentru a explica schimbarea la stânga a pragului de glucoză observat în studiile de perifuzie GSIS ex vivo și indică o îmbunătățire intrinsecă a funcției celulelor β în urma VSG.
Aceste rezultate de la insulele izolate oferă o legătură directă cu profilul transcripțional al insulelor, cu calea sa de semnalizare Ca 2+ îmbogățită și funcția secretorie de insulină crescută. Având în vedere că un mecanism care conectează sensibilitatea insulinei la glucoză la eliberarea insulinei se face prin căile de amplificare metabolică canonică (24, 55), am investigat diferite elemente ale acestei căi. În general, funcția mitocondrială determinată de 2 măsurători separate ale insulelor OCR (JO2), sintezei ATP și sintezei ATP/OCR au fost neschimbate prin intervenție chirurgicală. Astfel, capacitatea oxidativă mitocondrială îmbunătățită a insulelor nu pare să explice funcția îmbunătățită a celulei β. Arhitectura insulei (de exemplu, dimensiunea insulei, zona insulei compusă din celule α- sau β și masa celulei α- și β), de asemenea, nu diferă între grupuri, sugerând că masa insulei și morfologia nu contribuie la diferențele în funcția insulei prezentate aici . Acest lucru este întărit constatând că nici transcripțiile genei specifice celulei α sau celulelor β nu sunt îmbogățite în mod special în analiza noastră transcriptomică (Tabelul suplimentar 3), ci mai degrabă că există o îmbogățire uniformă a genelor care sunt exprimate atât în α- cât și în β celule (56).
Rezultatele noastre ilustrează în mod colectiv că VSG sensibilizează fundamental insula la glucoză. Aceasta poate servi ca o adaptare critică pentru a face față provocării homeostatice prezentate de fluxul crescut de substanțe nutritive din intestin către circulația comună pentru multe intervenții chirurgicale bariatrice (4). Efectul sensibilizant este intrinsec insulelor adaptate la intervenția chirurgicală timp de 10 zile, deoarece persistă ex vivo în afară de orice factor mediat de VSG, insulină-extrinsecă. Acest efect este concomitent cu un răspuns amplificat Ca 2+ la glucoză care pare să fie imprimat pe profilul transcriptomic al insulelor. În mod critic, îmbunătățirea funcției insulelor în perioada postoperatorie timpurie este un factor semnificativ al îmbunătățirilor timpurii independente de greutate ale controlului glucozei, care au atras un interes intens în întregul domeniu al diabetului. Această descoperire sugerează factorii declanșați la începutul cursului VSG și, eventual, alte intervenții chirurgicale bariatrice, au efecte directe asupra funcției celulelor β. Înțelegerea și valorificarea acestor factori are potențial pentru recuperarea secreției de insulină la pacienții diabetici.
Metode
Animale.
Șoarecii WT (C57BL/6J; Laboratorul Jackson) au fost crescuți intern la Duke Molecular Physiology Institute și plasați pe HFD (Research Diets Inc., 45% kcal din lipide, catalog D12451) la 8 săptămâni de la o medie de BM de
19 ani Animalele au fost cântărite o dată pe săptămână timp de 56 de zile (9 săptămâni) până când au atins BW de
38 g. Animalele au fost împărțite în grupuri separate cu profiluri metabolice echivalente pe baza BW (Figura 1A suplimentară), IPGTT preoperator (Figura 1B suplimentară) și MMTT preoperator (Figura 1D suplimentară). Curbele de glucoză și concentrațiile circulante de insulină (Figura suplimentară 1, B - E) nu au fost diferite între grupuri. Un total de 70 de șoareci au fost supuși VSG (60 de supraviețuitori; 10 au murit, au fost sacrificați sau au fost aruncați), iar 60 de șoareci au primit intervenție chirurgicală Sham și hrănire în pereche (53 de supraviețuitori; 7 au murit, au fost sacrificați sau au fost aruncați). Șoarecii au fost sacrificați sau aruncați din cauza bolii, a pierderii excesive de BW (> 20% BW) sau a hipoglicemiei (flux de glucoză în sânge 2+ la jeun.
Urmele și calculele oscilației calciului au fost efectuate în insule întregi expuse la 10 mM glucoză în conformitate cu protocoalele publicate anterior (54).
Statistici.
Toate datele sunt prezentate ca medie ± SEM și au fost analizate folosind Graphpad Prism, cu excepția cazului în care se indică altfel în legendele figurii. ASC integrată a fost calculată utilizând glicemia în repaus alimentar a fiecărui animal ca bază inițială și comparată între grupuri utilizând un test t cu 2 cozi, nepereche. O regresie liniară a fost utilizată pentru a analiza relația dintre ASC a glucozei și GSIS in vivo din Figura 2D; panta liniei este comparată cu o pantă ipotetică de 0. Toate celelalte date au fost analizate folosind ANOVA cu 1 direcție sau ANOVA cu 2 direcții, după caz. Testul de comparație multiplă al unui Sidak post-hoc a fost utilizat pentru a corecta comparațiile multiple.
Aprobarea studiului.
Toate procedurile care implică animale au fost aprobate de Duke IACUC și Duke Laboratory Animal Resource Division.
Contribuțiile autorului
JDD, KFW, EP, MJM, JC, AM și DD au conceput studii de cercetare; JDD, JN, SS, TG, KFW, MB, RA, AM și MM au efectuat experimente; JDD, KFW, EP, MJM, MAH, JT, JC și DD au analizat datele; JDD și DD au scris manuscrisul.
- Manșon chirurgical Gastrectomie Pierderea în greutate Servicii Mercy Health
- PDF Restricție, scădere în greutate și variabilitatea greutății corporale - Descărcare gratuită PDF
- Menținerea pozitivă a corpului în conversațiile despre pierderea în greutate
- Rolul activității fizice în prevenirea și tratamentul creșterii în greutate corporală la adulți
- Operație simultană LVAD cu punte-transplant cu gastrectomie în mânecă ȘTIRI BARIATRICE