Greutatea corporală fetală a demonstrat o scădere legată de doză, fetuții cu doză mare cântărind semnificativ mai puțin decât martorii.
Termeni asociați:
- Diabet gestațional
- Vârsta gestațională
- Diabetul zaharat
- Placenta
- Prieten Megadose
- Greutate la nastere
- Toxicitate
- Toxicitate pentru dezvoltare
- Creșterea fetală
Descărcați în format PDF
Despre această pagină
Biometria fetală, estimarea vârstei gestaționale, evaluarea creșterii fetale
Domenico Arduini, Francesco Giacomello, în Ultrasunete în obstetrică și ginecologie, 2009
ESTIMAREA GREUTĂȚII FETALE
Utilitatea clinică a estimării greutății fetale este încă dezbătută, deoarece este destul de fiabilă în cazul normalității, dar adesea nesigură în cazul patologiei, tocmai când problemele juridice ar putea proveni din asocierea dintre un rezultat fetal nefast și ceea ce se numește greșit un „eroare de diagnostic”. Prin urmare, majoritatea autorilor sunt de acord că acuratețea predicției greutății fetale trebuie utilizată cu precauție pentru deciziile de gestionare, în special pentru făturile mari pentru vârsta gestațională. 1.17 Utilizarea ultrasonografiei tridimensionale în estimarea greutății fetale este în curs de studiu și a fost revizuită în 2000. 25
Biologia moleculară a dezvoltării și bolii placentare
3.1 Disponibilitatea oxigenului și a nutrienților
Tabelul 1. Efectele incubației cu nutrienți, hormoni și citokine asupra transportului de aminoacizi mediat de sistemul A în celulele trofoblaste umane
| 400 μmol L - 1, 24 ore | PHT | ↑ 100% | 77 |
| 25 μmol L - 1, 24 ore | PHT | ↓ 40% | 78 |
| 50 μmol L - 1, 24 ore | PHT | ↓ 60% | |
| 100 μmol L - 1, 24 ore | PHT | Nu | |
| 0,5 vs 16,0 mmol L - 1, 24 ore | PHT | Nu | 79 |
| Aminoacizi neesențiali, 6 ore | BeWo | ↑ 225% † | 80 |
| Toți aminoacizii, 4 ore | BeWo | ↑ 600% † | 81 |
| 3% vs 20%, 24 de ore | PHT | ↓ 37% | 82 |
| 1% vs 20%, 24 de ore | PHT | ↓ 82% | |
| 0,6 ng mL - 1, 1 oră | PVF | ↑ 47% | 83 |
| 60 ng mL - 1,24 ore | PHT | ↑ 25% | 79 |
| 300 ng mL - 1,1 ore | PVF | ↑ 56% | 83 |
| 600 ng mL - 1,4 ore | PHT | ↑ 70% | 84 |
| 300 ng mL - 1,24 ore | PHT | ↑ 30% | 79 |
| 600 ng mL - 1,1 ore | PVF | Nu | 83 |
| 500 ng mL - 1,1 ore | PVF | ↑ 37% | 83 |
| 1000 ng mL - 1,1 ore | PVF | ↑ 45% | 85 |
| 10 pg mL - 1,24 ore | PHT | ↑ 60% | 86 |
| 20 pg mL - 1,24 ore | PHT | ↑ 100% | 87 |
| 10 pg mL - 1,24 ore | PHT | ↓ 27% | 88 |
| 5 μg mL - 1, 20 h | PHT | ↓ 58% | 89 |
| 340 ng mL - 1, 1 oră | PVF | Nu | 83 |
| 1000 nmol L - 1, 24 ore | BeWo | ↑ 125% † | 90 |
| 1000 nmol L - 1, 48 h | VE | ↑ 28% | 91 |
| 100 mmol - 1, 2 ore | PVF | ↑ 25% | 85 |
| 500 nmol - 1, 1 oră | PVF | ↓ 47% | 92 |
BeWo, linia celulară de coriocarcinom; PHT, trofoblast uman primar; PVF, fragmente viloase primare; VE, explant vilos; ↑, crescut, ↓, scăzut, Nu Δ, nicio modificare față de control, †, transport transcelular, #, insulină prezentă (1 nmol L - 1).
Masa 2. Efectul manipulărilor experimentale materne asupra sistemului placentar Capacitatea de transport a aminoacizilor, abundența de transport și greutatea fetală la termen scurt la rozătoare
| 30% grăsime D0-19 | Șoarece | Nu | Nu | Nu | 93 |
| 32% grăsime înainte de concepție | Șoarece | ↑ 900% | ↑ SNAT2 | ↑ 42% | 55 |
| 41% grăsime dinainte de concepție | Șoarece | ↑ 425% | ↑ SNAT2 | ↑ 29% | 25,95 |
| 80% D3 - D19 | Șoarece | ↑ 66% | ↑ Slc38a2 | ↓ 13% | 96,97 |
| 50% D10 - D19 | Șoarece | Nu | ↑ Slc38a1, Slc38a2 | ↓ 48% | 98 |
| 50% D0–20 | Război | ↓ 32% | ? | ↓ 15% | 99 |
| 18% vs 23% D3-19 | Șoarece | ↓ 25% | ↓ Slc38a4 | Nu | 100 |
| 9% vs 23% D3-19 | Șoarece | Nu | ↓ Slc38a1, Slc38a4 | ↓ 9% | |
| 4% vs 18% D2-21 | Război | ↓ 36% | ↓ SNAT1, SNAT2 | ↓ 23% | 101.102 e cel mai frecvent |
| 5% vs 20% D6-20 | Război | ↓ 48% * | ? | ↓ 21% | 39 |
| 5% vs 21% D0-21 | Război | ↓ 61% | ? | ↓ 28% | 103 |
| 13% vs 21% D14-19 | Șoarece | Nu | ↑ Slc38a1 | ↓ 5% | 104 |
| 10% vs 21% D14-19 | Șoarece | ↓ 39% | Nu | ↓ 9% | |
| s.c. D15-19 | Șoarece | ↓ 66% * | ↓ SNAT1, 2, 4 | ↓ 19% | 105 |
| s.c. D15-19 | Război | ↓ 30% | ↓ Slc38a2, ↓ SNAT2 | ↓ 7% | 106 |
| Orală D11-16 | Șoarece | ↑ 33% | ↓ Slc38a2 | ↓ 5% | 107 |
| Oral D14-19 | Șoarece | ↓ 46% | ↑ Slc38a1 | ↓ 16% | |
| Orală D11-16 | Șoarece | ↑ 75% | ↓ Slc38a2 | ↓ 5% | 108 |
| Oral D14-19 | Șoarece | Nu | Nu | ↓ 5% | |
| s.c. D14.15 | Șoarece | ↓ 46% | Nu | Nu | 29 |
s.c., subcutanat; ↑, crescut; ↓, scăzut; Nu Δ, nicio modificare față de control; *, măsurat ex vivo în vezicule cu membrană plasmatică trofoblastă.
Tulburări endocrine în timpul sarcinii
Evaluări în serie ale greutății fetale
Deoarece predicția greutății fetale dintr-un singur set de măsurători este inexactă, estimările seriale care arată tendința parametrilor ultrasonografici (de obicei realizate la fiecare 1,5 până la 3 săptămâni) ar putea oferi teoretic o estimare mai bună a percentilei de greutate reală. O comparație a eficacității calculelor seriale estimate ale greutății fetale cu o singură măsurare nu a arătat însă o precizie predictivă mai bună. Larsen și colab. (1995) au raportat că predicțiile bazate pe media estimărilor repetate ale greutății, pe extrapolarea liniară din două estimări sau pe extrapolare printr-o ecuație de ordinul doi adaptată la patru estimări nu au fost mai bune decât predicția din ultima estimare înainte de livrare . Rezultate similare (că o singură estimare este la fel de exactă ca evaluările multiple) au fost raportate de Hedriana și Moore (1994) .
Toxicologia pentru dezvoltare și reproducere a pesticidelor
12.5.2.12 Fenthion
O reducere a greutății fetale la 80 mg/kg a fost observată într-un studiu efectuat la șoareci, cu o creștere a malformațiilor la 14,5% din descendenți (Budreau și Singh, 1973a). Cu toate acestea, la șobolani s-a observat o creștere marginală a resorbțiilor la 18 mg/kg/zi, demonstrând alte efecte adverse asupra dezvoltării la doze mai mici, obținându-se o NOAEL = 4,2 mg/kg/zi. Expunerea la fenthion în dietă la 14 și 100 ppm în studiul de reproducere a demonstrat vacuolarea citoplasmatică epididimală (ECV) asociată cu fertilitatea scăzută, supraviețuirea redusă și întârzierea creșterii postnatale rezultând un NOAEL reproductiv = 2 ppm (CDPR, 2009).
Mortalitatea infantilă
Întârzierea creșterii intrauterine
IUGR se referă la greutatea fetală grav redusă pentru vârsta sa gestațională. În general, definită ca o greutate la naștere mai mică decât percentila 10 a greutății fetale prezise pentru vârsta sa gestațională, IUGR este asociată cu morbiditate și mortalitate neonatală crescută. Condiția poate fi cauzată de o varietate de căi, inclusiv circulația materno-fetală inadecvată, infecțiile intrauterine și anomaliile congenitale, cum ar fi trisomia 21 și trisomia 18. Cu toate acestea, IUGR poate reflecta și o nutriție maternă inadecvată, atât înainte, cât și în timpul sarcinii. IUGR crește riscul de morbiditate și mortalitate neonatală, în special dacă întârzierea creșterii este severă sau este asociată cu alte afecțiuni perinatale grave. Există, de asemenea, unele date recente care sugerează că copiii născuți cu IUGR chiar moderat pot întâmpina dificultăți cognitive sau metabolice subtile mai târziu în viață.
Epigenetica și cancerul, partea B
Kent L. Thornburg,. Mitchell S. Turker, în Advances in Genetics, 2010
I Introducere în programare
În ultimii 20 de ani, dovezile unei legături între condițiile de mediu în uter și riscul de boală la descendenți au crescut (Gluckman și colab., 2008). Ipoteza că mediul intrauterin afectează riscul de boală la vârsta adultă se bucură acum de un sprijin larg. În timp ce asocierile dintre creșterea fetală și boala adultă ulterioară pot reprezenta parțial efectele pleiotropice ale genelor transmise de la mamă la copil, modularea mediată de mamă a expresiei genice la descendenți, prin mediul pe care corpul unei mame îl oferă, pare să fie mai importantă decât o pură risc genetic ereditar. Asocierea dintre stresul de mediu în uter și evoluția bolii în viața ulterioară se numește „programare” (Barker, 1998; Thornburg și Louey, 2005). Mulți factori de stres care duc la programarea fetală au fost identificați, inclusiv factori nutriționali precum supra- și subnutriția, expunerea ridicată la corticosteroizi și hipoxia fetală. La modelele pe animale și studiile la om, de asemenea, malnutriția în diferitele sale forme afectează o serie de procese de dezvoltare care se manifestă ca boală la vârsta adultă.
Povestea de programare a început când echipa lui David Barker din Marea Britanie a arătat că riscul de mortalitate prin boală cardiacă ischemică era invers legat de greutatea la naștere a locuitorilor din Hertfordshire, Regatul Unit (Barker și colab., 1989). Această relație a arătat un efect gradat pe întregul spectru de greutate la naștere. Relația cu greutate mică la naștere - risc ridicat al bolii adulte este acum cunoscută ca fiind foarte puternică pentru multe afecțiuni cronice, inclusiv hipertensiune arterială, boală coronariană, diabet de tip 2 și osteoporoză (Gluckman și colab., 2008). La modelele animale, orice insultă care reduce fluxul de substanțe nutritive de la mamă la făt duce la descendenți programați care suferă tulburări cardiovasculare și metabolice pentru viață (McMillen și Robinson, 2005).
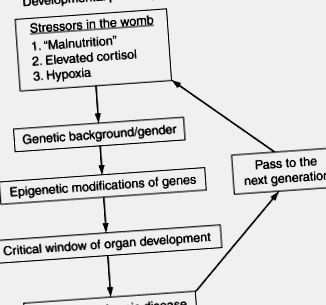
În timp ce legătura dintre fluxul de nutrienți și boala ulterioară este acum documentată în zeci de studii la om și animale (Gluckman și colab., 2008), mecanismele prin care factorii de stres de mediu din uter modifică embrionul și fătul în curs de dezvoltare rămân un mister (Fig. 3.1 ). Figura 3.1 prezintă, în formă schematică, etapele majore și modificatorii la care genomul este sensibil și care duc la programare. Pe de o parte, plasticitatea dezvoltării permite unui organism să se adapteze condițiilor de mediu pentru a-și îmbunătăți șansele de supraviețuire, dar, pe de altă parte, permite modificarea epigenomului în moduri care cresc riscul apariției bolilor cronice la adult. Deși acum este sigur că mecanismele epigenetice sunt importante în medierea efectelor durabile ale malnutriției fetale (Burdge și colab., 2007), nu se cunoaște măsura în care procesele epigenetice stau la baza bolilor cronice comune la om. De asemenea, nu se cunoaște măsura în care modificările epigenetice pot fi inversate după naștere.
Figura 3.1. Diagrama de flux care ilustrează procesul de programare. Plasticitatea dezvoltării permite o serie de opțiuni de exprimare a genelor în timpul dezvoltării. Stresori precum malnutriția, excesul de cortizol sau hipoxia pot duce la modificări ale expresiei genice în embrion care predispun descendenții la boli în viața ulterioară. Efectul asupra fătului va depinde de sexul său, de stadiul său de gestație, de mediul nutritiv și de fundalul său genetic. Descendenții de sex feminin pot da naștere la descendenți care sunt programați, repetând ciclul în generația următoare.
În plus față de mecanismele epigenetice, o altă adaptare la malnutriție la făt este „schimbul” de structuri anatomice care predispune apoi la boala ulterioară. Poate cel mai bun exemplu este reducerea numărului de nefroni care însoțește un stres nutrițional. Deoarece numărul de nefron în fiecare rinichi este stabilit înainte de naștere la multe animale și la oameni, o dotare de nefron inadecvată la naștere nu poate fi inversată în viața ulterioară. Variația numărului de nefron în rinichiul uman aparent normal este mare, variind de la aproximativ 300.000 la mai mult de 1,8 milioane (Zandi-Nejad și colab., 2006). Brenner a emis ipoteza că o reducere a numărului de nefron prezice riscul apariției hipertensiunii sistemice a adulților; studiile pe animale susțin în general această ipoteză (Zandi-Nejad și colab., 2006).
Modificări structurale suplimentare compromise la făt sunt asociate cu stările viitoare de boală și includ reduceri ale dimensiunii ficatului (Barker 2002; Gentili și colab., 2009), dotarea mușchilor scheletici (Baker și colab., 2010), elastină în vasele de sânge (Martyn și Greenwald, 1997) și numărul de cardiomiocite de lucru în inimă (Jonker și colab., 2010). Cu toate acestea, multe aspecte ale programării nu par a fi legate de schimbări în structura organelor. De exemplu, modificările apetitului, funcției creierului și metabolismului țesuturilor care însoțesc supra- și subnutriția în timpul vieții fetale par să implice modificări complicate, dar permanente, în procesele hormonale sau celulare. Pentru acestea, trebuie încă determinate mecanismele prin care interacționează genele și mediul.
Este norocos că relația dintre greutatea fetală și rezultatul bolii la adulți a fost suficient de robustă pentru a fi detectată în studiile timpurii ale lui Barker, deoarece a fost extrem de importantă în descoperirea procesului de programare. Acum se știe însă că mulți factori de stres conduc la programare fără a afecta greutatea fetală la naștere. Astfel, în orice categorie dată de greutate la naștere dintr-o populație, ar exista o serie de traiectorii de creștere pe care diferiți fetuși călătoresc pentru a câștiga acea greutate finală, ceea ce ridică posibilitatea ca și cohorte cu greutăți similare la naștere să aibă predispoziții distincte de boală. Pe măsură ce câmpul devine mai sofisticat, va fi, fără îndoială, posibil să se dezvăluie căile variate ale creșterii fetale care duc la diferite rezultate ale bolii. Acest proces de descoperire va include în mod necesar determinarea efectelor variațiilor genomului care predispun la efectele de programare. Există dovezi în creștere că fundalul genetic modifică efectele greutății la naștere asupra bolii ulterioare. Trei exemple vor ilustra diferite grade în care genomul și greutatea la naștere interacționează:
Eriksson și colab. (2002) au descoperit că polimorfismele Pro12Pro și Pro12Ala ale genei PPAR-γ2 au afectat rezistența la insulină la 152 de persoane în vârstă, în funcție de mărimea corpului lor la naștere. Polimorfismul Pro12Pro al genei PPAR-γ2 a fost asociat cu o rezistență crescută la insulină (P 2.
Într-un alt studiu, (Dennison și colab., 2001) densitatea minerală osoasă la nivelul coloanei vertebrale sa dovedit a fi mai mare în rândul persoanelor din genotipul BB care se aflau în cea mai mică treime a distribuției greutății la naștere, comparativ cu cele cu genotipul Bb sau bb ( P). 3.
Într-un studiu de cohortă asupra gemenilor de sex feminin (4000 de subiecți), s-a găsit o corelație intrapair semnificativă între greutatea la naștere și masa osoasă, chiar și între gemenii monozigoți (Antoniades și colab., 2003). Acest lucru sugerează că mediul intrauterin domină relația dintre greutatea la naștere și masa osoasă în comparație cu moștenirea genomică.
- Fructoza - o prezentare generală Subiecte ScienceDirect
- Citrullinemia - o prezentare generală Subiecte ScienceDirect
- Alimentele fermentate - o prezentare generală Subiecte ScienceDirect
- Chisturile coledocale - o prezentare generală Subiecte ScienceDirect
- Urticaria rece - o prezentare generală Subiecte ScienceDirect