1 Universitatea din California San Diego, Facultatea de Medicină, La Jolla, CA, SUA
2 Departamentul de Chirurgie, Divizia de Oncologie Chirurgică, Moores UCSD Cancer Center, Universitatea din California San Diego, La Jolla, CA, SUA
3 Departamentul de Medicină, Divizia de Gastroenterologie, Universitatea din California San Diego, La Jolla, CA, SUA
4 Departamentul de Patologie, Divizia de Patologie Chirurgică, Universitatea din California San Diego, San Diego, CA, SUA
* Autor corespondent: Jason K. Sicklick
Divizia de oncologie chirurgicală
Universitatea din California, 3855 Health Sciences Drive
Camera 2313, La Jolla, CA 92093-0987, SUA
Tel: 858-822-3967
Fax: 858-228-5153
E-mail: [e-mail protejat]
Data primirii: 27 iunie 2014; Data acceptată: 18 septembrie 2014; Data publicării: 25 septembrie 2014
Citare: Eshagh K, Reid C, Chan M, Lin G, Savides T și colab. (2014) Groove Pancreatita: o mascaradă malignă în Duoden. J Gastroint Dig Syst 4: 217. doi: 10.4172/2161-069X.1000217
Vizitați pentru mai multe articole similare la Journal of Gastrointestinal & Digestive System
Abstract
Abstract
Cuvinte cheie
Pancreatită groove; Distrofia chistică a pancreasului heterotopic; Hamartom pancreatic al duodenului; Chistul peretelui para-duodenal; Mioadenomatoza; GIST; tumoare stromală gastro-intestinală; Hiperplazia glandei Brunner
Introducere
Pancreatita groove (GP) este o formă rară de pancreatită cronică care a fost descrisă de mai multe nume, inclusiv chistul para-duodenal al peretelui, hamartomul pancreatic al duodenului, distrofia chistică a pancreasului heterotopic și mioadenomatoza. GP este cel mai frecvent la bărbații cu vârsta cuprinsă între 40-50 de ani, cu antecedente de alcoolism și/sau fumat, care prezintă dureri abdominale, vărsături și pierderea în greutate. Imagistica relevă de obicei stenoza duodenală și leziuni chistice în apropierea capului pancreasului [1]. Această formă de pancreatită focală cronică afectează „canelura” dintre duoden, căile biliare comune și capul pancreatic. Se crede că este cauzată de obstrucția minoră funcțională și/sau anatomică a papilei din secrețiile pancreatice vâscoase [2]. Cel mai frecvent, acest lucru se datorează alcoolului sau fumatului. La rândul său, există scăderea fluxului de enzime pancreatice, proliferarea glandei Brunner și pancreatita rezultată [3]. Pancreasul heterotopic din duoden și boala ulcerului peptic sunt, de asemenea, posibili factori care contribuie. Spre deosebire de pancreatita cronică, nu există o asociere cunoscută între pancreatita groove, boala autoimună sau calculii biliari [4].
Modalitățile de diagnosticare a imaginii la alegere includ CT și endoscopie superioară cu EUS. CT arată de obicei un perete duodenal chistic și inflamație locală. Imagistica endoscopică poate dezvălui mucoasa duodenală inflamată cu stenoză luminală. Pe EUS, chisturile se găsesc în canelură și peretele duodenal [3,5]. În ciuda constatărilor menționate anterior, diagnosticarea țesuturilor este adesea dificilă datorită eterogenității celulelor din peretele duodenal și chisturile para-duodenale.
Materiale și metode
Raportul unui caz
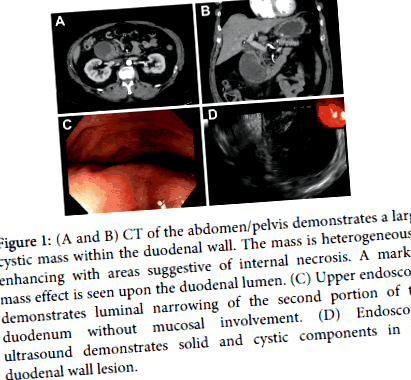
Figura 1: (A și B) CT al abdomenului/pelvisului demonstrează o masă chistică mare în peretele duodenal. Masa se îmbunătățește eterogen cu zone sugestive de necroză internă. Pe lumenul duodenal se observă un efect de masă marcat. (C) Endoscopia superioară demonstrează îngustarea luminală a celei de-a doua porțiuni a duodenului fără afectarea mucoasei. (D) Ecografia endoscopică demonstrează componente solide și chistice în leziunea peretelui duodenal.
Figura 2: (A) Fotomicrografia specimenelor citologice demonstrează focarele celulelor fusului în fundalul epiteliului intestinal normal (Diff-Quick, 200x). (B) Aspiratele repetate demonstrează focarele celulelor ax-la-epitelioide (Diff-Quick, 400x). (C) Fotomicrografia specimenului rezecat relevă peretele chistului adiacent pancreasului, care are dovezi de fibroză și pancreatită cronică (H&E, 20x). (D și E) Fotomicrografiile specimenului rezecat dezvăluie o masă chistică adiacentă mucoasei duodenale normale (H&E, 20x). (F) Fotomicrografii ale proliferării celulelor fusiforme mioidale (de exemplu, stromale) la porțiunea inferioară a imaginii, care este cel mai compatibilă cu miofibroblaste și fibroblaste, precum și zone focale care conțin macrofage încărcate cu hemosiderină (H&E, 200x).
Discuţie
Provocarea diagnosticării pancreatitei groove rezidă preoperator în ambiguitatea constatărilor imagistice și a variabilității citologice. Citologia poate demonstra celule fusiforme, macrofage încărcate cu lipide și/sau resturi [6]. De fapt, în funcție de zona eșantionată, caracteristicile pot fi sugestive pentru patologia benignă, cum ar fi hiperplazia glandei Brunner (BGH) sau tumorile submucoase (SMT), cum ar fi tumoarea stromală gastro-intestinală (GIST), leiomiomul și schwannomul. GIST are cel mai adesea histologie cu celule fusiforme, dar poate avea și caracteristici epitelioide sau mixte. Markerii includ de obicei KIT (CD117) și actină musculară netedă. Un factor distinctiv major între GIST și alte SMT este că acestea din urmă sunt aproape uniform negative pentru KIT. Cu toate acestea, aproximativ unul din douăzeci de GIST sunt, de asemenea, KIT-negative. Astfel, markerul Descoperit pe GIST-1 (DOG-1) poate ajuta la distingerea acestor SMT-uri.
Prezența glandelor Brunner pe biopsii poate duce la diagnosticarea greșită a BGH. Acest lucru poate fi prezent într-un mod similar cu GP, deoarece există glande Brunner excesive. Cu toate acestea, se crede că BGH este cauzată de hiperactivitatea factorilor de modulare exocrină, incluzând factorul nervului vag și al membranei mucoasei intestinale [7], precum și hipersecreția acidului gastric și scăderea secreției enzimei pancreatice [2]. Endoscopic, BGH prezintă leziuni nodulare, mai degrabă decât chistice, în submucoasa duodenală [8]. În timp ce hiperplazia glandei Brunner este adesea asimptomatică, nu există un consens în ceea ce privește rezecția (adică, pancreaticoduodenectomia), cu excepția cazului în care pacienții dezvoltă simptomatologie severă, cum ar fi durerea abdominală sau hemoragia.
În cazurile de medicină generală secundară alcoolului, tratamentul este un tratament conservator; nul pentru os, analgezie, nutriție parenterală și încetarea alcoolului. La pacienții cu GP secundare unor anomalii anatomice sau refractari la un tratament conservator, pancreaticoduodenectomia este recomandată la aproximativ 75% dintre pacienții cu ameliorare completă a simptomelor postoperator [3].
Concluzie
În rezumat, GP este o tulburare rară care imită adesea tumorile duodenale submucoase și tumorile periampulare maligne care prezintă icter obstructiv. Terapia chirurgicală rămâne standardul de aur pentru tratamentul acestei boli atunci când sunt prezente simptome și obstrucție. De la rezecție, pacientul nostru tolerează o dietă, iar greutatea sa este stabilă.
- Diaree și coagulopatie simptomatică o prezentare mai puțin frecventă a bolii celiace OMICS International
- Dieta face ca oamenii să se îngrașe OMICS International
- Dietă; Modificări ale stilului de viață pentru studenții internaționali
- Dieta cu pancreatită - Dietonus
- Scara fobiei grase a revizuit forma scurtă International Journal of Obesity