Abstract
fundal
Regimul de hrănire restricționat în timp (TRF), adică fără consum de alimente timp de 14-16 ore în timpul fazei ușoare pe zi, atenuează trăsăturile de îngrășare și tulburările metabolice la adulți. Acest studiu își propune să investigheze în continuare dacă TRF ar fi protector împotriva provocărilor nutriționale similare la șoarecii juvenili.
Metode
Șoarecii din grupul experimental au fost tratați cu TRF în primele 4 săptămâni (considerate a fi faza copilăriei șoarecilor) înainte de a trece la modelul de hrănire ad libitum (AD) ca adulți; grupul de control cu toți subiecții rămâne în modul AD. Greutatea corporală a fost monitorizată, iar biochimia serică, maturitatea sexuală, funcția imună și microbiota intestinală au fost evaluate la un anumit moment.
Rezultate
Șoarecii tratați cu TRF în timpul copilăriei (de la vârsta înțărcării), dar au trecut prin tiparul de hrănire AD, deoarece adulții au demonstrat tendința de greutate corporală mai mare, niveluri mai ridicate de glucoză serică, insulele Langerhans micșorate, boli ale ficatului gras, îngroșarea pereților aortici, dezvoltarea sexuală întârziată, proporție crescută de celule T reglatoare și microbiota intestinală nesănătoasă.
Concluzie
TRF din copilărie provoacă efecte adverse pleiotropice, inclusiv tulburări metabolice ireversibile severe, funcție imună deprimată și pubertate întârziată. Microbiota a stabilit scena pentru ca TRF să utilizeze reacții în aval la modificările de mai sus.
Introducere
Prevalența mondială a sindromului metabolic a crescut semnificativ în ultimele decenii, provocând o mare amenințare atât pentru populația adultă, cât și pentru cea infantilă. Homeostazia glucozei, hipertensiunea și dislipidemia, supraponderale, afectate adesea de boli cardiovasculare, diabet zaharat, boli neurodegenerative și probleme de fertilitate, au devenit împreună o povară majoră pentru toate societățile1 și ar putea duce chiar la întârzierea diagnosticării bolilor severe crește riscul de boli canceroase. 2 Exercițiile fizice, intervențiile chirurgicale bariatrice și regimurile dietetice, inclusiv restricția calorică, restricția de energie intermitentă și hrănirea restricționată în timp (TRF) sunt intervenții eficiente pentru obezitate și sindromul metabolic la adulți. 3 În plus, postul poate reduce obezitatea și bolile legate de obezitate, dar poate oferi și beneficii sistemului neurologic și duratei de viață. 4.5
Deși fiziologia copiilor este diferită de adulți, toate studiile TRF anterioare s-au concentrat asupra adulților. Prin urmare, consecințele TRF la copii sunt necunoscute. Având în vedere trăsăturile fiziologice unice ale copiilor, am fost extrem de precauți în ceea ce privește extrapolarea efectelor pozitive ale TRF observate la adulți. Studiul actual oferă dovezi pentru utilizarea TRF în politica și practica medicală în populația pediatrică. Studii suplimentare ar trebui să traducă descoperirile fiziologice dăunătoare observate la șoareci la oameni, care vor oferi informații factorilor de decizie în ceea ce privește dieta adecvată pentru generația mai tânără.
Materiale și metode
Animale
Toate experimentele pe animale au fost efectuate în conformitate cu ghidurile Comitetului instituțional de îngrijire și utilizare a animalelor de la Institutul Salk. Îngrijirea experimentală a animalelor a fost efectuată cu permisiunea Comitetului pentru bunăstarea animalelor din Spitalul Universitar Medical Medical din Uniunea Beijing (permisiunea nr. XHDW-2015-1098). Șoarecii masculi Kunming (Beijing Vital River Laboratory Animal Technology Co., Ltd. (4 Yangshan Road, Beijing, China)) la vârsta de 3 săptămâni (vârsta înțărcării) au fost antrenați la un ciclu de lumină-întuneric 12:12. Intervenția a început după aclimatizare cu hrana normală disponibilă ad libitum (AD) timp de 1 săptămână. Săptămâna 0: șoarecii aveau 4 săptămâni (3 săptămâni de alăptare + 1 săptămână dietă normală de chow pentru aclimatizare). Săptămâna 4: șoarecii aveau 8 săptămâni și modelul lor de hrănire a fost schimbat în metoda experimentală. Săptămâna 4 a fost luată în considerare atunci când șoarecii juvenili s-au dezvoltat în șoareci adulți. Săptămâna 8: șoarecii aveau vârsta de 12 săptămâni, iar principalele rezultate au fost colectate și analizate.
Program de hrănire și diete
În săptămâna 0, șoarecii au fost repartizați aleatoriu la două regimuri de hrănire. În grupul experimental, șoarecii au urmat modelul TRF, în timp ce șoarecii din grupul de control au avut acces la alimentele AD. Conform TRF, șoarecilor li s-a permis accesul la alimente între ora 13 (ZT 13) (ZT 0: luminile aprinse; ZT 13: 1 h după aprinderea luminilor) și ZT 21 (3 ore înainte de aprinderea luminilor).
Aportul caloric nu a fost restricționat în niciunul dintre regimuri. Ambele regimuri au folosit chow normal (GB14924.3-2010 Standard: 29% proteine, 13% grăsimi și 58% carbohidrați) (prin referință: LabDiet-5010). Mâncarea a fost completată la ZT 13 în fiecare seară pentru a asigura o cantitate adecvată de hrană disponibilă pentru fiecare cușcă.
Definiția grupurilor experimentale și de control: Șoarecii TRF - AD (TA) au urmat TRF în primele 4 săptămâni (5-8 săptămâni după naștere, după aclimatizare), care a fost considerată perioada juvenilă. După 4 săptămâni, juvenilul s-a transformat în șoareci adulți și li s-a permis hrana AD. Șoarecii AD-AD (AA) au fost desemnați ca grup de control și toți indivizii au fost hrăniți cu AD. Grupul TRF-TRF (TT) a fost forțat să postească pe parcursul unei perioade de 16 ore zilnic pe tot parcursul experimentului.
Consumul și greutatea alimentelor
Cantitatea de alimente consumate pentru fiecare cușcă a fost cântărită în fiecare zi la ZT 21, iar greutatea corporală a fost monitorizată săptămânal.
Biochimie serică
Sângele a fost obținut la ZT 21 (începutul perioadei de post pentru TRF). Testul imunosorbent legat de enzime a fost utilizat pentru a măsura concentrația insulinei serice, a trigliceridelor (TG), a colesterolului total (TC), a lipoproteinelor cu densitate mică (LDL), a lipoproteinelor cu densitate ridicată (HDL), a leptinei, a grelinei, a peptidei YY (PYY), peptida 1 asemănătoare glucagonului (GLP-1), hormonul care eliberează gonadotropina (GnRH), hormonul foliculostimulant (FSH), hormonul luteinizant (LH), androgenul și estrogenul (E). Nivelurile de glucoză din sânge au fost măsurate cu un glucometru OneTouch Ultra la ZT 13 și ZT 21.
Studiu histologic
Inima, ficatul și pancreasul au fost izolate de la șoareci la ZT 21 (săptămâna 8) și fixate în soluție de formaldehidă. Eșantioanele au fost secționate și colorate cu o metodă standard de colorare hematoxilină - eozină (H&E).
Analiza citometriei de flux
Cantitatea de celule T reglatoare (Tregs) a fost determinată prin citometrie în flux după cum urmează: (1) sângele integral a fost colectat la ZT 21 în prezența unui anticoagulant; (2) celulele au fost stimulate și incubate la 37 ° C timp de 30 de minute; (3) celulele au fost spălate și permeabilizate; (4) celulele au fost resuspendate în tampon de colorare la o concentrație finală de 5-10 × 106 celule/ml; (5) Au fost adăugați anticorpi Phosflow - anti-CD4 conjugat cu fluoresceină izotiocianat, anti-CD25 conjugat cu aloficocianină, anti-Foxp3 conjugat cu ficoeritrină - și incubat timp de 60 min în întuneric; (6) celulele au fost spălate, centrifugate și supernatantul a fost decantat; (7) celulele au fost resuspendate înainte de analiza citometrică în flux; și (7) citometrul cu flux C6 (BD Accuri) a fost utilizat pentru a identifica compoziția limfocitelor.
Extracția ADN-ului metagenomic și secvențierea ARNr 16S
Trei șoareci (din cuști diferite) din fiecare grup de hrănire au fost sacrificați la ZT 21 (săptămâna 8). Ceca individuală de șoarece a fost izolată din rect și înghețată rapid. Ceca au fost apoi resuspendate și digerate înainte de liză. ADN-ul din lizat a fost extras, precipitat, spălat și resuspendat. Etichetele de secvență a genei ARNr 16S, corespunzătoare regiunii hipervariabile V1 - V3, au fost generate folosind platforma 454 de pirozecvenție. Clasificarea bazată pe unitatea taxonomică operațională (OTU) a fost utilizată pentru a genera profiluri de date. Pentru a dobândi o înțelegere generală a microbiotei, s-au efectuat analize ale diversității α și β, predominant pentru a arăta diversitatea între și în cadrul grupurilor.
analize statistice
Datele au fost analizate de Stata/MP 14.0. Toate datele distribuite în mod normal au fost afișate ca medie ± s.e.m. Comparațiile dintre cele două grupuri au fost efectuate de către Student’s t Test. O valoare de p
Rezultate
TRF din copilărie a provocat tulburări metabolice
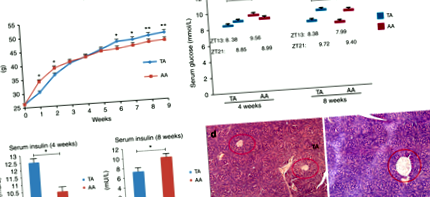
Greutate corporala (Fig. 1a): Șoarecii TA au demonstrat pierderea în greutate sub intervenția TRF, dar au fost mai obezi când li s-a permis să mănânce AD la vârsta adultă. Deși greutatea grupului TA a fost, în general, mai mică decât grupa AA în primele 4 săptămâni, greutatea medie a șoarecilor din grupurile TA și AA nu a fost semnificativ diferită (40,08 ± 0,90 vs. 40,71 ± 0,68 g, p = 0,30; n = 40). S-a măsurat cantitatea de alimente consumate de șoareci în ambele grupuri, totuși nu a fost dezvăluită nicio diferență semnificativă la sfârșitul săptămânii 4 atunci când s-a comparat grupul TA cu grupul AA: 5,16 ± 0,20 vs. 5,20 ± 0,18 g/zi. Cu toate acestea, greutățile șoarecilor din grupul TA au crescut după săptămâna 4 și au rămas ridicate până la sfârșitul experimentului. În săptămânile 8 și 14, ponderile medii ale grupurilor TA și AA au fost de 47,1 ± 0,82 vs. 45,0 ± 0,93 g (p FIG. 1
Metabolismul glucozei: Înainte de a schimba tiparul de hrănire în grupul TA (sfârșitul săptămânii 4), nivelurile medii de glucoză din sânge pentru grupurile TA și AA erau 8,38 ± 0,39 și 9,56 ± 0,34 mmol/L la ZT 13 (TA mai mică decât AA, p FIG. 2
Concentrațiile serice de lipide și studiul histologic al rădăcinii și ficatului aortic. A Nivelurile lipidice serice la sfârșitul săptămânii 8. nTA = 13, nAA = 6. b Rădăcini aortice colorate cu H & E de la șoareci TA și AA sub mărire 10 × 10 (i și ii) și 10 × 20 (iii și iv). (i) și (iii): grup TA; (ii) și (iv): grup AA. c Secțiuni histologice reprezentative ale ficatului colorate cu H & E: stânga, grup TA; dreapta, grup AA (mărire 10 × 20)
Modificări ale hormonilor digestivi și peptidelor
(1) Leptina: În săptămâna 8, concentrațiile serice de leptină în grupul TA au fost de 849,48 ± 86,55 pg/ml, care au fost ușor mai mari decât în grupul AA, 808,33 ± 124,99 pg/ml (p = 0,263). (2) Grelina: În săptămâna 4, grelina în grupul experimental a fost semnificativ mai mare (1325 ± 60 ng/L) decât în grupul martor (1053 ± 39 ng/L)p FIG. 3
Șoarecii TA au prezentat o maturitate sexuală retardată și o funcție imună deprimată
Dezvoltarea sexuală: În ziua 27, trei șoareci AD au prezentat testicule mărite. Deoarece testiculele sunt eliptice, am măsurat cel mai mare diametru și am definit „testiculele mărite” ca ≥8 mm. Folosind acest standard, am numărat numărul șoarecilor sub TRF sau AD cu „dezvoltarea testiculului” (Fig. 4a). Până în ziua 31, toți șoarecii aveau testicule mature. Șoarecii TA au fost mai predispuși să aibă o întârziere a dezvoltării în comparație cu grupul AA. Prelevarea de sânge pentru măsurarea hormonilor sexuali a fost efectuată în ziua 32, deoarece acest punct de timp a furnizat cele mai bune dovezi ale dezvoltării sexuale pe baza modificărilor dimensiunii testiculului. Datele au fost foarte consistente: niveluri ridicate de GnRH, FSH, LH și niveluri scăzute de hormoni din aval, inclusiv androgen și estrogen, au fost observate în grupul TA (toate p FIG. 4
Celulele Treg: În săptămâna 8, am folosit probe proaspete de sânge periferic pentru a măsura procentul de CD4 + CD25 + Foxp3 + Treg în toate limfocitele. Procentul mediu Treg (Treg%) pentru grupul TA a fost de 6,78 ± 1,41% și 2,69 ± 0,31% pentru grupul AAn = 6, p FIG. 5
Analiza microbiotei intestinale în săptămâna 8. A Analiza componentelor principale (PCA) a tuturor subiecților. b α Diversitatea grupurilor prin analiza Shannon (p = 0,24). c Arborele taxa al speciilor de bacterii pe grupe. d Top 10 bacterii din abundență sub filum, clasă, ordine și nivel familial al grupurilor TA și AA. e Taxa-heatmap sub nivelul genului fiecărui subiect analizat (n = 6)
Continuarea TRF la vârsta adultă nu a reușit să inverseze deficiențele existente
Continuarea TRF de-a lungul maturității nu a inversat deficiențele existente ale șoarecilor care au suferit TRF în primele 4 săptămâni. (i) Insulele Langerhans din pancreas au fost mai mici, cu o rază medie similară grupului TA. (ii) Modificările grase au fost mai severe în comparație cu grupul TA. (iii) Peretele rigid și îngroșat al vasului rădăcinii aortice (Fig. 6a). Patru valori ale rezultatelor au arătat diferențe semnificative: greutatea medie a șoarecilor TT a fost mai mică (45,5 ± 1,01 g) decât în grupul TA (47,1 ± 0,82 g; n = 40; p FIG. 6
Indicatori de rezultat al șoarecilor sub TRF atât la copii, cât și la adulți. A Secțiuni histologice colorate cu H & E ale organelor și țesuturilor de la șoareci TT. (i) Pancreas, cercurile roșii indică insulele Langerhans (mărire 10 × 10), (ii) ficat (mărire 10 × 10) și (iii) rădăcină aortică, săgeata albastră indică peretele vasului (mărire 10 × 4). b Valorile TT comparativ cu TA în săptămâna 8 (cu excepția greutății în săptămâna 14). Semnificația statistică este indicată cu roșu. TT hrănire restricționată în timp ca un copil și adult
Discuţie
Acest studiu a avut unele limitări. Ca studiu pilot anterior unei investigații a TRF la copii umani, rezultatele noastre au fost neașteptate. Rezultatele studiilor patologice nu au fost cuantificate științific: pancreasul nu a fost secționat într-un model standardizat pentru a calcula volumul insulelor Langerhans, iar severitatea bolii ficatului gras nu a fost indicată prin evaluare sistemică. Fenotiparea metabolică nu a fost efectuată cu atenție, iar rezultatele nu au fost repetate în mod adecvat din cauza dimensiunii probei. Celălalt defect este că nivelul seric al leptinei nu a fost ajustat prin conținutul de grăsime prin imagistica prin rezonanță magnetică. 16
Concluzie
Acesta este primul studiu al TRF în copilărie. Am constatat că TRF a indus daune ireversibile la șoareci care implică tulburări metabolice, riscuri cardiovasculare crescute, funcția imună suprimată și întârzierea dezvoltării sexuale. Microbiota a mediat aceste efecte din aval ale TRF. Aceste rezultate dăunătoare și efectele de moștenire persistente indică faptul că TRF nu trebuie utilizat la copii, dar sunt necesare investigații mecaniciste suplimentare pentru a înțelege pe deplin rețeaua dintre diete, microbiota intestinală, metabolismul și biologia dezvoltării. Este important să reamintim autorităților de sănătate publică că merită luate în considerare îndrumările referitoare la cantitatea și calendarul meselor pentru copiii de vârstă școlară.
- Occidentalizarea stilului de viață cauzează tulburări metabolice asociate obezității la japonezi
- Consumul de timp restricționat poate îmbunătăți sindromul metabolic - Consilier în endocrinologie
- Carduri de antrenament pe module; Tulburări metabolice; Quizlet
- Tulburări vestibulare Simptome, cauze și tratamente
- Ce este acidoză metabolică Cauze, simptome, tratamente - Insider