Duk-Hee Lee
1 Departamentul de Medicină Preventivă și Centrul de Cercetare pentru Promovarea Sănătății, Școala de Medicină, Universitatea Națională Kyungpook, Daegu, Coreea
David R. Jacobs, Jr.
2 Divizia de Epidemiologie, Școala de Sănătate Publică, Universitatea din Minnesota, Minneapolis, Minnesota, SUA
3 Departamentul de nutriție, Universitatea din Oslo, Oslo, Norvegia
Miquel Porta
4 Institut Municipal d’Investigació Mèdica și Facultatea de Medicină, Universitat Autònoma de Barcelona, Barcelona, Spania
Abstract
fundal
Deși atât nutriția, cât și substanțele chimice sunt factori importanți de mediu care modulează modificările epigenetice, acestea sunt studiate în mod obișnuit separat de cercetători din diferite domenii. Cu toate acestea, acești doi factori de mediu nu pot fi separați unul de celălalt în lumea reală, deoarece un număr de agenți chimici contaminează lanțurile alimentare.
Obiectiv
Propunem un mecanism de unificare care poate lega modificările epigenetice în raport cu hipometilarea ADN datorită agenților chimici și a deficitului sau dezechilibrului de nutrienți, subliniind importanța unei abordări integratoare în domeniul epidemiologiei mediului.
Discuţie
Pentru metilarea ADN sunt necesare grupări metil din S-adenosilmetionină (SAM). Dietele sărace în surse de grupări metil pot duce la hipometilare globală a ADN-ului prin afectarea sintezei SAM. Cu toate acestea, chiar și fără deficiență nutrițională, necesitatea sporită de a sintetiza glutathi-one (GSH) poate afecta sinteza SAM și perturba metilarea ADN, deoarece ciclul de metilare și căile de sinteză GSH sunt legate biochimic. Expunerea la substanțe chimice de mediu este o situație comună în care nevoia de sinteză a GSH este sporită, deoarece GSH este consumat pentru a conjuga diverse substanțe chimice. Având în vedere că conjugarea GSH are loc la orice doză chimică, această ipoteză este relevantă chiar și la expuneri sub dozele mari care determină răspunsuri toxicologice.
Concluzie
În prezent, populațiile generale sunt expuse la un număr mare de substanțe chimice, fiecare la o doză foarte mică. Astfel, hipometilarea ADN datorită expunerii chimice poate fi comună în societățile moderne și poate interacționa sinergic cu hipometilarea ADN-ului indusă de nutriție.
Epigenetica este studiul modificărilor ereditare induse de meiotică și mitotică în expresia genelor prin metilarea ADN-ului, modificări ale histonelor sau modificări ale microARN-ului fără modificări reale în secvența ADN genomică (Feinberg 2007; Ozanne și Constancia 2007). Deoarece expresia genică este influențată de diverși factori de mediu, epigenetica poate servi ca o interfață între genomul static moștenit și mediul dinamic (Feinberg 2007; Ozanne și Constancia 2007), prezentând provocări imense pentru epidemiologia mediului (Porta 2008).
Acolo unde dereglarea epigenetică este din ce în ce mai implicată în cancer, rolul epigeneticii în alte boli cronice complexe, cum ar fi bolile cardiovasculare, diabetul de tip 2 și obezitatea, rămâne în mare parte necaracterizat. Până în prezent, eforturile de cercetare privind cauzele modificărilor epigenetice s-au concentrat asupra nutriției în timpul sarcinii ca influențe primare ale tiparelor epigenetice în copilărie și maturitate (Mathers 2007). În special, aplicând teoria originii fetale a bolilor adulte, greutatea scăzută la naștere din cauza subnutriției este ipotezată pentru a explica parțial epidemiile în curs de desfășurare ale sindromului metabolic și ale diabetului de tip 2 - de exemplu, în țările în curs de dezvoltare precum India sau China (Yajnik 2004) . Expunerea preconcepțională la foamete în timpul iernii olandeze a foamei din 1944-1945 s-a dovedit recent a fi asociată cu hipometilarea genei factorului de creștere 2 asemănător insulinei (IGF2) șase decenii mai târziu (Heijmans și colab. 2008). Deoarece IGF2 joacă un rol cheie în creșterea mamiferelor, influențând diviziunea și diferențierea celulară și, eventual, reglarea metabolică (O'Dell și Day 1998), studiul a oferit sprijin empiric pentru ipoteza că subnutriția în timpul sarcinii crește riscul apariției bolilor adulte prin epigenetică. modularea. expresiei genelor (Gluckman și colab. 2008).
Pe de altă parte, se evidențiază, de asemenea, că diverși agenți chimici de mediu obișnuiți, inclusiv unii perturbatori endocrini, pot afecta procesele epigenetice normale de dezvoltare și, prin urmare, pot contribui la creșterea riscului de boli cronice la adulți (Edwards și Myers 2007). Din păcate, modificările epigenetice datorate acestor două tipuri importante de factori de mediu - nutriția și substanțele chimice - tind să fie studiate separat de cercetătorii din diferite domenii.
Deoarece numeroși agenți chimici contaminează lanțurile alimentare, totuși, acești doi factori de mediu nu pot fi separați unul de celălalt în lumea reală. Mai mult, acești factori pot provoca sinergic modificări epigenetice printr-o cale comună, așa cum am ipotezat mai jos. Epidemiologia mediului este o zonă de studiu unică care observă în mod liber populațiile umane vii și încearcă atât să descurce, cât și să integreze procese etiopatogene complexe care implică factori de risc foarte diversi. Prin urmare, este esențial pentru progresul științific să înțelegem mai bine cum pot fi legate nutriția și substanțele chimice sintetice.
Hipometilarea ADN-ului printr-un mecanism de unificare
Hipometilarea globală a genomului afectează în mare măsură regiunile intergenice și intronice ale ADN-ului, în special secvențele repetate și elementele transpozabile și se crede că va duce la instabilitate cromozomială și evenimente de mutație crescute (Wilson și colab. 2007). În ceea ce privește tipul de țesut, cancerele umane au în comun atât hipometilarea genomică globală, cât și hipo- și hipermetilarea insulei CpG focale (Franco și colab. 2007). În plus, hipometilarea globală este, de asemenea, asociată cu alte boli, cum ar fi ateroscleroza (Zaina și colab. 2005). Aici, propunem un mecanism de unificare care poate lega modificările epigenetice în raport cu hipometilarea globală sau focală a ADN datorită agenților chimici și a deficitului sau dezechilibrului de nutrienți, care a fost puțin luat în considerare în rândul epidemiologilor și altor cercetători. Nu credem că mecanismul nostru ipotetic poate explica toate mecanismele epigenetice, inclusiv hipermetilarea focală a ADN-ului în gene specifice, deși expunerile chimice și deficiența sau dezechilibrul nutrițional duc probabil la alte modificări epigenetice prin mecanisme necunoscute.
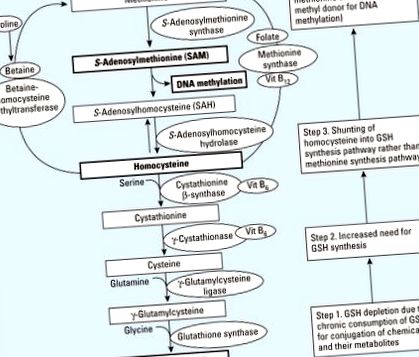
SAM (S-adenosilmetionina) este un donator de metil critic pentru majoritatea metiltransferazelor care modifică ADN, ARN, histone și alte proteine (Loenen 2006). Folatul, metionina, betaina, colina și vitamina B12 sunt implicate în metabolismul cu un singur carbon, care include metilarea substrată SAM (Mason 2003). Astfel, dietele lipsite de substraturi sau cofactori în metabolismul cu un singur carbon pot contribui la hipometilarea ADN prin afectarea sintezei SAM (Davis și Uthus 2004; Selhub 2002). Acest ciclu de metilare (Figura 1, sus) este foarte bine cunoscut și citat frecvent pentru a explica relația dintre dietă și modificările epigenetice. Cu toate acestea, chiar și fără deficiența nutrițională a grupărilor metil, se poate produce sinteza afectată a SAM și metilarea perturbată a ADN-ului atunci când crește nevoia de sinteză a glutationului (GSH) (Figura 1, jos).
Un mecanism ipotetic de unire care leagă hipometilarea ADN datorită deficitului sau dezechilibrului de substanțe chimice și nutrienți. Vit, vitamina. Modelul de metilare a ADN-ului poate fi deranjat din cauza epuizării GSH atunci când este consumat cronic pentru conjugarea substanțelor chimice și a metaboliților acestora. În circumstanțe obișnuite, metabolismul homocisteinei contribuie atât la căile de sinteză ale metioninei, cât și ale GSH. În prezența substanțelor chimice precum poluanții organici persistenți care epuizează GSH, contribuția la calea metioninei poate fi diminuată din cauza nevoii mai mari de a sintetiza GSH (casete numerotate în dreapta).
Expunerea la compuși chimici poate fi o situație comună în care oamenii au nevoie de mai mult GSH (Jones și colab. 1995). GSH și GSH transferazele au evoluat ca o protecție chimică majoră împotriva xenobioticelor reactive și a compușilor reactivi produși în timpul metabolismului compușilor endogeni și exogeni (Ketterer și colab. 1983). Transferazele GSH au specificități de substrat largi și suprapuse, care le permit să participe la detoxifierea unui grup de compuși chimic divers. Cele mai frecvente reacții implică atacul nucleofil al GSH asupra electrofililor, de obicei epoxizi ai compușilor organici aromatici și alifatici (Coles și Ketterer 1990). Aceste substraturi au în comun un grad de hidrofobie și posedă centre electrofile (Coles și Ketterer 1990).
Studiile experimentale au raportat că expunerea la substanțe chimice a crescut conținutul de GSH prin îmbunătățirea absorbției substraturilor de aminoacizi și a activității enzimelor biosintetice (Franco și colab. 2007; Shi și colab. 1994) ca mecanism de adaptare împotriva expunerii pe termen scurt la substanțe chimice. Nevoia crescută de GSH reduce disponibilitatea homocisteinei, care se află la intersecția dintre ciclul de metilare și calea transsulfurării, pentru utilizare în ciclul de metilare. În cele din urmă, prin trecerea homocisteinei în calea de sinteză GSH, nivelurile de metionină și SAM ar scădea (Figura 1).
Dacă expunerea la substanțe chimice este tranzitorie, toate aceste tulburări pot reveni rapid la normal, fără a progresa la nivelurile de epuizare GSH. Cu toate acestea, atunci când există o expunere prelungită la substanțe chimice, aceasta poate progresa până la epuizarea GSH intracelular prin consumul de GSH prin conjugare (Franco și colab. 2007). Multe studii de teren asupra organismelor acvatice care trăiesc în zone poluate au raportat scăderea conținutului de GSH comparativ cu cele din zonele nepoluate (Cossu și colab. 1997; Otto și Moon 1996). Spre deosebire de experimentele in vitro sau animale, în care modelele de expunere la substanțe chimice nu sunt similare cu cele ale oamenilor cu viață liberă în ceea ce privește durata expunerii sau numărul de substanțe chimice, studiile naturaliste de teren pot oferi informații relevante pentru răspunsul fiziologic la expunerea de fond la substanțe mixte xenobiotice.
Există dovezi experimentale directe că epuizarea GSH scade nivelul SAM în celule și duce la hipometilarea ADN-ului la nivelul întregului genom (Lertratanangkoon și colab. 1997). În studiile experimentale, epuizarea GSH este indusă în mod obișnuit prin inhibarea directă a enzimelor de sinteză GSH sau în modele knockout (Akai și colab. 2007; Wu și Cederbaum 2004). Cu toate acestea, în populațiile generale care trăiesc în societăți contaminate chimic, un mecanism mai comun pentru epuizarea GSH poate fi consumul de GSH prin conjugare cu substanțe chimice sau metaboliții acestora.
Odată ce se produce epuizarea GSH, poate începe un ciclu vicios. Ca o moleculă crucială în apărarea anti-oxidantă a celulei, epuizarea GSH intracelulară provoacă o cascadă de evenimente care implică stres oxidativ, inclusiv producerea de specii reactive de oxigen/azot (Higuchi 2004). Stresul oxidativ poate suprima direct ciclul de metilare prin limitarea activității metioninei sintazei folate-dependente și a cobalaminei (Deth et al. 2008). În plus, GSH este consumat în continuare pentru a conjuga specii reactive de oxigen/azot care sunt generate din cauza stresului oxidativ, ducând la o epuizare mai mare a GSH.
Expunere de fond la amestecuri de substanțe chimice
Foarte important, soliditatea teoretică a ipotezei noastre nu necesită expunere chimică individuală la doze mari, care este de obicei necesară pentru a provoca un răspuns toxicologic clasic. De fapt, în multe țări din întreaga lume, grupurile din populația generală sunt expuse la doze foarte mici din fiecare substanță chimică, adesea sub limitele considerate în prezent sigure (Paustenbach și Galbraith 2006; Porta și colab. 2008). Cu toate acestea, conjugarea GSH poate apărea la orice doză, deoarece este un răspuns fiziologic la eliminarea „corpurilor străine”. Pentru o persoană expusă la o singură substanță chimică la o concentrație scăzută, consumul de GSH este banal. Cu toate acestea, dacă expunerea la un număr mare de substanțe chimice pentru o lungă perioadă de timp, utilizarea GSH este relevantă și epuizarea se poate întâmpla din cauza conjugării GSH.
În societățile noastre moderne, sute de substanțe chimice sunt detectate în subgrupuri semnificative ale populației, concentrațiile compușilor fiind foarte corelate (Paustenbach și Galbraith 2006). Cele mai multe astfel de expuneri apar în timpul vieții zilnice normale, ceea ce implică o expunere cronică, pe toată durata vieții. Astfel, modificările modelelor de metilare datorate expunerii de fond la amestecuri de agenți chimici sunt plauzibile. Ele pot fi mai grave atunci când coexistă deficiența nutrițională sau dezechilibrul implicat în ciclul de metilare.
O altă considerație importantă este că hipometilarea globală a ADN-ului se acumulează progresiv în timpul îmbătrânirii (Fraga și colab. 2007). În prezent, nu este clar de ce îmbătrânirea este legată de hipometilarea ADN-ului global. Cu toate acestea, epuizarea GSH ar putea fi implicată în această asociere, deoarece nivelurile GSH scad într-un număr de țesuturi în timpul îmbătrânirii prin perturbarea eficienței catalitice a glutamatului-cisteină ligază, enzima care limitează rata în sinteza GSH (Liu și colab. 2004) . În același timp în care apare această perturbare a eficienței catalitice, sarcina corporală a substanțelor chimice cu timp de înjumătățire lungă tinde să crească odată cu îmbătrânirea. Mai mult, deficiențele de vitamina B12 și folat sunt frecvente la persoanele în vârstă (Koehler și colab. 1997). Astfel, expunerea chimică, nutriția și îmbătrânirea pot interacționa reciproc sinergic, ducând în cele din urmă la hipometilare globală.
Schimbările epigenetice induse chimic pot fi moștenite de-a lungul generațiilor (Anway și colab. 2005, 2006), crescând posibilitatea ca o anumită agregare familială a bolilor cronice să fie parțial legată de expunerile chimice din generațiile anterioare. Dacă se confirmă în următorii câțiva ani, astfel de dovezi vor fi un exemplu relevant al unei provocări științifice și de sănătate publică la care poate contribui epidemiologia de mediu, permițând cercetări care integrează în mod eficient raționamente, metode și dovezi din cursul vieții, de mediu, molecular și epigenetic. epidemiologie (Porta 2008).
Poluanți organici persistenți și modificări epigenetice
Dintre substanțele chimice relevante pentru epigenomica mediului, poluanții organici persistenți (POP) sunt de o preocupare specială, deoarece se bioacumulează în țesutul adipos pe tot parcursul vieții (Abelsohn și colab. 2002). Oamenii sunt în mod obișnuit expuși la o varietate de amestecuri POP care încep în utero, în esență, deoarece aceste substanțe chimice se acumulează în lanțurile alimentare și se transferă din aportul alimentar al mamei prin placentă (Abelsohn și colab. 2002).
O altă caracteristică importantă a POP poate duce, de asemenea, la epuizarea GSH. Xenobioticele lipofile precum POP sunt secretate în bilă din ficat și sunt reabsorbite din lumenul intestinal în circulația sângelui și înapoi în ficat, suferind astfel circulație entero-hepatică (Jandacek și Tso 2001). Această caracteristică a POP este unul dintre principalele motive pentru lungul timp de înjumătățire al POP în corpul uman (Jandacek și Tso 2001). POP-urile sunt secretate în bilă conjugată cu molecule precum GSH (Bakke și colab. 1990). Astfel, reciclarea continuă a POP prin circulație enterohepatică poate duce la epuizarea cronică a GSH hepatic. De asemenea, deoarece există corelații puternice între concentrațiile serice de POP și vârstă în populația generală (Lee și colab. 2006), POP oferă exemple de substanțe chimice care pot crește sinergic riscul de hipometilare globală odată cu îmbătrânirea.
Hipometilarea globală a ADN-ului a fost asociată recent cu concentrații serice ridicate de POP în inuitii groenlandezi aparent sănătoși (Rusiecki și colab. 2008). Gradul de metilare a ADN-ului a scăzut odată cu creșterea concentrațiilor de p, p'-DDT (diclorodifeniltricloretan), p, p'-DDE (diclorodifenildicloretilenă), β-hexaclorociclohexan, oxiclordan, α-clordan, mirex, suma mai multor poligen-chyly, și suma tuturor POP-urilor studiate. Chiar dacă concentrațiile lor de POP au fost mult mai mari decât cele din alte populații generale, mecanismul global de hipometilare a ADN-ului poate fi implicat în asocieri între expunerea de fond la POP și diferite boli cronice, inclusiv diabetul de tip 2, sindromul metabolic și bolile coronariene (Ha și colab. 2007; Lee și colab. 2006, 2007).
Este demn de remarcat faptul că unele pesticide organoclorurate (OC) și bifenili policlorurați (PCB) sunt încă utilizate în țările în curs de dezvoltare precum India sau China și că persistă în aprovizionarea cu alimente a tuturor țărilor. În plus, cantități mari de deșeuri municipale sunt aruncate zilnic în depozite deschise de gunoi în suburbiile marilor orașe, fără o gestionare adecvată. Un studiu recent a raportat că mediul înconjurător a prezentat niveluri extrem de ridicate de POP în comparație cu cele din siturile de control (Minh și colab. 2006). De fapt, expunerea in utero la diferiți contaminanți chimici, cum ar fi dioxinele, PCB-urile sau pesticidele OC, pot provoca rezultate negative ale sarcinii, cum ar fi greutatea redusă la naștere, nașterea prematură sau întârzierea creșterii intrauterine (Wigle și colab. 2008; Windham și Fenster 2008), care sunt atribuite în mod obișnuit subnutriției și unui viitor risc ridicat de sindrom metabolic și diabet de tip 2 în țările în curs de dezvoltare (Yajnik 2004). Modificările epigenetice datorate POP pot juca probabil un rol în epidemiile actuale ale sindromului metabolic și ale diabetului de tip 2 din țările în curs de dezvoltare, împreună cu occidentalizarea stilului de viață. Cu toate acestea, ipoteza noastră poate fi relevantă pentru orice populație cu expunere de fond la diferite substanțe chimice care sunt conjugate cu GSH.
Concluzii
În prezent, există o lipsă de studii umane integrative care iau în considerare atât substanțele chimice, cât și nutriția. Prin urmare, viitoare studii umane vor fi necesare pentru a lua în considerare influențele expunerilor chimice asupra hipometilării ADN-ului, luând în considerare factorii dietetici.
Mai ales în perioadele de alimentație în general adecvate, studiile asupra modificării epigenetice pot pierde un factor de o importanță considerabilă dacă nu iau în considerare agenții chimici. Deoarece modificările epigenetice sunt reversibile, medicamentele în curs de dezvoltare care controlează reglarea epigenetică atrag acum investiții substanțiale în cercetare, inclusiv dezvoltarea de alimente sau suplimente funcționale. Cu toate acestea, deoarece expunerea pe tot parcursul vieții la unii agenți chimici joacă probabil un rol important în modificările epigenetice de relevanță etiopatogenă pentru unele boli adulte, ar fi, de asemenea, rezonabil și eficient să se consolideze politicile publice și private care reduc expunerea la astfel de substanțe chimice.
Note de subsol
Acest studiu a fost susținut de o subvenție din partea proiectului coreean de cercetare și dezvoltare în domeniul tehnologiei sănătății, Ministerul Sănătății, Asistenței Sociale și Afacerilor Familiei, Republica Coreea (A084046).
- Aceasta; nu caloriile, ci; s substanțele chimice; Clinica de nutriție
- Punerea unei baze solide pentru strategia dvs. Ironman Nutrition
- Introducere în nutriție
- Principiul alimentar intuitiv # 2 Onorați-vă foamea - Eu trăiesc bine nutriția
- Principii nutritive intuitive pentru a simți și performa bine psihologia astăzi