Ali Canbay
Departamentul de Gastroenterologie, Hepatologie și Boli Infecțioase, Universitatea Otto-von-Guericke Magdeburg, Str. Leipziger. 44, 39120 Magdeburg, Germania
Jan-Peter Sowa
Departamentul de Gastroenterologie, Hepatologie și Boli Infecțioase, Universitatea Otto-von-Guericke Magdeburg, Str. Leipziger. 44, 39120 Magdeburg, Germania
Abstract
NAFLD: Definiții, cauze și prevalență
Boala ficatului gras nealcoolic (NAFLD) este un spectru de afecțiuni bazate pe steatoza ficatului fără consum semnificativ de alcool (≥ 20 g/zi la femei; ≥ 30 g/zi la bărbați) [1]. Ficatul gras nealcoolic (NAFL) este măsurarea acumulării de grăsime sub formă de picături lipidice în hepatocite, cu steatohepatită nealcoolică (NASH) ca formă progresivă cu inflamație lobulară și degenerare cu balonare a hepatocitelor. NAFLD și NASH sunt acum recunoscute ca manifestări hepatice ale sindromului metabolic și ca atare pe baza aportului excesiv de calorii, a activității și exercițiilor insuficiente și a depozitelor de țesut adipos rezultate. Factorii de risc pentru NAFLD includ obezitatea, diabetul zaharat de tip 2 (T2DM), hipertensiunea și dislipidemia cu sau fără enzime hepatice crescute. Există și alte cauze posibile pentru steatoza hepatică, adică Infecția cu VHC, medicamente și cauze genetice (boala celiacă, boala Wilson, deficit de lipază de acid lizozomal), care ar trebui excluse la diagnostic. Cu toate acestea, deoarece prevalența globală a NAFLD a crescut la aproximativ 25% în urma obezității pandemice [2], majoritatea cazurilor de NAFLD și NASH se datorează supraponderalității și obezității.
Fiziopatologia NAFLD și NASH
Tratamente conservatoare și farmacologice actuale ale NAFLD
tabelul 1
Componente farmacologice pentru tratamentul NAFLD sau NASH în studiile clinice de fază III.
Tabel adaptat din [10]
| Acid obeticholic | Agonistul receptorului Farnesoid-X | Îmbunătățirea sensibilității la insulină și reducerea gluconeogenezei și trigliceridelor serice |
| Elafibranor | Agonist dual pentru receptorul-α și -δ activat de proliferatorul peroxizomului | Îmbunătățirea homeostaziei glucozei și a metabolismului insulinei și reducerea inflamației. |
| Cenicriviroc | Antagonist de tip 2 și 5 al receptorilor chemokinei (motiv C-C) | Răspunsul inflamator redus la leziunile hepatocitelor de către celulele Kupffer, ulterior diminuarea fibrozei |
| Selonsertib | Inhibitor al kinazei 1 care reglează semnalul apoptozei | Reducerea inflamației hepatice, a apoptozei hepatocitelor și a fibrozei datorită stresului oxidativ |
Pe bază empirică, multiple ținte posibile pentru farmacoterapie sunt promițătoare: rezistența la insulină a ficatului și sistemic și factorii care afectează ficatul însuși. Substanțele candidate în studiile clinice de fază III sunt acidul obeticholic (acid 6-etilchenodeoxicolic), elafibranor, cenicriviroc și selonsertib (Tabelul 1). Pentru detalii despre situația actuală privind opțiunile de tratament farmacologic pentru NASH, vă rugăm să consultați revizuirea de către Alkhouri și colab. [10].
Motivul pentru LOLA ca tratament posibil pentru NAFLD
Printre numeroasele funcții ale metabolismului aminoacizilor hepatici, catabolismul și detoxifierea amoniacului sunt efectuate în hepatocite. Acestea nu au fost încă explorate ca potențiale ținte pentru tratarea NAFLD sau NASH. l -ornitină l -partat (LOLA) este un amestec de aminoacizi endogeni care ar trebui să faciliteze îndepărtarea amoniacului la pacienții cu ciroză hepatică [11]. În secțiunea următoare sugerăm o abordare ipotetică pentru tratarea modificărilor metabolice în NAFLD cu LOLA. Unele dintre efectele potențiale sunt în prezent în curs de investigare și, prin urmare, sunt doar speculative.
Efecte hepatoprotectoare cunoscute ale LOLA
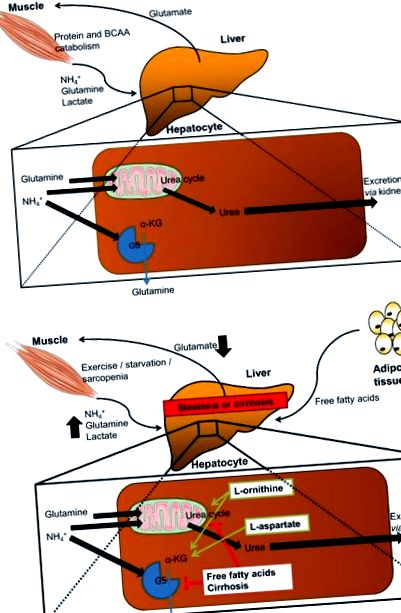
Metabolismul azotului în mușchi și alte țesuturi periferice duce la formarea amoniacului, care este transformat prin ciclul ureei în ficat și eliminat sub formă de urină [12]. Insuficiența funcției hepatice duce la creșterea concentrației de amoniac [13]. În insuficiența hepatică acută, acută-cronică și cronică, amoniacul se acumulează prin activitatea diminuată a ciclului ureei. Concentrațiile serice mari de amoniac sunt asociate cu encefalopatie hepatică (HE), apoptoză hepatocitară, inflamație, afectarea funcției hepatice și mortalitate ridicată [13, 14].
LOLA este utilizat la pacienții cu ciroză hepatică pentru ameliorarea HE minimă prin îmbunătățirea îndepărtării amoniacului în hepatocitele încă funcționale [15]. Se presupune că LOLA afectează îndepărtarea amoniacului, pe de o parte, prin sinteza crescută a ureei și, pe de altă parte, prin sinteza crescută a glutaminei prin enzima glutamină sintetază (GS) [15]. În plus, glutamatul derivat din LOLA poate fi transformat și în glutation, care este un important antioxidant pentru hepatocite. În plus față de efectele directe ale LOLA asupra ficatului datorită îndepărtării îmbunătățite a amoniacului și a capacității anti-oxidative îmbunătățite, ar putea exista efecte hepatoprotectoare indirecte datorate inversării parțiale a sarcopeniei [16] și datorită formării de oxid nitric (NO) din l-arginină, având ca rezultat îmbunătățirea microcirculației hepatice [17]. Aceste efecte putative directe și indirecte ale LOLA au fost demonstrate în studii preclinice și clinice mici, în așteptarea confirmării în studii mai mari (Fig. 1).
Generarea și detoxifierea de amoniac și ținte mecanice putative ale LOLA pentru tratamentul NAFLD. A Detoxifierea amoniacului în condiții sănătoase: amoniacul (NH3) este generat ca un produs secundar din catabolismul proteinelor și al aminoacizilor cu lanț ramificat (BCAA) și transportat sistemic ca amoniu (NH4 +). Detoxifierea NH4 + în ficat se realizează fie prin intermediul ciclului ureei, o parte din care se află în mitocondrii, fie de enzima glutamină sintetază (GS). Pentru aceste reacții, sunt necesare glutamină și α-cetoglutarat (α-KG; derivat din BCAA sau malat). b Efectele presupuse ale steatozei sau cirozei asupra detoxifierii amoniacului (roșu) și a mecanismului putativ al l -ornitinei l -partat (LOLA; verde). În ciroza, performanța ciclului ureei este diminuată și glutamina, precum și rezervele α-KG sunt epuizate, ducând la acumularea de NH4 + și efecte toxice, adică encefalopatie hepatica. Se presupune că LOLA îmbunătățește ciclul ureei prin glutamat derivat din l -ornitină și l -ornitină. Atât l-ornitina, cât și l-aspartatul pot umple rezervele de α-KG. În plus, l-ornitina ar putea fi capabilă să furnizeze capacitate anti-oxidativă prin refacerea glutationului și oxidul nitric derivat din l-aspartat ar putea îmbunătăți microcirculația hepatică (ambele nu sunt prezentate)
Amoniacul ca posibil contribuitor la leziunile hepatice în NAFLD
Eficacitatea LOLA în modele pre-clinice și studii de NAFLD
Până în prezent, majoritatea studiilor privind eficacitatea LOLA au fost efectuate în ciroză sau modele ale acesteia. Cu toate acestea, există câteva studii preclinice care ar putea indica un posibil efect al LOLA asupra NAFLD. Două studii privind ciroza experimentală și HE au descris că scăderea amoniacului a îmbunătățit sarcopenia la șobolanii cirotici Sprague-Dawley prin stabilizarea metabolismului aminoacizilor [22] și că tratamentul LOLA a dus la o creștere semnificativă a glutaminei plasmatice, care probabil a derivat din l -ornitină prin GS [23]. Glutamina s-a dovedit a fi protectoare în modelele preclinice ale NAFLD și NASH, posibil prin reducerea stresului oxidativ [24, 25]. Dovezi indirecte sugerează că LOLA ar putea diminua leziunile hepatice în NAFLD prin reducerea amoniacului și a stresului oxidativ.
Sumar si CONCLUZII
Datele actuale susțin rolul crucial al amoniacului în bolile hepatice avansate. Datele din modele preclinice și dintr-un număr mic de studii clinice susțin teza că LOLA are proprietăți hepatoprotectoare în ciroză. La pacienții cu NAFLD sau NASH, LOLA pare să reducă concentrațiile serice de enzime hepatice și trigliceride. Mecanismele putative pentru efectul LOLA în NAFLD sunt îndepărtarea amoniacului sporită, capacitatea anti-oxidativă crescută și peroxidarea lipidică atenuată de glutamină și glutation, microcirculația hepatică îmbunătățită datorită NO-derivat din l-arginină Aceste efecte ar trebui investigate în medii clinice bine controlate pentru a demonstra dacă LOLA ar putea fi un tratament fezabil pentru NAFLD sau NASH.
Note
Finanțarea
Acest articol este publicat într-o ediție specială supliment suplimentar jurnal finanțat integral de Merz Pharmaceuticals GmbH, Frankfurt, Germania.
Note
Conflict de interese
Prof. Ali Canbay a primit un grant de cercetare de la MERZ și a primit taxe de vorbire de la MERZ, Falk, Shire și GILEAD. Jan-Peter Sowa declară că nu are niciun conflict de interese.
- L-Ornitină L-aspartat pentru tratamentul sarcopeniei în boli hepatice cronice
- Pulbere de L-Ornitină L-Aspartat de la furnizor cu ridicata - Profoods Nutrition
- Liv 52 recenzii, dozare, beneficii în ficatul gras, îngrijirea ficatului în culturism
- Boala inflamatorie a intestinului Diareea de dimineață Cunoașteți simptomele, cauzele și prevenirea
- HOCATT ™ Forma Ozonoterapiei; Beauty Port Elizabeth