Suman Ranjit
1 Laborator pentru dinamica fluorescenței, Departamentul de Inginerie Biomedică, Universitatea din California, Irvine, CA, SUA
Alexander Dvornikov
1 Laborator pentru dinamica fluorescenței, Departamentul de Inginerie Biomedică, Universitatea din California, Irvine, CA, SUA
Evgenia Dobrinskikh
2 Departamente de Medicină, Universitatea Colorado-Anschutz Medical Campus, Aurora, Colorado, SUA
Xiaoxin Wang
2 Departamente de Medicină, Universitatea Colorado-Anschutz Medical Campus, Aurora, Colorado, SUA
Yuhuan Luo
2 Departamente de Medicină, Universitatea Colorado-Anschutz Medical Campus, Aurora, Colorado, SUA
Moshe Levi
2 Departamente de Medicină, Universitatea Colorado-Anschutz Medical Campus, Aurora, Colorado, SUA
Enrico Gratton
1 Laborator pentru dinamica fluorescenței, Departamentul de Inginerie Biomedică, Universitatea din California, Irvine, CA, SUA
Abstract
Abordarea fazorică a imaginii cu autofluorescență pe durata vieții a fost utilizată pentru a identifica și caracteriza o specie cu durată lungă de viață (LLS) (
7,8 ns) la ficatul șoarecilor hrăniți cu o dietă occidentală. Mărimea suprafețelor care conțin această specie LLS depinde de tipul dietei, iar distribuția mărimii arată că dieta occidentală are dimensiuni LLS mult mai mari. Combinația de imagini de a treia generație de armonici cu FLIM a identificat speciile LLS cu picături de grăsime și a fost estimată distribuția dimensiunii picăturilor. A doua microscopie de generație armonică combinată cu FLIM fazor arată că există o creștere a fibrozei cu o dietă occidentală. O nouă descompunere în trei componente ale graficului fazor arată că o dietă occidentală este corelată cu o fracțiune mai mare de NADH liber, ceea ce înseamnă o stare mai redusă și o stare mai glicolitică. Analiza multiparametrică a distribuției fazorului arată că, din distribuția punctelor fazorale, se poate separa o dietă occidentală hrănită față de o dietă cu conținut scăzut de grăsimi hrănite cu ficți de șoareci. Abordarea fazorică pentru analiza imaginilor FLIM ale autofluorescenței la specimenele de ficat poate duce la descoperirea de noi specii fluorescente și apoi aceste noi specii fluorescente pot ajuta la evaluarea arhitecturii țesuturilor. În cele din urmă, integrarea FLIM și a doua și a treia analiză armonică oferă o măsură a progresului fibrozei ca efect al dietei.
1. Introducere
7,8 ns) găsite în picăturile de grăsime din țesuturile hepatice rezultate din dieta occidentală. Anterior, această specie de lungă durată a fost observată în celulele hrănite cu acid oleic sau când celulele sunt sub hipoxie pentru a produce specii reactive de oxigen (ROS) sau în țesuturile adipoase de șoarece [22, 23]. Semnătura Raman pentru trigliceride coincide cu prezența acestei specii LLS în aceste picături sub tratament cu acid oleic [22]. Oxidarea ROS a moleculelor de grăsime este cauza probabilă a formării LLS și aici am folosit acest semnal LLS pentru a identifica și distinge efectul dietei occidentale asupra secțiunilor de țesut hepatic.
Microscopul utilizat pentru măsurătorile noastre se bazează pe un detector de direcție directă în care datele sunt achiziționate în direcția de excitație și este extrem de sensibil pentru imagistica armonică [24-26]. În lucrarea descrisă în această lucrare, am folosit imagistica a treia generație de armonici, care este deosebit de sensibilă la limitele picăturilor de grăsime pentru a arăta că componenta LLS coincide cu picăturile [27]. De asemenea, am folosit o abordare combinatorie a FLIM și a doua generație de armonici (SHG) pentru a cuantifica gradul de fibroză din țesuturile hepatice [28-32].
2. Metode
2.1 Modelul animalului și pregătirea feliei de țesut
Șoareci masculi C57BL/6J de 8 săptămâni au fost obținuți de la Jackson Labs. Aceștia au fost hrăniți cu o dietă de control echivalentă cu conținut scăzut de grăsimi (LF, 10 kcal% grăsime) sau o dietă occidentală (WD, 42 kcal% grăsime din lapte, 34% zaharoză, 0,2% colesterol) timp de 6 luni. Studiile pe animale și protocoalele relative au fost aprobate de Comitetul de îngrijire și utilizare a animalelor de la Universitatea din Colorado Denver. Toate experimentările pe animale au fost efectuate în conformitate cu Ghidul pentru îngrijirea și utilizarea animalelor de laborator (National Institutes of Health, Bethesda, MD).
La sfârșitul perioadei de hrănire șoarecii au fost anesteziați și ficății au fost îndepărtați și prelucrați congelați în compusul OCT (Temperatura optimă de tăiere) sau fixat în formalină și încorporat parafină (FFPE). Țesutul a fost feliat în 5 secțiuni groase de 5 m și această secțiune a fost montată pe o lamă. Compusul OCT a fost îndepărtat folosind tampon DPBS (ThermoFisher Scientific, Waltham, MA) și felia a fost montată pe o lamă de acoperire folosind același tampon. Feliile de parafină s-au imaginat cu secționarea optică după lamele de „suport” la 60 ° C fără îndepărtarea în continuare a parafinei cu xilen și etanol.
2.2 Achiziționarea datelor: abordare DIVER și fazorică a FLIM
2.3 Analiza datelor
2.3.1 Analiza fazorului
Semnalele fluorescente și armonice colectate din fiecare punct al imaginii au fost transformate în spațiul fazor folosind următoarea transformare [20, 33, 34]
unde, si, j (ω) și gi, j (ω) sunt coordonatele Y și X în diagrama fazorului, respectiv; ω este frecvența de repetare a sursei laserului în radiani, T este perioada frecvenței de repetare a laserului și n este frecvența armonică. Ii, j este degradarea intensității măsurată la fiecare pixel din imaginea optică originală. Fluorescența colectată de la fiecare pixel al unei imagini este transformată într-un punct din diagrama fazorului. Modificările în metabolism și acumularea de lipide datorate modificărilor dietei pot schimba poziția punctelor fazorale și modelul de distribuție generală a graficului fazoric. Un set de puncte de fazor poate fi apoi ales cu ajutorul unui cursor colorat, iar imaginea corespunzătoare poate fi colorată corespunzător. Descriem mai multe moduri diferite de a analiza distribuția fazorului pentru a cuantifica diferite specii din țesutul observat.
2.3.2 Calculul dimensiunii picăturilor lipidice
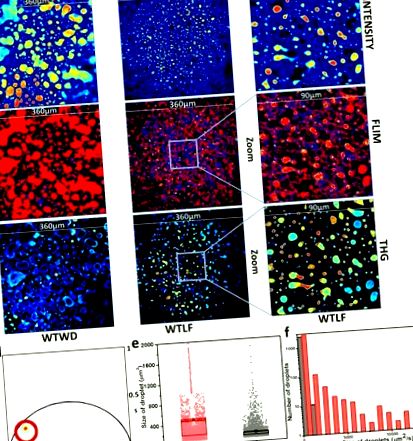
Locația speciilor cu durată lungă de viață în graficul fazor a fost selectată cu cursorul roșu și imaginile FLIM au fost colorate corespunzător (Fig. 1 (d)). Specia LLS este prezentă numai în picăturile de lipide. Astfel, dimensiunea picăturilor poate fi măsurată prin măsurarea dimensiunii ariei imaginilor acoperite de LLS. Există un număr mare de picături de dimensiuni foarte mici, care sunt de obicei prezente în țesuturile hepatice. O prag de> 85 µm 2 în distribuția mărimii pentru picăturile de grăsime are ca rezultat o mai bună separare a imaginilor de țesuturile hepatice ale dietei occidentale bogate în grăsimi și ale celei slabe de control al grăsimilor. Dimensiunile picăturilor pot fi apoi reprezentate printr-un grafic cutie sau prin histograme (Fig. 1 (e) și 1 (f). Graficul cutiei arată cum se modifică deviația medie și standard a dimensiunii picăturilor în funcție de tipul Histograma arată cum picăturile pentru dieta occidentală se extind la dimensiuni mult mai mari decât cele observate pentru probele de dietă cu conținut scăzut de grăsimi.
Efectul dietei asupra dimensiunii picăturilor de lipide. (a) Imagini reprezentative de intensitate a fluorescenței, (b) imagini FLIM cu autofluorescență și (c) imagini de a treia generație de armonici (THG) din probe de dietă grasă (WD) și, respectiv, de dietă fără grăsimi (LF). FOV este de 360 µm. Imaginile zoomate (90µm) (panoul din dreapta) de intensitate (a) FLIM (b) și THG (c) arată că semnalele LLS de la șoarecii cu dietă LF probe de țesut hepatic coincid cu picături foarte mici. Aceste imagini sunt realizate prin zoom în imaginile LF (360 (m) corespunzătoare. (d) Graficul fazor al imaginilor FLIM ale ficatului. Cursorul roșu a fost utilizat pentru a selecta speciile de viață lungă (LLS) în diagrama fazorului și imaginile FLIM au fost colorate în consecință cu fazori selectați de cursul roșu. (e) Boxplot care descrie media (pătratul mic umplut) și deviația standard (partea de sus și de jos a cutiei) pentru probele WD (roșu) și LF (negru). Punctele reprezintă măsurători individuale din fiecare imagine. (f) Histograma dimensiunilor picăturilor peste 85 µm 2. Roșu și gri reprezintă probe WD și respectiv LF. Valoarea p pentru testul Kolmogorov-Smirnov (K-S) pentru datele din panoul e și f a fost mai mică de 0,0001.
2.3.3 Calculul fracției de NADH liber și legat
Combinația și localizarea componentelor fazorului în analiza FLIM este guvernată de legea adăugării fazorului [20]. Conform acestei legi, poziția unui punct fazor care rezultă din degradarea fluorescenței la un anumit pixel al unei imagini poate fi urmărită înapoi la pozițiile fazorice ale componentelor responsabile de fluorescență în acel punct particular. Legea adăugării fazorului dictează că contribuțiile relative ale a două sau mai multe puncte fazorale către un alt punct dintre ele sunt invers proporționale cu distanțele dintre punctul din mijloc și punctele lor fazor corespunzătoare [20]. Imaginile FLIM pentru ficatul dietei occidentale au o semnătură fazorală în canalul NADH, care este rezultatul speciilor lor originale care contribuie. Imaginile realizate cu filtrul NADH au contribuția NADH gratuit (
0,4 ns), NADH legat (3,4 ns) și speciile de viață lungă
8 ns). Aceste trei componente au fost alese cu cursoare verzi, albastre și roșii, respectiv în Fig. 2 (a). Fracțiile individuale pot fi calculate în funcție de poziția punctelor fazorului din interiorul triunghiului determinată de cursorii roșu, verde și albastru.
Descompunerea graficului fazor folosind trei componente (a) Locația a trei componente în distribuția fazorului utilizată pentru separarea diferitelor contribuții sunt afișate și roșu, verde și albastru reprezentând LLS, NADH legat și respectiv, liber. Punctul negru reprezintă un punct din distribuția fazorică a cărei fracție este mapată utilizând ecuațiile descrise în secțiunea Metode. (b) Modificări ale fracției de NADH liber și (c) fracției din speciile LLS pentru dieta cu conținut scăzut de grăsimi (negru) și, respectiv, vest (roșu). Barele de eroare din panourile b și c corespund abaterii standard a 9 eșantioane independente pentru fiecare stare dietetică și liniile continue corespund cu media celor 9 eșantioane independente pentru fiecare stare.
Având în vedere un punct experimental de coordonate g și s (punct negru, Fig. 2 (a)), dacă sunt prezente doar 3 specii într-un eșantion (NADH și LLS libere și legate) punctul trebuie să cadă în triunghi cu roșu, verde și colțuri albastre. Apoi regula adăugării fazorului a fost utilizată pentru a determina cantitatea relativă de fracțiune NADH și LLS liberă, după cum urmează. S-a trasat o linie care trece prin punctul roșu și negru și această linie a fost interceptată cu linia dintre punctele verzi și albastre. Punctul de interceptare este utilizat pentru a determina concentrația relativă de legat la liber folosind raportul
Fracția de LLS a fost obținută folosind raportul
Am folosit această descompunere pentru a transforma distribuția punctelor fazorului la distribuția NADH liber și legat. Raportul dintre NADH liber și legat este legat de raportul NAD +/NADH din țesut și, astfel, distribuția liberă și legată a NADH este o măsură a modificărilor metabolismului. După scăderea efectului speciei LLS, se poate compara distribuția reală a NADH liber la legat din probele de dietă occidentală și cu conținut scăzut de grăsimi și se pot evalua modificările metabolismului.
2.3.4 Analiza multiparametrică a distribuției fazorilor
Distribuția punctelor fazor originare dintr-o imagine FLIM este o amprentă a imaginii și este deosebită pentru imaginea corespunzătoare. Diferența în distribuția fazorului între diferite seturi de date se distinge adesea prin schimbări în poziția medie a punctelor fazorului. Cu toate acestea, de multe ori poziția medie nu este suficientă pentru a descrie schimbările în distribuția fazorului. Anterior, am dezvoltat o abordare multiparametrică pentru analiza distribuției fazorale [30]. Pentru clarificarea analizei utilizate în lucrare, această abordare este descrisă din nou mai jos. În primul rând, histograma din distribuția fazorului este împărțită în patru înălțimi egale pe baza înălțimii maxime a histogramei de distribuție fazorală. Apoi, pentru fiecare segment, cinci parametri, inclusiv media (g), media (s), lungimea (a) și lățimea (b) distribuției (considerând-o ca elipse) și unghiul distribuției (θ) se calculează pe baza moment spațial al distribuției.
Momentul spațial al distribuției a fost calculat din pozițiile punctului fazor individual:
unde, I (g, s) este valoarea histogramei fazorului în poziția g și s. Momentul central este apoi calculat folosind următoarea relație:
unde, p, q și f (g, s) sunt indicii care indică rangul momentului, respectiv. Această analiză utilizează momente până la rangul 2.
Unghiul este calculat folosind:
În cele din urmă, forma distribuției este calculată din valoarea axei majore (a) și a celei minore (b):
Apoi, acești parametri multipli au fost combinați pentru a crea un spectru care corespunde acelei distribuții de fazori. În cele din urmă, cele două seturi diferite de distribuții fazorale care aparțin dietei occidentale și imaginile hepatice cu conținut scăzut de grăsimi sunt comparate prin adăugarea unui set de parametri de potrivire pentru fiecare dintre componente. Odată ce valoarea acestor parametri de ajustare este determinată pentru cea mai bună separare între dieta occidentală și dieta cu conținut scăzut de grăsimi, curba caracteristică de funcționare a receptorului (a fost calculată curba ROC și diferiți parametri statistici, inclusiv aria de sub curbă (valoarea ASC), adevărat și fals ratele pozitive, sensibilitatea și rata de predicție pozitivă pot fi calculate și diferitele probe de țesut pot fi comparate [30]. Datele prezentate aici au folosit parametrii g, s, a, b pentru comparație.
2.3.5 A treia microscopie de generare a armonicilor
A treia generație de armonici rezultă din modificările bruște ale indicelui de refracție la limitele țesutului. În acest proces, lumina emisă are o treime din lungimea de undă în comparație cu lungimea de undă de excitație. În țesuturi, există o schimbare mare a indicelui de refracție la limita picăturilor lipidice și aceste picături generează un semnal puternic THG [27]. În această lucrare, THG a fost folosit pentru a arăta că speciile LLS din imaginile FLIM se suprapun cu picăturile de lipide. Acest lucru este prezentat în mod specific pentru imaginile mărite pentru ficatul cu dietă cu conținut scăzut de grăsimi, unde imaginile mărite arată că aceste mici pete LLS aparțin de fapt picăturilor de lipide.
2.3.6 Fibroza imagistică cu a doua generație de armonici
3. Rezultate
3.1 Dimensiunea calculului picăturii
Imaginile de intensitate a fluorescenței sunt prezentate în Fig. 1 (a). Aceste imagini FLIM au fost mapate în culori (Fig. 1 (b)) după ce specia cu viață lungă (LLS) din graficul fazor a fost selectată cu cursorul roșu (Fig. 1 (d)). O comparație între aceste imagini FLIM codificate prin culoare și a treia imagine armonică (Fig. 1 (c)) arată că LLS se suprapune de fapt cu semnalul THG, demonstrând că speciile LLS sunt prezente în picăturile de lipide. Probele cu dietă cu conținut scăzut de grăsimi (LF) au fost mărite (FOV 90 µm) pentru a arăta că LLS este de fapt coincident cu semnalul THG. Figura 1 (b) prezintă imagini FLIM reprezentative din dieta occidentală și, respectiv, cu conținut scăzut de grăsimi. Această comparație arată, de asemenea, că dimensiunile picăturilor sunt mult mai mari pentru șoarecii din dieta occidentală. De asemenea, sunt prezentate o comparație de dimensiuni folosind o histogramă și o cutie (Fig. 1 (e), 1f). Graficul cutiei arată în mod clar că dimensiunile medii ale picăturilor de lipide sunt mult mai mari decât dimensiunile picăturilor șoarecilor cu dietă cu conținut scăzut de grăsimi. Histogramele arată că picăturile de grăsime au o distribuție globală de dimensiuni mari. Cu toate acestea, picăturile mai mari sunt prezente doar pentru șoarecii din dieta occidentală. Mediile a opt imagini pentru șase animale sunt reprezentate în fig. 1 (e) și abaterea standard a imaginilor a fost utilizată pentru boxplot.
3.2 Analiza fazorului cu 3 componente
3.3 Analiza multiparametrică
Indicele de separare multiparametrică utilizând distribuția fazorală ca amprentă a imaginilor de țesut este prezentat în Fig. 3 (a). Parametrii utilizați pentru separare au inclus media g, s, a, b. Figura 3 (a) arată separarea dintre probele de șoareci cu conținut scăzut de grăsimi (negru) și dieta occidentală (roșie). În această metodă, cea mai bună separare se realizează atunci când punctele roșii nu se suprapun cu cele gri închis; separarea este foarte bună și gradul de separare poate fi văzut din zona de sub curbă (Fig. 3 (b)) care este 1,0. Valoarea ASC ridicată determină separarea realizată prin analiza formei graficului fazor între diete și aceasta este transmisă de următorii parametri statistici, inclusiv precizia (0,98), specificitatea (0,97), sensibilitatea (1,00), valoarea de predicție pozitivă (0,96) și rata pozitivă adevărat/fals (1,00/0,03).
- Cum funcționează dieta funcția creierului Biostrap
- Identificarea pacienților cu boală hepatică grasă nealcoolică cu fibroză activă prin măsurare
- Funcția hepatică și necroza hepatică datorită dietei deficitare SpringerLink
- Mickey Mehta Am adoptat tendințele dietei occidentale în loc de indian - Știri despre stilul de viață
- Efectul inhibitor al extractului de caprifoi albastru asupra ficatului gras indus de diete bogate în grăsimi la șoareci